核转录因子、c MY C在弥漫大B细胞淋巴瘤亚型中的表达及意义
肖建波 刘卫东 李海丽 王轶楠 马守东 赵 郁 王钧 刘金慧
河北省唐山市人民医院放化疗科,河北 唐山 063000
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphomas,DLBCL)是非霍奇金淋巴 瘤(non-Hodgkin lymphoma,NHL)中最常见的一种亚型,占NHL的30%~40%,是一种异质性很强的疾病,在临床表现、组织形态和预后等多方面都具有很大差异。因此Alizadeh等[1]根据基因表达谱不同,将DLBCL分为生发中心型(germinal center B-cell-like,GCB)和活化 B 细胞型(activated B-cell-like,ABC)。 但由于受技术条件的限制,基因芯片技术尚无法在临床中普遍应用。2004年Hans等[2]应用免疫组化的方法,通过检测淋巴瘤组织中CD10、BCL6和MUM1的表达情况进行分型,分为生发中心型(GCB)和非生发中心型(non-GCB,ABC)两个亚型。该免疫组化分型与基因芯片的分型结果具有较高的符合率,其中GCB型为71%,非GCB型为88%。在2008年WHO造血和淋巴组织肿瘤分类方案中,建议可用免疫组化方法对DLBCL进行分型。近年研究发现,DLBCL的两种亚型在预后上有很大差别,这与两种亚型的细胞遗传学不同有关,临床表现在蛋白表达不同。其中核转录因子κB(nuclear transcription factor κB,NF-κB) 及原癌基因 cMYC 在 DLBCL 淋巴瘤的发生发展中起重要作用,本研究拟探讨NF-κB p65、cMYC在DLBCL不同亚型之间的表达情况及临床意义。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 收集57例唐山市人民院2008年1月~2012年5月收治的DLBCL患者淋巴结组织蜡块,全部重新复查淋巴结蜡块材料良好,同时上述患者均经HE及免疫组织化方法确诊。通过免疫组织化学方法检测CD10、BCL6和MUM1表达情况,若 CD10和(或)BCL6(+)判定为 GCB 型,若 MUM1(+)判定为ABC型。
1.1.2 病历资料 57例患者中,男29例,女28例,年龄 17~72 岁,平均年龄(45±6)岁;国际预后指数(intemational pmgnostic index,IPI)评分 0~2 分 31 例,3~5分26例;临床分期Ⅰ、Ⅱ期23例,Ⅲ、Ⅳ期34例;GCB型24例,ABC型33例。本组病例随访时间8~42 个月,平均(23±2)个月。
1.2 免疫组化方法及阳性结果判定
患者淋巴结组织蜡块标本经10%中性福尔马林溶液固定,常规脱水,石蜡包埋,4 μm厚切片,切片常规脱蜡水化;0.3%H2O2阻断内源性过氧化物酶,10%小牛血清封闭切片,滴加一抗,4℃过夜。PBS洗后滴加广谱生物素化二抗(1∶200),SP 复合物(1∶200),DAB显色,苏木精复染胞核,脱水,透明,封片。分别设相应的阳性、阴性、空白对照。NF-κB p65及cMYC的主要阳性染色部位在细胞核和细胞浆。NF-κB p65及cMYC阳性表达为棕黄色或棕褐色细小颗粒。用已知阳性片为阳性对照,所有病理标本切片用PBS液代替一抗作阴性对照。阳性反应为细胞浆内或细胞核内出现黄色或棕黄色颗粒。阳性反应为细胞浆内或细胞核内出现黄色或棕黄色颗粒,阳性反应细胞>10%为阳性结果。
1.3 统计学方法
采用统计软件SPSS 13.0对实验数据进行分析,计量资料数据以均数±标准差()表示,采用t检验。计数资料以率表示,采用χ2检验。生存分析采用Kaplan-Meier生存分析和Log Rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 NF-κB p65、cMYC在 DLBCL组织中的蛋白表达情况
57例 DLBCL患者中 34例表达 NF-κB p65占59.6%。24例GCB亚型中,10例表达NF-κB p65占41.7%。33例ABC亚型,24例表达NF-κB p65占分别为72.7%。NF-κB p65在ABC亚型中的表达明显高于 GCB亚型,差异有统计学意义(χ2=5.569,P=0.029)。31例表达cMYC占54.4%。24例GCB亚型中,9例表达 cMYC占 37.5%,33例 ABC亚型,22例表达了cMYC占66.7%。cMYC在ABC亚型中的表达明显高于 GCB 亚型,差异有统计学意义(χ2=4.765,P=0.035)。见表1。
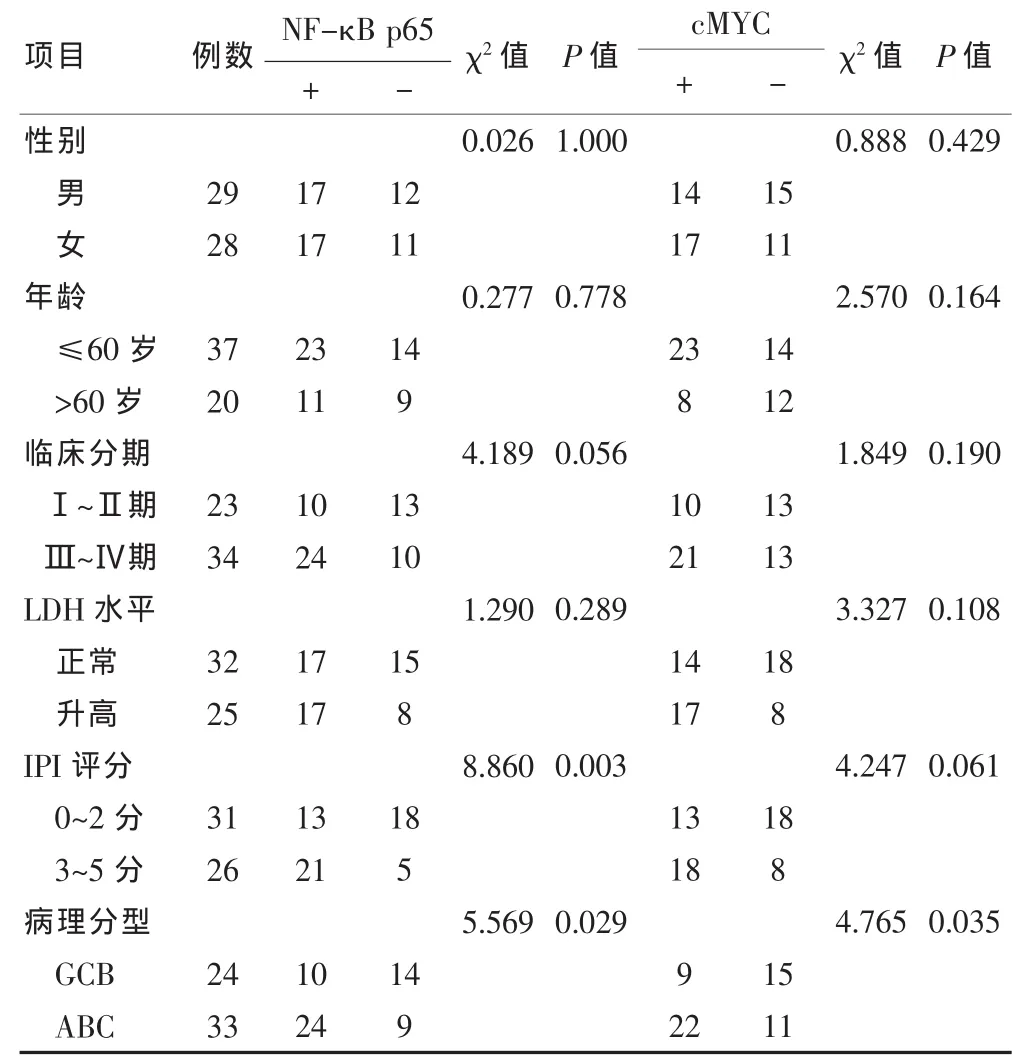
表1 NF-κB p65、cMYC阳性表达与临床特征的关系(例)
2.2 NF-κB p65、cMYC在 DLBCL组织中的蛋白表达与临床特征的关系
57例DLBCL组织NF-κB p65的表达在不同年龄(≤60 岁、>60 岁)、性别(男、女)、分期(Ⅰ、Ⅱ期和Ⅲ、Ⅳ期)及不同乳酸脱氢酶(LDH)(正常、升高)组间表达差异无统计学意义(P>0.05)。NF-κB p65在IPI 0~2分组阳性表达率为41.94%,3~5分组阳性表达率为 80.77%,表达差异有统计学意义(χ2=8.860,P=0.003);NF-κB p65在ABC及GCB亚型组织中的阳性表达率分别为72.7%、41.6%,差异有统计学意义(χ2=5.569,P=0.029)。IPI是影响DLBCL预后的独立危险因素,ABC及GCB两种亚型淋巴瘤预后不同,而NF-κB p65在不同IPI及病理亚型组间表达均不同,提示NF-κB p65很可能与预后有关。cMYC的表达在不同年龄(≤60 岁、>60 岁)、性别(男、女)、分期(Ⅰ、Ⅱ期和Ⅲ、Ⅳ期)、LDH(正常、升高)及IPI组间表达差异无统计学意义。在ABC及GCBL亚型组织中的阳性表达率分别为66.7%、54.4%,差异有统计学意义(χ2=4.765,P=0.035)。两种病理亚型预后不同,进而推测cMYC的表达很可能与预后相关。见表1。
2.3 Kaplan-Meier生存分析
全部 DLBCL及 GCB亚型患者,NF-κB p65和(或)cMYC的阳性/阴性表达,患者的生存曲线差异无统计学意义(P>0.05),提示 NF-κB p65及 cMYC 的表达与DLBCL及GCB亚型患者生存不相关。在ABC亚型中,NF-κB p65阳性表达组生存率低于阴性表达组(P=0.043)(图1)。cMYC阳性表达组生存率低于阴性表达组(P=0.024)(图 2)。 提示 NF-κB p65 或cMYC的蛋白表达可能是影响ABC亚型预后的重要不利因素。
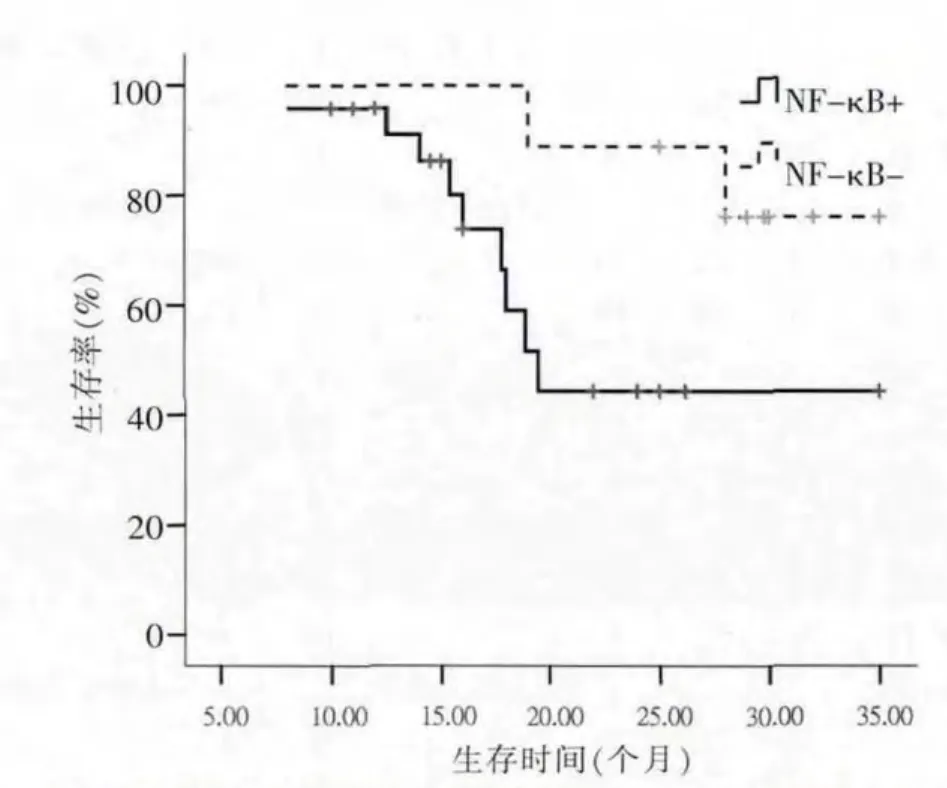
图1 33例ABC亚型患者NF-κB p65+/-表达组的生存曲线
3 讨论
DLBCL是常见的NHL之一,尽管美罗华为基础的化疗方案在DLBCL中取得了很大成功,然而高危患者的预后仍然较差,尤其是在ABC亚型治疗效果不佳。在临床工作中,识别特殊患者进行规范的分层治疗,成为一个亟待解决的问题。
目前,IPI是公认的DLBCL的独立不良预后因素,IPI为3~5分患者预后明显差于0~2分患者,许多学者提出以此进行分层治疗,最近有文献报道NF-κB与IPI同为DLBCL的独立不良预后因素,NF-κB阳性表达预后差[3]。NF-κB是广泛存在于真核生物细胞内的一种可诱导的转录因子家族蛋白,与淋巴瘤的发生、发展密切相关。董佑红等[4]报道DLBCL患者组织中NF-κB的表达与IPI评分相关,本研究也发现了NF-κB在DLBCL组织中表达,NF-κB p65的表达率为59.6%,并且高IPI评分组NF-κB p65阳性表达率高,与报道相似,近而推测 NF-κB表达很可能是影响DLBCL的一个不利因素。
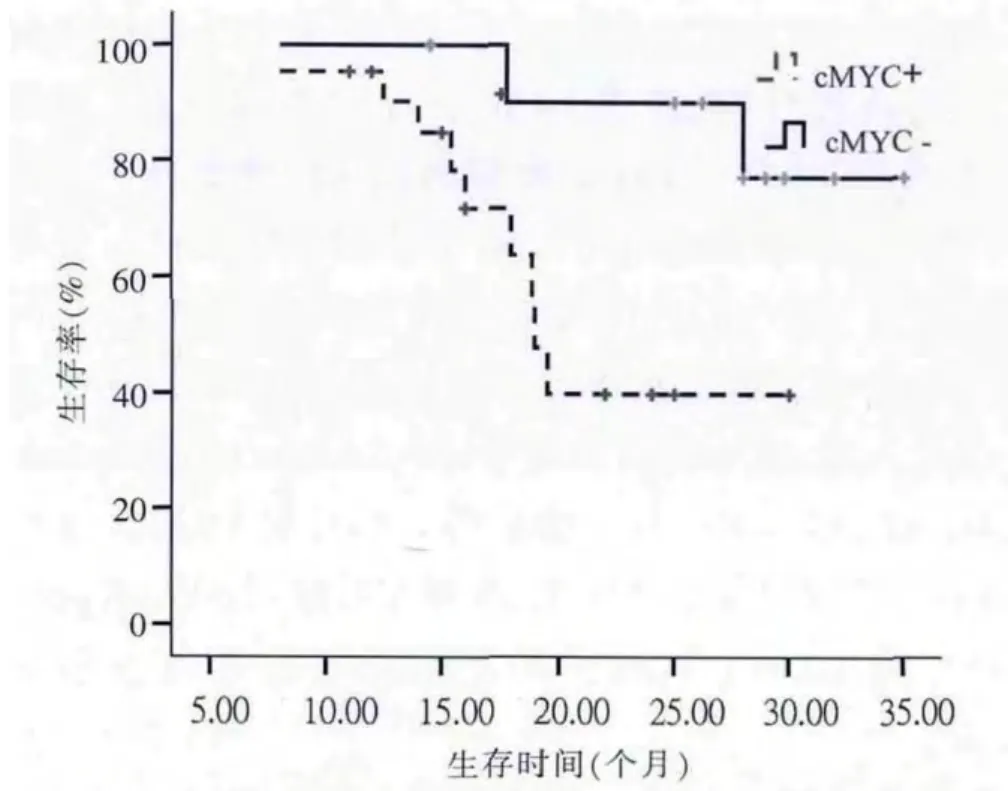
图2 33例ABC亚型患者cMYC+/-表达组的生存曲线
研究发现NF-κB在DLBCL的不同亚型中,表达的临床意义不同,与ABC亚型预后不良有关[5]。Davis等[6]应用IκBα的特异性抑制剂阻断NF-κB通路后发现ABC亚型组的细胞出现快速的凋亡,而GCB亚型组细胞不受影响,提示NF-κB活化与ABC亚型DLBCL的增殖有关。孟伟等[7]报道NF-κB在ABC亚型中表达高于GCB型。NF-κB在ABC亚型DLBCL中的意义可能不同于GCB亚型。本研究NF-κB p65在ABC、GCB亚型组的表达率分别为 72.7%、41.6%,ABC亚型表达率明显高于GCB亚型。生存分析发现,在ABC亚型DLBCL中,NF-κB p65阳性与阴性表达组的生存曲线明显不同,阳性组生存率低于阴性表组,差异有统计学意义。但在GCB亚型中,本研究并未观察到类似现象,提示NF-κB p65很可能是ABC亚型DLBCL的不利预后因素。
MYC基因是位于8q24的原癌基因,对细胞增殖、生长、分化、凋亡及促进新生血管形成等方面发挥重要作用[8]。许多国内外研究表明cMYC基因异常与NHL的不良预后相关,MYC重排是独立于IPI的不良预后因子[6-9]。cMYC基因异常与DLBCL预后密切相关,可作为预测DLBCL的预后因素并指导治疗[9]。MYC基因重排是Burkitt淋巴瘤的特征,也发生在5%~10%的DLBCL患者中。近年来发现DLBCL患者的一个重要的危险因素是MYC易位,特别是它与BCL-2易位相连接时,预后极差。Johnson等[10]和Shimin等[11]研究发现,MYC蛋白在DLBCL的两种亚型中均有表达,当它与BCL-2共同表达时预后不佳,对标准的R-CHOP方案治疗效果差,MYC蛋白的高表达与易位相关。在DLBCL患者中,常有cMYC蛋白过表达的现象,Mossafa等[12]发现DLBCL患者中出现cMYC基因扩增,并且这些患者的预后较差。本研究也发现了cMYC在DLBCL中的表达,在ABC及GCB亚型中的表达率分别为66.7%、54.4%,差异有统计学意义。生存分析显示,在ABC亚型DLBCL中,cMYC表达阳性组与阴性组的生存曲线明显不同,阳性组生存率低于阴性组,差异有统计学意义。但在全部DLBCL及GCB亚型组并未观察到类似现象。MYC的负性预后作用在与BCL-2共表达患者中明显[10],MYC基因扩增与BCL-2基因扩增正相关,均为ABC型显著高于GCB型[13],BCL-2是 NF-κB的重要靶基因,在 ABC亚型中,常伴随NF-κB、BCL-2的过表达,由此推测在ABC亚型,cMYC的负性预后作用可能与 NF-κB、BCL-2的表达有关,但仍需进一步研究证实。
本研究发现,NF-κB p65和cMYC在ABC亚型的表达率均高于GCB亚型,在ABC亚型,它们的阳性表达均与预后差相关,它们的临床意义有相似之处。既往研究发现ABC亚型DLBCL,许多基因上调,如MYC、BCL-2、cyclinD2 等,Lim 等[14]研究发现这些基因的上调可能与NF-κB在ABC亚型中不断激活有关。由此本研究推测NF-κB p65和cMYC可能在ABC亚型的发生、发展过程中存在一定联系,但其机制仍不清楚,需待进一步研究探讨。在ABC亚型,NF-κB p65、cMYC的表达与生存密切相关,有可能成为ABC亚型新的预后指标,需在临床工作中进一步研究证实。
[1]Alizadeh AA,Eisen MB,Davis RE,et al.Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling[J].Nature,2000,403(6769):503-511.
[2]Hans CP,Weisenburger DD,Greiner TC,et al.Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J].Blood,2004,103(1):275-282.
[3]Bavi P,Uddin S,Bu R,et al.The biological and clinical impact of inhibition of NF-κB-initiated apoptosis in diffuse large B cell lymphoma(DLBCL) [J].J Pathol,2011,224(3):355-366.
[4]董佑红,伍钢,王涛,等.NF-κBp50和VEGF在弥漫性大B细胞淋巴瘤组织中的表达及其临床意义[J].中华肿瘤防治杂志,2007,14(6):436-439.
[5]王艳君,孟丹.bcl-2与NF-κB/p65在弥漫性大B细胞淋巴瘤不同亚型中表达的意义[J].白血病·淋巴瘤,2009,18(10):592-595
[6]Davis RE,Brown KD,Benlish U,et al.Constitutive nuclear factor-κB activity is required for survival of activated B-cell diffuse large B-cell lymphoma cells[J].J Exp Med,2001,194:1861-1874.
[7]孟伟,石雨薇,顾霞.PKC-βⅡ、NF-κBp50在弥漫性大B细胞淋巴瘤中的表达及其意义[J].临床与实验病理学杂志,2011,27(1):56-59.
[8]Kikuchia A,Nakamurab N,Kuze T.Characterization of de novo diffuse large B-cell lymphoma with a translocation of c-myc and immunoglobulin genes[J].Leuk Res,2008,32:1176-1182.
[9]何兰兰,严峰,刘德亮.bcl-6、p53、c-myc基因异常在弥漫大B细胞淋巴瘤中的临床意义[J].白血病·淋巴瘤,2013,22(11):661-664.
[10]Johnson NA,Graham WS, Kerry J.Savage Concurrent Expression of MYC and BCL2 in Diffuse Large B-Cell Lymphoma Treated With Rituximab Plus Cyclophosphamide, Doxorubicin, Vincristine, and Prednisone[J].J Clin Oncol,2012,30:3452-3459.
[11]Shimin H, Zijun YX,Alexander T.MYC/BCL2 protein coexpression contributes to the inferior survival of activated B-cell subtype of diffuse large B-cell lymphoma and demonstrates high-risk gene expression signatures:a report from The International DLBCL Rituximab-CHOP Consortium Program[J].Blood,2013,121:4021-4031.
[12]Mossafa H,Damotte D,Jenabian A, et al.Non-Hodgkin's lymphomas with Burkitt-like cells are associated with C-myc amplification and poor prognosis[J].Leuk Lymphoma,2006,47:1885-1893.
[13]梁艳,潘毅,房爱菊.弥漫性大B细胞淋巴瘤C-MYC基因异常分析[J].中国肿瘤临床,2013,40(9):513-516.
[14]Lim KH,Yang Y,Staudt LM.Pathogenetic importance and therapeutic implications of NF-κB in lymphoid malignancies[J].Immunol Rev,2012,246(1):359-378.

