谷氨酸棒杆菌生产L -赖氨酸的培养优化和产酸特性研究
苏会波,林海龙,罗 虎,周 勇,卢宗梅
(1.中粮营养健康研究院,国家能源生物液体燃料研发中心,国家能源生物炼制研发中心,北京 100020;2.中粮生物化学(安徽)股份有限公司,安徽蚌埠 233010)
L-赖氨酸具有促进发育、增强免疫力和提高中枢神经组织功能等生理功效,是人体和动物不能自身合成且生长必需的8种基本氨基酸之一[1-4]。目前,L-赖氨酸是世界上的第二大氨基酸品种。2012年,国内的L-赖氨酸产能约为150万 t,产量约为100万t。2013年,国内的L-赖氨酸产能增至约230万t,生产厂家有16家以上,以大成生化、宁夏伊品、中粮生化和希杰等企业为主[5]。L-赖氨酸约90%用作饲料工业中的营养强化剂,10%用作食品工业中的鲜味剂和甜味剂,以及医药行业中的药物中间体[6-9]。
目前,L-赖氨酸的研究主要集中在选育高产菌株、开发新生产工艺和优化原发酵工艺等方面。张伟国等[10]将黄色短杆菌进行诱变得到高产菌株,摇瓶发酵72h后L-赖氨酸浓度可达77~82g/L。廉少杰等[11]通过发酵温度优化,将L-赖氨酸发酵浓度从111g/L提高到151g/L。周勇等[12]对L-赖氨酸发酵培养基成分进行优化,在7L发酵罐中发酵64h后,L-赖氨酸盐酸盐浓度可达161g/L,糖酸转化率可达58.3%。在其他学者的研究中,很少对L-赖氨酸发酵培养基中的成分进行重要性分析和系统性优化。因此,作者在研究中利用谷氨酸棒杆菌进行摇瓶培养生产L-赖氨酸,通过响应面分析法和氮源优化,对发酵培养基中的成分进行了重要性分析排序和系统性优化,将L-赖氨酸浓度从 1.90g/100mL提高至2.25g/100mL[13]。为了考察优化培养基对连续发酵生产L-赖氨酸的影响,本文在5L发酵罐中对优化培养基和原始培养基连续发酵生产L-赖氨酸的菌种生长和产酸特性进行了实验研究和分析,以期能促进L-赖氨酸生产的工艺优化和效益提升。
1 材料与方法
1.1 材料与仪器
谷氨酸棒杆菌B253 上海工业微生物研究所;原始发酵培养基(g/L) 葡萄糖40、(NH4)2SO410、苏氨酸 0.2、蛋氨酸 0.1、谷氨酸 0.3、KCl 2.4、KH2PO41.2、糖蜜9.0mL、NaCl 1.6、MgSO41.8、FeCl20.8、MnSO41.0 和维生素 B 1.0;优化发酵培养基(g/L)[13]葡萄糖 40、(NH4)2SO410、苏氨酸 0.2、蛋氨酸 0.2、谷氨酸0.21、KCl 2.4、KH2PO41.2、糖蜜 15.7mL、NaCl 1.6、MgSO41.8、FeCl20.8、MnSO41.0 和维生素 B 1.0;发酵培养基用 6% 氨水将 pH 调至 6.3~6.4,121℃ 灭菌20min;以上试剂均为分析纯,国药集团化学试剂有限公司。
NBS Bioflo 115发酵罐 艾本德中国有限公司;SBA-40E生物传感分析仪检测 山东省科学院生物研究所;UV-1750紫外可见分光光度计 岛津企业管理(中国)有限公司;SW-CJ-1FD超净工作台 苏州安泰空气技术有限公司;SX-700灭菌锅 日本Tomy Digital Biology公司;5418微量台式离心机 德国艾本德股份公司;PT-15便携式pH测定仪 赛多利斯科学仪器有限公司。
1.2 实验方法
1.2.1 种子罐培养 种子培养在容积为2L的全自动发酵罐中进行,培养体积为500mL。先用pH缓冲液和饱和亚硫酸钠溶液校正pH电极和溶氧电极,然后接入菌种开始培养。培养温度为37±0.5℃,流加25%浓度氨水控制培养 pH 为 6.8~7.0,搅拌速度为600r/min,通风量为 0.5L/min。培养周期约为 15~20h,菌种 OD 值(562nm,稀释 26 倍)为 0.8~1.0 时即可接入发酵罐。
1.2.2 发酵罐培养 发酵培养在容积为5L的全自动发酵罐中进行,先用pH缓冲液和饱和亚硫酸钠溶液校正pH电极和溶氧电极,然后接入200mL培养好的种子罐菌种液开始培养,培养温度为(37±0.5)℃,流加25%浓度氨水控制培养 pH 为6.8~7.0,搅拌速度为800r/min,通风量为2.0L/min。发酵罐培养过程中,主要控制参数为葡萄糖浓度、氨基氮浓度、pH和溶氧,每3h检测葡萄糖和氨氮浓度并调整流加速度。发酵罐培养周期控制在48h左右,发酵12h后每6h检测L-赖氨酸浓度。通过流加葡萄糖溶液和(NH4)2SO4溶液调整发酵溶液中还原糖浓度和氨基氮浓度,通过调整通风量和搅拌速度保证溶液中的溶氧充足。发酵罐中溶液液位随着流加溶液增多不断升高,当液位高于2500mL时开始排料,每次排出约100mL料液,装入封口三角瓶内于4℃冷藏,停罐时测量排料体积和L-赖氨酸含量。
1.3 分析方法
1.3.1 pH测定 PT-15便携式pH测定仪检测。
1.3.2 OD值测定 发酵液稀释26倍后,用 UV-1750紫外可见分光光度计检测562nm处吸光度。
1.3.3L-赖氨酸和还原糖测定 SBA-40E生物传感分析仪检测。
1.3.4 氨基氮测定 Dual Star氨氮测量仪检测。
1.3.5 总酸计算 总酸(g)=L-赖氨酸浓度(g/mL)×发酵液体积(mL)。
1.3.6 糖酸转化率计算 糖酸转化率(g酸/g糖)=产酸总量(g)/原料总糖(g)。
2 结果与讨论
2.1 菌种培养
接入种子罐的菌种液 OD值为 0.091,pH为6.89。接入种子罐后,种子罐发酵液的初始OD值为0.026,初始还原糖浓度为 3.9g/100mL,初始氨基氮浓度为0.345g/100mL,初始 pH 为6.33。发酵过程中通过流加50%浓度葡萄糖溶液确保还原糖浓度不低于0.3g/100mL。种子培养液中的菌种生长情况(OD值)、还原糖消耗和pH变化情况如图1所示。
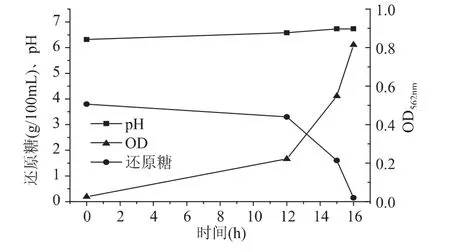
图1 种子培养的OD值、还原糖消耗和pH变化Fig.1 OD、reducing sugar consumption and pH of seed culture
从图1可知,种子罐中的pH开始调整后,基本稳定在6.8~7.0。发酵开始到12h期间,菌种溶液 OD值从初始的0.026增加到0.224。还原糖消耗相对较少,仅从3.8g/100mL 降低到 3.3g/100mL。这是因为接种后菌种需要适应新的发酵环境,新陈代谢和自身生长缓慢,碳源消耗速度相对较低。发酵12h到15h期间,菌种处于快速生长时期,OD值迅速增加到0.549,同时消耗大量还原糖,还原糖浓度快速降低到1.6g/100mL。发酵16h 时,菌种溶液 OD 值为 0.815,满足发酵罐接种要求。此时,还原糖浓度为0.15g/100mL,利用率达96%,种子液中L-赖氨酸浓度为 1.86g/100mL。
种子罐中的氮源消耗如图2所示。从图2可知,种子液培养过程中氮源消耗较少,氨基氮仅从初始浓度 0.345g/100mL 下降到终点浓度 0.265g/100mL。这是因为初始培养基中含较丰富(NH4)2SO4,菌种培养刚刚进入对数生长期,未能大量消耗溶液中的氮源。另外,培养过程中因调节溶液pH需流加一定量的氨水,也可以作为氮源被利用。
2.2 发酵参数控制
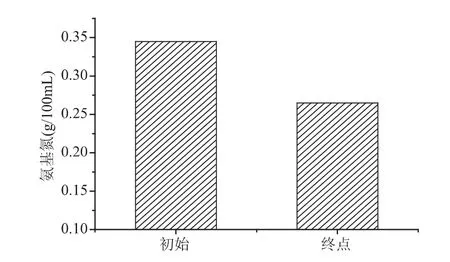
图2 种子培养的氮源消耗Fig.2 Nitrogen source consumption of seed culture
谷氨酸棒杆菌连续发酵生产L-赖氨酸过程中,需要控制的主要参数为还原糖浓度、氨基氮浓度、发酵溶液的pH和溶氧。发酵溶液中的还原糖和氨基氮浓度变化如图3所示。发酵罐中接入菌种后,菌种逐步利用葡萄糖和(NH4)2SO4快速生长并产出L-赖氨酸。溶液的初始还原糖浓度为1.85g/100mL,发酵开始后还原糖浓度迅速降低,发酵12h后低于0.5g/100mL。发酵溶液中的葡萄糖作为碳源,主要影响微生物的能量代谢、菌体的生长和产物的合成,是至关重要的原料。发酵过程中通过流加50%浓度葡萄糖溶液将还原糖浓度维持在0.3~1.5g/100mL,以便能给菌种提供足够的能量和碳源。发酵溶液中初始氨基氮浓度为0.118g/100mL,发酵开始后逐步降低,发酵12h后低于0.05g/100mL。作为主要氮源,(NH4)2SO4可以为微生物提供丰富的氮元素,促进菌种的自身生长和代谢产酸,同时NH4+和S还可以激活L-赖氨酸合成途径中的关键酶天冬氨酸激酶[14-15]。产酸过程中通过流加50%浓度(NH4)2SO4溶液将氨基氮浓度稳定在0.02~0.12g/100mL,以便能给菌种提供足够的氮源,但又不产生抑制作用。
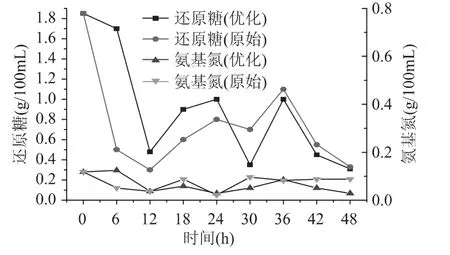
图3 发酵溶液的还原糖和氨基氮控制Fig.3 Reducing sugar and amino nitrogen control in fermentation
发酵溶液中的pH、溶氧控制如图4所示。pH主要会影响微生物的新陈代谢及其对培养基成分的利用,从而影响微生物体内酶的活性和产物的代谢途径。发酵溶液的初始 pH 为6.3~6.6,发酵开始后逐步降低。赖氨酸发酵属于中性发酵,发酵过程中通过流加25%浓度氨水保持溶液pH稳定在6.8~7.0,以便谷氨酸棒杆菌能更好地生长和产酸。发酵溶液中的溶氧主要影响微生物的生长和能量代谢,同时会参与产物的合成。发酵溶液中初始溶氧为100%,发酵初期,菌种量少,虽然呼吸强度较大,但总体上需氧量不大,此时发酵液中的溶氧较高,发酵6h溶氧约为65%~75%。随着菌种大量繁殖进入对数生长期,发酵液的菌种浓度不断上升,需氧量也不断增加,使溶氧浓度明显下降,发酵18h下降至40%左右。而且菌种生长和产酸速度越快,溶氧消耗越快。对数生长期后,菌种的呼吸强度下降,需氧量减少,溶氧经过一段时间的平稳后开始回升,发酵结束后约为65%~85%。发酵过程中通过将通风量从1.0L/min提高到 2.0L/min,将搅拌速度从 400 转/min提高到600转/min,控制发酵溶液中的溶氧始终在40%以上,以给菌种提供充足的氧气用于新陈代谢和产物合成。

图4 发酵溶液的溶氧和pH控制Fig.4 DO and pH control in fermentation
2.3 菌种生长和产酸特性
发酵罐中的菌种生长如图5所示。谷氨酸棒杆菌在优化培养基和原始培养基中的生长趋势基本一致,接种后均很快进入对数生长期,在18h菌种量达到最大值,OD 值分别为 1.059和 1.232,对应的细胞干重达到8.0g/L和9.3g/L。菌种在此阶段处于旺盛生长时期,生长速率高于0.2g/L/h。发酵的前6h,菌种生长得最快,此时优化培养基和原始培养基中菌种的生长速率达到最高值,分别为0.53g/L/h和0.72g/L/h。发酵18h后,菌种新陈代谢进入稳定期和衰亡期,部分菌种发生自溶,发酵液整体生物量均有所降低。发酵48h到达终点时,优化培养基中菌种量为7.7g/L,比最高值降低了3.8%。原始培养基中菌种量为8.3g/L,比最高值降低了10.8%。值得一提的是,整个发酵过程中,优化培养基的菌种生长量和生长速率始终低于原始培养基。
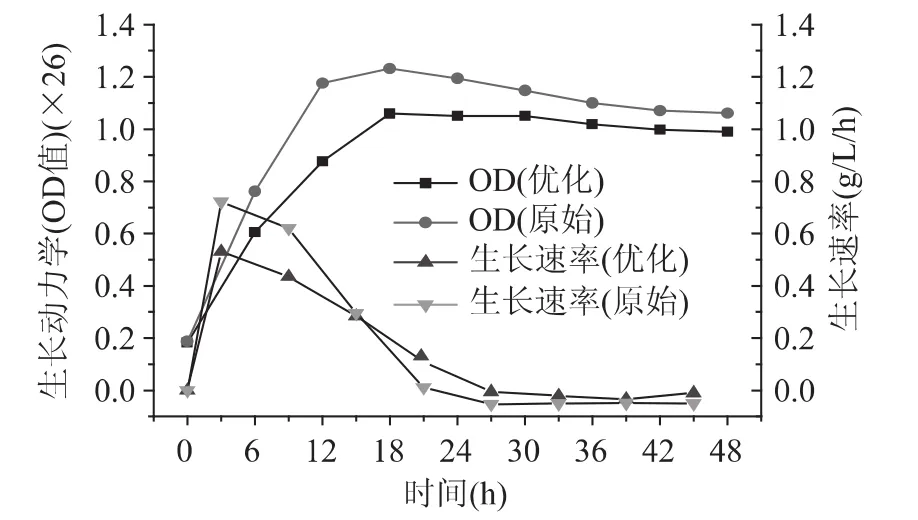
图5 菌种生长曲线和生长速率Fig.5 Growth curve and rate of Corynebacterium glutamicum
谷氨酸棒杆菌的产酸特性如图6所示。从图6可以看出,整个发酵周期优化培养基的产酸速率和L-赖氨酸浓度增长趋势与原始培养基一致。接种后6~24h是菌种快速产酸时期,该阶段优化培养基和原始培养基中菌种的最大产酸速率分别达到0.75g/100mL/h 和 0.81g/100mL/h,溶液中L-赖氨酸浓度由初始的 0.26g/100mL分别快速增长到 15.2g/100mL和15.4g/100mL。这是由于菌种在0~18h处于对数生长期,菌种新陈代谢旺盛,菌种大量繁殖,经过短暂延滞作用后代谢产物L-赖氨酸的浓度也相应快速增长。接种后18~36h是菌种新陈代谢的稳定期,谷氨酸棒杆菌在此阶段不再生长,菌种量基本上保持稳定,L-赖氨酸生产速率缓慢降低但仍保持在0.2g/100mL/h以上,L-赖氨酸浓度随着积累逐步增加。接种36h后,菌种新陈代谢进入衰亡期,L-赖氨酸生产速率进一步降低。发酵48h到达终点时,优化培养基中的L-赖氨酸浓度为20.8g/100mL,比原始培养基中的19.6g/100mL提高了6.1%。

表1 产酸过程中的原料消耗、总酸产量和糖酸转化率Table 1 Material consumption,L-lysine yield and conversion ratio
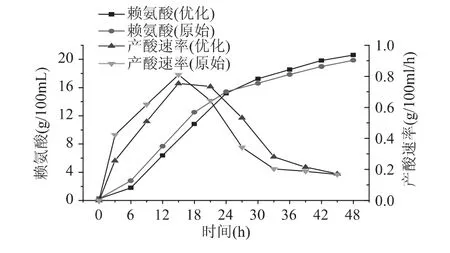
图6 发酵产酸曲线和产酸速率Fig.6 Production curve and rate of L-lysine
2.4 产酸总量和糖酸转化率
发酵过程中的葡萄糖与(NH4)2SO4消耗情况、产酸总量和糖酸转化率如表1所示。优化培养基发酵消耗的葡萄糖和(NH4)2SO4分别为 824.6g和200.6g,原始培养基发酵消耗的葡萄糖和(NH4)2SO4分别为903.8g和 188.6g。相比之下,优化培养基比原始培养基少消耗了8.8%的葡萄糖,多消耗了6.4%的(NH4)2SO4,两种培养基溶液中的C/N(m/m)分别为7.8和9.0。发酵过程结束后,优化培养基溶液中的产酸总量和糖酸转化率分别为588.2g和0.713g酸/g糖,和原始培养基的574.7g和0.636g酸/g糖相比,分别提高了 2.3% 和 12.2% 。
这可能是由于优化培养基成分中的蛋氨酸、糖蜜和谷氨酸含量改变后,培养基中的碳氮比和其他营养成分配比随之改变,菌种的新陈代谢和生长繁殖机制受到影响,不需消耗过多碳源合成生物体,因此菌种生长速度和总生物量均低于原始培养基。菌种生长进入高速产酸期后,消耗的碳源和氮源主要用来生产L-赖氨酸。优化培养基中消耗的C/N为7.8,低于原始培养基中消耗的C/N 9.0。优化培养基利用较低的C/N和较少的葡萄糖原料,生产出了更多的L-赖氨酸,说明优化培养基更有利于菌种高效利用氮源合成L-赖氨酸。
3 结论
对谷氨酸棒杆菌连续培养发酵生产L-赖氨酸进行研究后发现,和原始培养基相比,优化培养基中的菌种消耗的碳源较少,总体生物量较低。发酵结束后,优化培养基中的L-赖氨酸浓度、产酸总量和糖酸转化率分别比原始培养基提高了 6.1%、2.3% 和12.2%,优化培养基进一步提升了L-赖氨酸的发酵指标和生产效率,为降低工业生产成本奠定了基础。
[1]田原,张勇,宋安东,等.pH值反馈控制赖氨酸补料发酵中的碳氮源补加方法[J].过程工程学报,2011,11(3):492-496.
[2]张军华.微生物发酵法生产L-赖氨酸的研究进展[J].生物加工过程,2012,10(2):73-78.
[3]张伟国.L-赖氨酸发酵的研究[J].发酵科技通讯,2005,34(1):7-8.
[4]龙万凯.我国赖氨酸工业技术新进展[J].化学工程,2003,31(5):74-78.
[5]潘福成,王长梅.2013年上半年赖氨酸市场回顾及下半年展望[J].饲料广角,2013(16):22-24.
[6]Becker J,Klopprogge C,Schröder H,et al.Metabolic Engineering of the Tricarboxylic Acid Cycle for Improved Lysine Production by Corynebacterium glutamicum[J].Applied and Environmental Microbiology,2009,75(24):7866-7869
[7]陈宝利,张青萍.赖氨酸生产的现状及未来的发展方向[J].辽宁化工,2011,40(8):871-873.
[8]骆超超,高学军,王青竹,等.发酵谷物中产L-赖氨酸益生菌的筛选与鉴定[J].食品科学,2010,31(21):232-235.
[9]王均成,王文风.L-赖氨酸发酵生产研究进展[J].发酵科技通讯,2010,39(4):39-43.
[10]张伟国,顾正华.L-赖氨酸高产菌选育的研究[J].食品与发酵工业,2001,27(8):17-20.
[11]廉少杰,张伟国.梯度温度法提高L-赖氨酸发酵水平的研究[J].食品工业科技,2012,33(8):242-244,251.
[12]周勇,满云,张伟国.L-赖氨酸高产菌发酵的研究[J].食品与生物技术学报,2011,30(6):924-927.
[13]苏会波,林海龙,罗虎,等.响应面分析法和氮源改进优化L-赖氨酸发酵工艺[J].食品工业科技,2014,35(9):140-144.
[14]曾兆国,李承钰,陈永辉,等.赖氨酸发酵过程中不同氮源的代谢作用研究[J].饲料工业,2010,31(6):34-35.
[15]陈银芳,张伟国.L-赖氨酸高产菌的选育及发酵培养基的优化[J].生物技术,2009,19(4):36-40.

