乌贼墨多糖对环磷酰胺致小鼠卵巢损伤的保护作用
谷毅鹏,张云波,刘华忠,乐小炎,陶叶杏,肖 为,罗 萍,*
(1.广东海洋大学食品科技学院,广东湛江 524088;2.广东海洋大学农学院,广东湛江 524088;3.广东海洋大学生物化学中心,广东湛江 524088)
乌贼墨来自海洋软体动物乌贼的墨囊,在遇敌时喷出用以逃生,是一种具有多种生理功能的海洋活性物质[1]。乌贼墨多糖(Squid ink polysaccharides,SIP)是乌贼墨中最主要的活性成分之一,具有抗肿瘤[2]、抗氧化[3]、抗菌[4]、增强免疫[5-6]等生物学活性,近年来,本课题组发现并报道了SIP的化学防御功能[7-8],能有效缓解环磷酰胺(Cyclophosphamide,CP)对模型动物生殖功能的毒性损伤[9-11]。CP是最常用的化疗抗肿瘤药物,也是治疗自身免疫性疾病最强的烷化剂类药物,在临床上应用十分广泛[12-14]。但是CP又可导致卵巢功能严重损伤,出现卵巢萎缩,间质纤维化,原始卵泡减少,使卵巢功能过早衰竭甚至不孕[15-16]。CP导致的卵巢损伤会对女性患者造成身体和心里上的严重影响,降低女性患者化疗后生活质量和信心,因此寻找能够降低CP的卵巢毒害,保护卵巢功能的药物及方法,已显得尤为重要。本实验通过对雌性小鼠腹腔注射CP来构建卵巢损伤模型,并给予乌贼墨多糖灌胃,以此来进一步探讨SIP对CP致小鼠卵巢损伤的保护作用及可能的机制,为其在临床上的应用寻求一定理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 实验动物 清洁级雌性昆明小白鼠 购自广东省医学实验动物中心,体重约18~20g,共40只,在生化中心实验动物房适应性饲养1~2周。
1.1.2 主要试剂 乌贼墨多糖 本实验室制备[11,17];木瓜蛋白酶 购自北京鼎国生物技术有限公司;注射用环磷酰胺(CP) 购自江苏恒瑞医药股份有限公司;超氧化物歧化酶(SOD)、谷胱甘肽过氧化氢酶(GSH-Px)、丙二醛(MDA)和谷胱甘肽过氧化物酶(GPx) 均购自南京建成生物工程研究所;其它所有试剂 均为分析纯。
1.1.3 主要仪器 KDC-160HR型高速冷冻离心机;FDU-1100型真空冷冻干燥机;UV-2550型紫外可见分光光度计;N-1000型旋转蒸发仪;JY92-Ⅱ型超声波细胞粉碎机;BX51型多功能显微镜。
1.2 实验方法
1.2.1 实验动物分组及处理 将40只雌性昆明小鼠随机分成4组,即对照组、模型组、乌贼墨多糖(SIP)组、治疗组,每组10只。各组实验动物分组及药物处理如表1所示,SIP组和治疗组动物每天灌胃SIP(80mg/kg),对照组和模型组每天磷酸盐缓冲液(PBS)灌胃;同时,模型组和治疗组动物需腹腔注射环磷酰胺(CP),剂量为50mg/kg,每周一次,连续5周,其余两组按同样方法腹腔注射等量生理盐水(NS)。
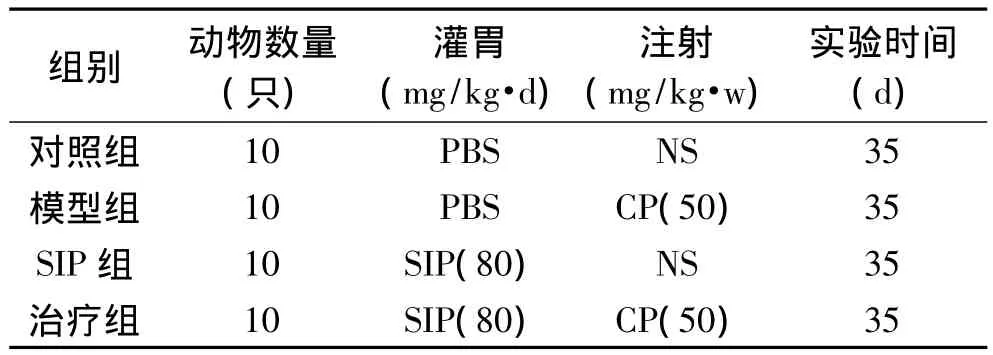
表1 实验动物分组及药物处理Table 1 Experimental animal grouping and drug treatment
各组实验动物在末次药物处理24h后称重,摘眼球取血,然后脱颈椎处死,迅速取出双侧卵巢,去除周围脂肪及结缔组织,称重,并根据实验需要对卵巢分装保存。常规分离血清,-20℃保存备用。计算小鼠卵巢指数:卵巢指数(%)=每只小鼠卵巢重量/每只小鼠体重×100。
1.2.2 组织病理学检测 将卵巢组织固定于10%甲醛溶液中,梯度乙醇脱水,浸蜡8h,石蜡包埋,5μm切片,HE染色,在光学显微镜下观察卵巢组织结构变化,并统计原始卵泡、初级卵泡、成熟卵泡和卵泡总数。
1.2.3 血清生殖激素的测定 血清中卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)和睾酮(T)水平的检测均严格按照试剂盒说明书操作。
1.2.4 卵巢抗氧化指标测定 取一侧卵巢制成5%组织匀浆,备用。卵巢组织中超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH-Px)均采用试剂盒说明书方法测定。
1.2.5 数据处理 使用SAS公司开发的JMP7.0软件对实验数据进行处理和分析,结果用“平均值±标准差”表示。
2 结果与分析
2.1 小鼠体重及卵巢指数
由表2可以看出,与对照组比较,模型组小鼠卵巢指数明显降低,差异有统计学意义(p<0.01),模型组小鼠体重也有所降低,但差异并不显著(p>0.05),表明CP对小鼠的卵巢指数的抑制作用很明显;同模型组相比,治疗组小鼠经SIP灌胃后体重变化不大,卵巢指数虽稍有增加,但差异也不明显(p>0.05)。

表2 小鼠体重及卵巢指数Table 2 The body weight of mice and ovarian index
2.2 组织病理学观察

图1 小鼠卵巢组织病理学观察Fig.1 Histopathological observation of mouse ovaries

表3 血清性激素水平Table 3 The levels of sex hormones in serum

表4 卵巢组织中抗氧化指标Table 4 The tissue antioxidant index of ovarian
在光镜下对小鼠卵巢组织切片进行观察,如图1所示,对照组(图1A)和SIP组(图1C)卵巢可见大量原始卵泡,较多的初级、生长和成熟卵泡以及黄体,形态规则,间质少;模型组(图1B)卵巢的卵泡数目锐减,其中生长卵泡和成熟卵泡数量下降明显,有的甚至消失,间质有纤维化;治疗组(图1D)卵巢的结构同模型组相比已有比较明显的改善,卵泡总数增加,可见大量初级卵泡,并保存了较多生长卵泡,而且间质纤维化程度有所减轻。通过对各级卵泡进行计数,如图2所示,模型组原始卵泡数、初级卵泡数、成熟卵泡数以及卵泡总数均显著低于对照组,差异具有统计学意义(p<0.01);而SIP组与对照组相比,上述卵泡数的差异均不显著(p>0.05);但治疗组同模型组比较,原始卵泡数、初级卵泡数、成熟卵泡数以及卵泡总数均有明显增高,且差异极显著(p<0.01)。结果表明,环磷酰胺能够显著降低小鼠各级卵泡数,破坏卵巢结构,而SIP能够明显缓解CP对小鼠卵巢组织结构和卵泡生长过程的抑制作用,提高各级卵泡数目,增强卵巢的储备能力。

图2 小鼠双侧卵巢各级卵泡总数Fig.2 Total bilateral ovarian follicles in mice
2.3 血清性激素水平
各组血清中性激素水平如表3所示,与对照组相比,模型组小鼠注射CP后,血清中LH水平明显升高,差异极显著(p<0.01),血清中FSH和T水平也均显著升高(p<0.05),但E2水平却明显下降(p<0.05),证明CP能显著降低正常雌性小鼠血清中E2水平,显著升高血清中FSH和T水平,并且能极显著的升高血清中FSH水平;SIP组血清中的上述指标与对照组相差不大,不具统计学意义(p>0.05)。同模型组比较,治疗组血清中E2水平升高非常显著(p<0.01),血清中LH水平下降极其显著(p<0.01),FSH水平也下降明显(p<0.05),但血清中T水平虽有所下降却不具统计学意义(p>0.05);由此可知,SIP能够极显著的抑制CP对雌性小鼠血清中LH和E2水平的影响,也能抑制CP对FSH的影响,但对血清中T水平的改善并不明显。
2.4 抗氧化指标
从表4可以看出,当注射CP后,模型组小鼠卵巢组织中SOD活力和GSH-Px活力均比对照组低,并且差异极显著(p<0.01);而经SIP灌胃后,同模型组相比,治疗组小鼠卵巢中SOD活力明显恢复(p<0.05),GSH-Px活力也显著升高,差异有统计学意义(p<0.01);从表4还能看出,与对照组比较,模型组小鼠卵巢MDA含量显著升高(p<0.01),GSH含量明显降低(p<0.01),但经SIP灌胃后,治疗组雌性小鼠与模型组相比,卵巢中MDA含量明显降低(p<0.01),GSH含量显著升高(p<0.01)。结果表明,SIP能显著抑制CP对小鼠卵巢组织造成的氧化损伤,提高卵巢组织中SOD和GSH-Px活力,降低MDA含量,升高GSH含量,从而有效保护卵巢组织细胞,增强整体抗氧化能力。
3 结论
环磷酰胺(CP)作为应用最广泛的化疗药物,常用于治疗恶性肿瘤及自身免疫疾病,但毒副作用强,易造成卵巢永久性损伤,致使卵巢早衰和不孕。CP导致卵巢功能性损伤的机理目前尚不明确,但一般认为,有丝分裂越活跃的细胞对细胞毒性药物的敏感性越强,而正是由于CP破坏了增殖活跃的卵泡颗粒细胞和通过激活ROS介导的细胞凋亡信号通路,上调了生长卵泡的凋亡比率,导致性激素分泌减少,反馈性引起下丘脑促性腺激素释放激素(GnRH)、垂体促性腺激素(FSH、LH)的分泌增加,加快原始卵泡向生长卵泡的发育,从而使其再次受到CP的破坏,形成恶性循环,最终耗竭原始卵泡的储备[18-20]。本研究证实CP会导致血清中性激素水平失衡,破坏卵巢组织结构,对卵巢内的不同阶段的生长卵泡有严重的杀伤作用,使卵巢产生明显的氧化损伤。
乌贼墨多糖(SIP)是从乌贼墨中提取出来的海洋生物活性物质,具有抗化疗作用,而且是一类高效、无毒、广谱类细胞保护剂。本研究结果显示,SIP能拮抗CP对卵巢的毒害:首先,增加原始卵泡数、初级卵泡数、成熟卵泡数以及卵泡总数(p<0.01),提高卵巢的储备功能,并在一定程度上修复CP对卵巢组织结构的破坏;其次,调节血清中E2(p<0.01)、FSH(p<0.05)和LH(p<0.01)恢复至正常水平,降低CP对血清中性激素的影响;最后,还能显著的提高卵巢组织中SOD活力(p<0.05)和GSH-Px活力(p<0.01),降低 MDA含量(p<0.01),升高 GSH含量(p<0.01),抑制卵巢组织的氧化损伤。SIP对CP致小鼠卵巢损伤产生的保护作用,可能是通过提高卵巢组织的抗氧化能力,缓解了CP对卵泡颗粒细胞和卵泡膜细胞的毒性损伤,抑制生长卵泡的不正常凋亡,调控下丘脑-性腺轴对性激素的正常分泌,从而保护卵巢组织结构,增强卵巢的储备能力。然而,目前关于CP拮抗剂在化疗过程中对卵巢的保护作用已有大量研究,但其作用机制还存有较大争议,因此对于SIP的这种保护作用以及机理还需要更多的科学实验来证实。
[1]杜铁平,周培根.乌贼墨研究概况[J].食品研究与开发,2002,23(6):16-18.
[2]Takaya Y,Uchisawa H,Matsue H,et al.An investigation of the antitumor peptidoglycan fraction from squid ink[J].Biological and Pharmaceutical Bulletin,1994,17(6):846-849.
[3]Luo P,Liu H.Antioxidant ability of squid ink polysaccharides as well as their protective effects on deoxyribonucleic acid DNA damageinvitro[J].African JournalofPharmacy and Pharmacology,2013,7(21):1382-1388.
[4]吴金龙,罗剑秋,刘华忠,等.乌贼墨多糖对冷藏鱿鱼的防腐保鲜作用研究[J].食品科学,2010,31(10):304-307.
[5]陆通,高春义,朱有名,等.乌贼墨升白作用的研究[J].实用中西医结合杂志,1995,8(3):163-164.
[6]Liu H Z,Luo P,Chen S H,et al.Effects of squid ink on growth performance,antioxidantfunctions and immunity in growing broiler chickens[J].Asian-Aust J Anim Sci,2011,24(12):1752-1756.
[7]刘华忠,王光,吴金龙,等.乌贼墨多糖对环磷酰胺致小鼠部分脏器损伤的缓解效应[J].中国现代应用药学,2012,29(2):89-93.
[8]王光,钟杰平,刘华忠.乌贼墨多糖缓解环磷酰胺致大鼠骨髓功能抑制作用的研究[J].食品工业科技,2012,33(17):365-367.
[9]王光.乌贼墨多糖的化疗保护作用研究[D].湛江:广东海洋大学,2010.
[10]乐小炎,许泽旋,师丽莎,等.乌贼墨多糖对环磷酰胺损伤小鼠生精功能的影响[J].中国海洋药物,2012,31(5):23-26.
[11]乐小炎,原林,林少杰,等.乌贼墨多糖的制备及对睾丸化疗性损伤的保护作用[J].食品工业科技,2013,34(17):342-344,348.
[12]Emadi A,Jones R J,Brodsky R A.Cyclophosphamide and cancer:golden anniversary[J].Nature Reviews Clinical Oncology,2009,6(11):638-647.
[13]Brodsky R A.High-dose cyclophosphamide for autoimmunity and alloimmunity[J].Immunologic research,2010,47(1 - 3):179-184.
[14]Sistigu A,Viaud S,Chaput N,et al.Immunomodulatory effects of cyclophosphamide and implementations for vaccine design[C]//Seminars in immunopathology.Springer- Verlag,2011,33(4):369-383.
[15]Molina J R,Barton D L,Loprinzi C L.Chemotherapyinduced ovarian failure:manifestations and management.[J].Drug Safety,2005,28(5):401-416.
[16]李超然,石红.化疗导致卵巢损害的保护措施研究进展[J].大连医科大学学报,2011,33(4):402-405.
[17]师莉莎,刘华忠,吴金龙,等.酶法提取乌贼墨多糖工艺探讨[J].食品科技,2011,36(4):138-141,147.
[18]Kishk E A F,Ali M H M.Effect of a gonadotropin-releasing hormone analogue on cyclophosphamide-induced ovarian toxicity in adult mice[J].Archives of gynecology and obstetrics,2013,287(5):1023-1029.
[19]王雪峰,何援利.慢病毒介导Bcl-2基因保护化疗大鼠卵巢损伤的作用及机制[J].广东医学,2013,34(2):187-191.
[20]井甜甜,何援利.促性腺激素释放激素激动剂对大鼠化疗损伤卵巢功能的保护作用[J].中国妇幼保健,2008,23(16):2276-2279.

