NaF、NaBr、NaI对酵母朊病毒[PSI+]形成的影响
李 辉, 张 波, 窦 爽 , 宋有涛,2*
(1.辽宁大学 生命科学学院,辽宁 沈阳 110036;2.辽宁大学 环境学院,辽宁 沈阳 110036)
NaF、NaBr、NaI对酵母朊病毒[PSI+]形成的影响
李 辉1, 张 波1, 窦 爽1, 宋有涛1,2*
(1.辽宁大学 生命科学学院,辽宁 沈阳 110036;2.辽宁大学 环境学院,辽宁 沈阳 110036)
为研究NaF、NaBr、NaI对酵母朊病毒[PSI+]形成的影响,利用表达融合蛋白GFP-Sup35p酵母朊病毒模型,借助半变性琼脂糖凝胶电泳技术,结合免疫印迹方法在蛋白水平上定量分析NaF、NaBr、NaI对酵母朊病毒[PSI+]形成的影响。结果显示,在细胞表型方面NaF、NaBr诱导出酵母朊病毒[PSI+],且所需浓度分别为0.02、1.0 mol/L;NaI在浓度为0.25mol/L可以诱导出[PSI+]经盐酸胍治愈后的酵母朊病毒[psi-]。在蛋白水平,NaF、NaBr、NaI盐作用后的[psi-]细胞内Sup35p并没有形成聚集体。
酵母朊病毒;[PSI+];聚集体
朊病毒是一类能在哺乳动物中引起疯牛病、绵羊瘙痒症,以及人类克雅氏病等可传染性的海绵羊脑病的病原体。迄今为止,对于朊病毒的疾病仍缺乏有效的治疗药物[1-2]。生态学的观点认为,生命与环境之间发生着不可分割的联系,已知所有的生命都受到环境的影响,研究发现,朊病毒不仅存在于哺乳动物中,也存在于自然界其他的物种中[3]。酿酒酵母(S.cerevisiae) 中也含有2种具有动物朊病毒特性的朊病毒状蛋白[PSI+](由翻译终止因子Sup35p引起)和[URE3](由氮代谢的调节蛋白Ure2p引起),它们虽然在序列上与动物朊病毒不同源,但可以自我复制并具有传染和遗传特性,并且这种特性在数百万年的真菌进化中一直存在[4-5]。这些酵母朊病毒能够在体内和体外形成淀粉状纤维,并且在结构上与动物朊病毒形成的纤维具有很大的相似性,Wickner由此提出了“酵母朊病毒假说”[6-8]。由于酵母朊病毒[PSI+]具有和哺乳动物朊病毒(Prp)相似的复制增殖机制、易于检测的遗传表型(红色为朊病毒可溶状态,白色为朊病毒聚集状态)及其与哺乳动物种间屏障的优势,因此基于酵母细胞筛选抗朊病毒药物的模型在大规模上筛选具有安全、经济和易实现高通量筛选等特性越来越受到广大研究者的关注[9-12]。在酵母中,朊病毒[PSI+]使得一系列原本隐藏的遗传变异显现出来,并产生表现型有25%是有利表型。在基因组范围内高通量筛选能调节[PSI+]诱导率的基因时,发现信号转导基因和应激基因在这方面有独特优势。其次测试不同突变菌株在不同环境下(如不同碳源和氮源),[PSI+]与[psi-]细胞的生长速率。在150株突变体中,近一半菌株都是在朊病毒状态下生长速率更快,并且生长速率增加了1/4左右。这些生长速率的不同跟它们本身的菌株特性及环境有关。通过比较测试,发现Sup35p的N和M结构域是自然选择倾向。通过在十几种压力条件(强氧化性、高浓度盐环境)下测试,[psi-]细胞自发突变形成[PSI+]的概率增加。研究者提出假说:[PSI+]可作为一种缓冲使得酵母细胞在波动的环境中生存并繁殖,从而促进进化[13-15]。另有研究表明[16],在氯化钠作用条件下,可形成酵母朊病毒[PSI+]表型,并在细胞表型和蛋白水平上得到相应的验证。因此,本研究采用氟化钠、溴化钠、碘化钠3种盐作用酵母朊病毒[PSI+],分析其对酵母朊病毒[PSI+]形成的影响,从而完善了研究卤族钠盐形成酵母朊病毒[PSI+]的初步实验。
1 材料与方法
1.1材料
1.1.1 菌株 野生型酵母779-6A(NMC) :MATαkar1SUQ5ade2-1his3Δ202leu2Δ1trp1Δ63ura3-52sup35::KanMX/pJ501,[PSI+],由美国国立卫生院 (NIH) Masison DC.博士惠赠。重组型酵母(NGMC) :MATαkar1SUQ5ade2-1his3Δ202leu2Δ1trp1Δ63ura3-52sup35::KanMX/pJ501,[GPSI+],GFP基因插入SUP35基因的第123~124位之间,由本实验室构建。
1.1.2 培养基 ①1/2YPD 培养基:酵母浸粉0.5%,蛋白胨2%,葡萄糖2%,固体平板加入2%琼脂;②YPD 培养基:酵母浸粉1%,蛋白胨2%,葡萄糖2%,固体平板加入2%琼脂;③SD-Ade( 腺嘌呤缺乏合成培养基) 固体培养基: 无氨基酸酵母氮源(YNB-AA) 7 g/L,葡萄糖20 g/L,琼脂20 g/L,倒平板前添加尿嘧啶、色氨酸、组氨酸和亮氨酸,使其终质量浓度分别为20、20、20、60 mg/L;④YPAD 培养基:酵母浸粉1%,蛋白胨2%,葡萄糖2%,腺嘌呤0.04%,固体平板加入2%琼脂;⑤1/2YPD+GuHCl 固体培养基: 同1/2YPD,倒平板前添加盐酸胍,使其终浓度为5mmol/L。
1.1.3 试剂 盐酸胍购于Sigma公司;兔抗GFP抗体与HRP标记的羊抗兔IgG 购于金斯特生物科技有限公司;酵母浸粉、蛋白胨、葡萄糖、琼脂粉购自上海奥博星生物科技有限公司;氟化钠、溴化钠、碘化钠、尿嘧啶、色氨酸、组氨酸、亮氨酸购自国药集团化学试剂有限公司;腺嘌呤 购自美国Solarbio 公司;其他试剂均为国产分析纯。
1.2方法
1.2.1 细胞遗传表型实验 在无菌操作条件下,挑取基因重组酵母菌[GPSI+]和经5mmol/L盐酸胍治愈的[Gpsi-]的单菌落于1/2YPD固体培养基及含NaF、NaBr、NaI 1/2YPD固体培养基上划线,30 ℃培养2~5d,培养出单菌落。转置室温培养3 d,待菌落颜色不再变化时,备用。
1.2.2 NaF、NaBr、NaI 对酵母朊病毒[PSI+]表型的影响 在无菌操作条件下,分别在含有不同浓度NaF、NaBr、NaI的1/2YPD固体培养基上划线,30 ℃恒温培养2~5d,转置于室温下3 d,待颜色不再变化时,观察结果(图1)。
1.2.3 不同培养基[PSI+]酵母细胞的表型分析 在无菌操作条件下,挑取基因重组酵母菌[GPSI+]和[Gpsi-]在1/2YPD固体培养基上划线,30 ℃恒温培养2 d。将培养出的菌落分别影印到含有不同浓度NaF、NaBr、NaI的1/2YPD、SD-Ade固体培养基以及YPAD固体培养基上。将影印后的培养皿倒置于30 ℃恒温培养箱中培养2~5d,转置于室温下3 d,备用。将上步中含不同浓度NaF、NaBr、NaI的1/2YPD固体培养基上长出的菌落分别影印到不含NaF、NaBr、NaI的1/2YPD、SD-Ade固体培养基上。将培养皿倒置于30 ℃恒温培养箱中培养2~5d,转置于室温下3 d,待颜色不再变化时,观察结果(图2)。
1.2.4 在蛋白水平上定量分析酵母细胞[PSI+]的形成 将不含盐的1/2YPD固体培养基培养出的白色单菌落活化后,接种到YPD液体培养基中,进行摇床培养,培养条件为30 ℃,至测菌液OD600=1.5时,停止培养。离心收集上清液后,加入裂解液及镐珠,用珠磨仪破碎细胞,收集上清液得到蛋白样品,-80 ℃保存;1.5%的半变性琼脂糖凝胶电泳结束后在0 ℃、恒压100 V条件下转膜1 h,将蛋白转移到PVDF膜上,兔抗GFP抗原 (1∶ 2 000) 孵育1 h,4 ℃过夜,然后用HRP标记的羊抗兔IgG (1∶ 5000)孵育1 h,采用ECL发光试剂盒对其进行放射自显影检测,获得图像信息(图3)。
2 结果与分析
在酵母细胞中,选用颜色变化作为酵母朊病毒[PSI+]表型的指示系统。其原理如下:酵母朊病毒[PSI+]的单体状态是翻译终止因子Sup35p(eRF 3)。在酵母细胞ade2-1(或ade1-14)突变体中,ADE基因的翻译被人为突变的终止密码子阻断。在正常的酵母细胞[psi-]中,Sup35p为单体状态,与Sup45p结合识别终止密码子,从而行使翻译终止因子的功能。在酵母细胞[psi-]中,由于这个翻译过程被中断,导致腺嘌呤代谢途径副产物累积,在培养基上生长的ade2-1(或ade1-14)菌株形成红色菌落;在酵母细胞[PSI+]中,Sup35p 为聚集状态,不能与Sup45p结合识别终止密码子,因而无法行使翻译终止因子的功能,导致ADE2(或ADE1)基因进行正常翻译,代谢途径中没有副产物的积累,所以[PSI+]的ade2-1(或ade1-14)菌株在培养基上形成白色的菌落。根据这个原理,在本研究中选用颜色指示系统来探讨NaF、NaBr、NaI对[PSI+]酵母细胞的形成。
2.13种盐对酵母朊病毒[PSI+]遗传表型分析结果
由图1所示,在含有0.005、0.01、0.02、0.05mol/L NaF的1/2YPD固体培养基上,酵母细胞[psi-]随着NaF浓度的增加,由最初的红色开始向白色转变,当其浓度为0.005mol/L时,菌落颜色明显的由红色转变成粉色;当其浓度为0.01 mol/L时,由于抑菌作用酵母细胞生长缓慢,形成的菌落较小,但菌落颜色已经变白,接近于酵母细胞[PSI+]的颜色;当其浓度为0.02 mol/L时,抑菌现象严重,可以清晰地观察到白色菌落的存在;当其浓度达到0.05mol/L时,出现严重的抑菌现象,无菌落生长。这些结果表明,当NaF浓度为0.005mol/L时,酵母细胞中的一部分ade2-1无义突变开始被抑制;当NaF浓度为0.01 mol/L时,酵母细胞中的ade2-1无义突变大部分或者完全被抑制,出现酵母细胞[PSI+]表型。这种ade2-1无义突变抑制可能是由于Sup35p的聚集引起的。随着浓度的增大,酵母细胞[PSI+]表型越来越明显,因此,NaF对酵母细胞[PSI+]表型的诱导表现出剂量效应关系。同理,在含有0.05、0.5、0.75、1.0 mol/L NaBr的1/2YPD固体培养基上,当NaBr浓度为1.0 mol/L时,出现酵母细胞[PSI+]的表型。

图1 NaF、NaBr、NaI对酵母朊病毒[PSI+]表型形成的影响
不同的是,在含有0.05、0.1、0.25、0.5mol/L NaI的1/2YPD固体培养基上,酵母细胞[psi-]并未发生任何颜色的变化,相反,在NaI浓度0.25mol/L时,酵母细胞[PSI+]发生了明显的颜色变化,已经出现酵母细胞[psi-]表型。
在含有0.05、0.1、0.25、0.5mol/L NaI的1/2YPD培养基上,当NaI浓度为0.25mol/L时,出现酵母细胞[psi-]的表型。
2.2免疫印迹法对酵母朊病毒[PSI+]表型形成分析结果
由图2所示,由同一来源的基因重组酵母菌[GPSI+] 和[Gpsi-]菌落影印到含有不同浓度NaF、NaBr 1/2YPD固体培养基(腺嘌呤含量适中的完全培养基)上,随着盐浓度增大,[Gpsi-]菌落颜色由原来的红色逐渐变浅,直至临界抑菌浓度时变为与酵母细胞[PSI+]一致的白色。在含有0.25mol/L NaI 1/2YPD固体培养基上,[GPSI+]菌落颜色由最初的白色变为红色,与酵母细胞[psi-]一致。在添加不同浓度NaF、NaBr SD-Ade固体培养基(选择性培养基,[psi-]菌不能生长)上,随着盐浓度增加,影印的[Gpsi-]菌落生长,菌落颜色为偏红色。这些Ade+菌落可能是非常微弱的酵母细胞[PSI+]表型,即酵母细胞内的Sup35p虽然已经聚集,但较正常的酵母细胞[PSI+]相比,仍有大多数的Sup35p呈单体状态,正常行使翻译终止子的功能,导致无义突变不能完全被抑制,ade2-1酶部分被合成,因导致一部分中间产物AIR的积累并经过转变而产生红色素。此时由于产生部分Sup35p聚集体,因而抑制一部分无义突变,合成ade2-1酶,进而合成腺嘌呤以供酵母细胞在选择性培养基上生长需要。
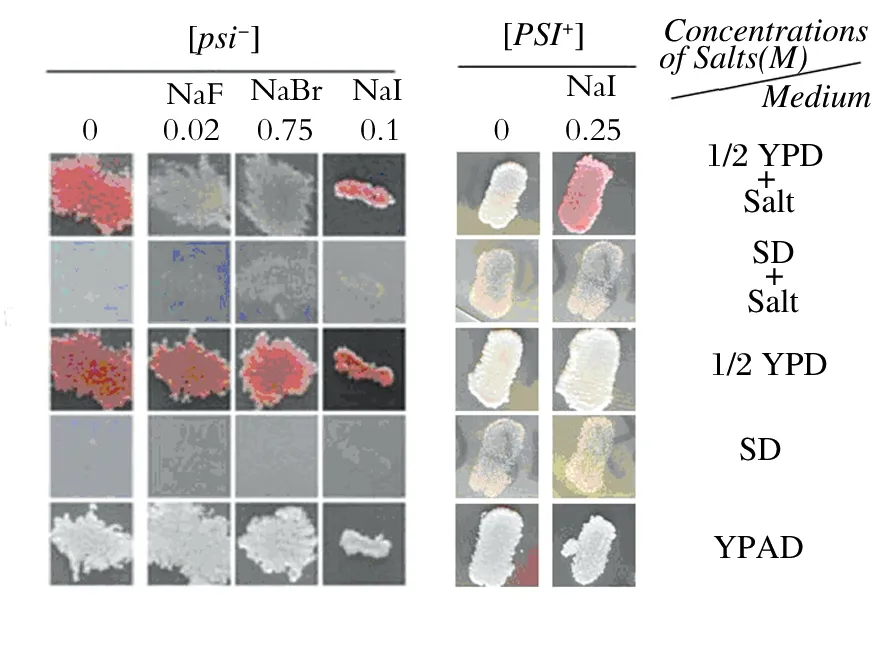
图2 不同培养基下NaF、NaBr、NaI酵母朊病毒对[PSI+]表型形成的影响
将在含有NaF、NaBr、NaI 1/2YPD固体培养基上变颜色的[GPSI+]和[Gpsi-]菌落分别重新影印到不含NaF、NaBr、NaI 1/2YPD、SD-Ade固体培养基上。由图2所示,在不含NaF、NaBr 1/2YPD固体培养基上,变白的[psi-]菌落又重新变回红色,而在其相应的SD-Ade固体培养基上,没有类似于在含NaF、NaBr SD-Ade固体培养基上的菌落长出。在不含NaI 1/2YPD固体培养基上,变红的[PSI+]菌落变回原来的白色,而与之对应的SD-Ade固体培养基上,[PSI+]菌落变回原来的白色,并且变回的颜色比较均一,与被诱导的剂量无关。可见,被诱导的[PSI+]和[psi-]表型繁殖依赖于盐的存在,当NaF、NaBr、NaI从培养环境中消失时,酵母细胞[PSI+]和[psi-]表型不能够稳定遗传。
综上所述,此实验进一步表明,在0.01 mol/L NaF、1.0 mol/L NaBr作用下某种程度上能形成较弱的酵母细胞[PSI+]表型,而在0.25mol/L NaI作用下,能形成酵母细胞[psi-]表型,并且这种[PSI+]和[psi-]酵母细胞表型在离开盐环境下不能稳定遗传。因此,这种微弱的[PSI+]和[psi-]细胞表型是否是由酵母细胞内的Sup35p的聚集引起,或只由其他原因的无义突变抑制引起,尚需用更为精确的半变性琼脂糖凝胶电泳技术结合免疫印迹方法,在蛋白水平上作进一步的检测和探讨。
2.3蛋白水平分析3种盐对酵母朊病毒[PSI+]聚集状态结果

图3 蛋白水平定量分析盐作用 [PSI+]和[psi-]酵母细胞朊病毒聚集状态
如图3所示,SDD-AGE/Western blotting结果表明NaF、NaBr、NaI三种盐作用[GPSI+]细胞5d后粉色菌落的聚集状态以单体的形式存在。这表明被诱导的酵母细胞[PSI+]表型繁殖严格依赖于这3种盐的存在,当这3种盐从培养环境中消失时,酵母细胞[PSI+]表型不能稳定遗传,这与前期的表型实验和免疫印迹实验结果一致。
3 讨 论
本研究选取NaF、NaBr、NaI三种盐,并在细胞表型和蛋白水平上探讨了其对酵母朊病毒[PSI+]形成的影响。由以上实验结果可知,在NaF、NaBr、NaI各自临界抑菌浓度下,均能在不同程度上诱导出[PSI+]和[psi-]细胞表型。然而,在不同培养基背景下,发现NaF、NaBr、NaI诱导[PSI+]和[psi-]细胞表型非常微弱,其繁殖严格依赖于该3种盐存在的培养环境。通过SDD-AGE/Western blotting技术,可知NaF、NaBr、NaI 作用后的[PSI+]和[psi-]细胞内,Sup35p并没有形成聚集体,均以单体的形式存在。可见,NaF、NaBr、NaI对于[PSI+]和[psi-]酵母细胞表型的形成严格依赖于该3种盐存在的培养环境。因此,在筛选某些环境因子作用于酵母朊病毒时,要考虑不同环境因子及其最佳作用剂量的大小,并能够使酵母朊病毒的[PSI+]表型繁殖稳定遗传。另外,本实验采用的细胞表型和蛋白水平SDD-AGE/Western blotting技术在筛选环境因子作用酵母朊病毒[PSI+]中的可行性,为使酵母朊病毒[PSI+]形成提供初级筛选方法。
[1]Prusiner SB.Biology of prion diseases[J].J AcquirImmune Defic Syndr,1993,6(6): 663-665.
[2]Ghaemmaghami S,May BCH,Renslo AR,et al.Discovery of 2-aminothiazoles as potent antiprioncompounds[J].J Virol,2010,84(7):3408-3412.
[3]陈彦,朱奇,石海英,等.朊粒、生命与病原体[J].微生物杂志,2000,20(3):45-47.
[4]Song Y.,Lan W.,Wu X.,et al.Quantitative effects of magnesium chloride stress on aggregation of Sup35p in [psi-] yeast cells[J].Protein & Peptide Letters,2010,17(12):1489-1494.
[5]Song Y.,Song Y.,Chen X.The yeast prion case: could there be a uniform concept underlying complex protein folding[J].J Biomol Struct Dyn,2011,28(4):663-665.
[6]Wickner RB.,Edskes HK.,Bateman D.,et al.The yeast prions [PSI+] and [URE3] are molecular degenerative diseases[J].Prion,2011,5(4):258-262.
[7]钟正伟,宋有涛.朊病毒治疗候选药物的研究进展[J].中国人兽共患病学报,2011,27(9):828-835.
[8]宋有涛,吴宪远,何星蓉.抗朊病毒药物筛选模型的研究进展[J].辽宁大学学报:自然科学版,2009,37(4):289-293.
[9]Bach S,Talarek N,Andrieu T,et al.Isolation of drugs active against mammalian prions using a yeast-based screening assay[J].Nat Biotechnol,2003,21(9):1075-1081.
[10]Tribouillard-Tanvier D,Beringue V,Desban N,et al. Antihypertensive drug guanabenz is active in vivo against both yeastand mammalian prions[J].PLoS One,2008,3(4):1981.
[11]刘胜贵,李军,陈富成,等.羊耳菊水提取物体外抑菌活性研究[J].时珍国医国药,2009,20(12):3072-3074.
[12]Song Y,Lan W,Wu X,et al.Quanti tative effects of Magnesium Chloride stress on aggregation of Sup35p in [psi-] yeast cells[J].Protein Pept Lett,2010,17(12):1489-1494.
[13]Partridge L.,Barton NH.Evolving evolvability[J].Nature,2000,407(6803):457-458.
[14]True HL.,Lindquist SL.A yeast prion provides a mechanism for genetic variation and phenotypic diversity[J].Nature,2000,407(6803):477-483.
[15]Tyedmers J.,Madariaga ML,Lindquist S.Prion Switching in Response to Environmental Stress[J].PLoS Biology,2009,6: 2605-2613.
[16]Tyedmers,J.,M.L.Madariaga,S.L.Lindquist.Prion 360 Switching in Response to Environmental Stress[J].PLoS Biol,2008,361(6):2605-2613,362.
ImpactofNaF,NaBr,NaIontheFormationofYeastPrion[PSI+]
LI Hui1,ZHANG Bo1,DOU Shuang1,SONG You-tao1,2
(1.Schl.ofLifeSci.,2.Schl.ofEnvironSci.,LiaoningUni.,Shenyang110036)
In order to study the impact of NaF,NaBr,NaI on the formation of yeast prion [PSI+],the expression fusion protein GFP-Sup35p yeast prion model was used with the aid of semi-denaturing agarose gel electrophoresis combined with Western blot method to quantitatively analyse the impact of NaF,NaBr,NaI on the formation of yeast prion [PSI+] at the protein level.The results showed that in the aspect of cell phenotype,NaF,NaBr induced out yeast prion [PSI+],and the desired concentrations were at 0.02 mol/L,1.0 mol/L; NaI at concentration of 0.25mol/L can induce [PSI+] by guanidine hydrochloride cure yeast prion[psi-].At the protein level,NaF,NaBr,NaI salt after [psi-] intracellular Sup35p did not form aggregates.
yeast prion;[PSI+]; aggregation
国家自然科学基金(30970152);辽宁省教育厅优秀人才项目(2009R26)
李辉 男,实验师。研究方向为利用基于酵母朊病毒的抗筛选药物筛选模型进行抗酵母朊病毒药物筛选。
E-mail: 905129549@qq.com
2013-05-17;
2013-05-21
Q93
A
1005-7021(2014)01-0012-05
10.3969/j.issn.1005-7021.2014.01.003
* 通讯作者。男,教授,硕士研究生导师。研究方向为细胞水平抗amyloidosis药物筛选平台。Tel:024-62202682,
E-mail: youtaos@gmail.com

