黄芩素抑制人巨细胞病毒感染星形胶质细胞的实验研究
周 雯,李 玲*,于向民*,刘爱红,王 斌,钱冬萌,杨 瑞,张志超
(1.青岛大学医学院组织胚胎学教研室,山东青岛 266071;2.青岛大学医学院附属青岛海慈医疗集团,山东青岛 266071;3.青岛大学病原微生物学教研室,山东青岛 266071)
人巨细胞病毒(human cytomegalovirous,HCMV)属疱疹病毒β亚科,核心为双股线性DNA病毒,在人群中普遍感染,全球人群感染率高达70%~80%[1],多呈隐性感染。在发达国家,新生儿HCMV先天感染率高达0.5%~2.2%,绝大多数感染者在出生时无症状,但有5%~15%的感染者在出生后2 a内出现视神经性耳聋、智力发育迟缓及视神经萎缩等后遗症[2]。迄今为止,HCMV引起神经系统损伤的机制尚未阐明,对HCMV感染尚无特异有效的治疗和预防手段。黄芩(Scutellaria baicalensis Georgi)始载于《神农本草经》,具有清热燥湿、泻火解毒、止血安胎等功效,在临床上应用广泛。以往研究对其主要有效成分黄芩素、黄芩苷以及提取的活性部位的药理活性多有关注,主要包括抗病原微生物、抗病毒、抗炎、抗过敏、抗氧化、抗肿瘤以及对肝脏、免疫系统、神经系统的保护作用等方面[3]。黄芩素(baicalein,BAI)是黄芩的重要单体,化学结构属黄酮类,具有多种药理作用,在临床上主要用于抗菌消炎和抗感染[4],现代研究发现黄芩素也有一定的抗病毒作用[5]。目前,国内外研究中,有关黄芩素的研究报道较为广泛,但其抑制HCMV感染人星形胶质细胞的研究尚未报道。本研究以人星形胶质细胞为研究对象,探讨黄芩素在HCMV感染星形胶质细胞过程中引起IE、pp65 mRNA和蛋白表达的改变,以阐明其对HCMV感染神经细胞的抑制作用,为进一步研究黄芩素的抗病毒机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞 人星形胶质细胞(AS)和人胚肺成纤维细胞(HELF)细胞株均为本室保藏。HCMV AD169株为法国巴斯德研究所赠送,于HELF细胞中扩增,至细胞病变达80%以上时收获病毒,空斑实验测定病毒滴度为108PFU/mL,毒种保存于-86℃。
1.1.2 药物 黄芩素(baicalein,Sigma)。分子式:C15H10O5;相对分子量:270.24;DMSO溶解,母液浓度100 mmol/L,分装后-20℃保存,备用。
1.1.3 试剂及仪器 胎牛血清(FBS,HyClone);DMEM/F12(HyClone);二甲基亚砜(DMSO,Sigma);噻唑蓝(MTT,Amerscso);Go TaqⓇqPCR Master Mix(Promega);Rabbit Anti-Cytomegalovirus IE(ViroStat);Rabbit Anti-Cytomegalovirus PP65(博奥森);SUNRISE酶标仪(瑞士);BIO RAD Realtime PCR仪(MyiQTM2 Optics Module);OLYMPUS FV1200型激光共聚焦显微镜(日本)。
1.2 方法
1.2.1 细胞培养 人星形胶质细胞AS由神经干细胞分化而来,采用含10%FBS的DMEM/F12,于37℃、5%CO2孵箱内常规培养,48 h换液,3 d传代。使用第3代和第4代细胞并且长到对数期时进行如下实验。
1.2.2 MTT比色法检测AS细胞增殖 取对数生长期的AS细胞均匀接种于96孔板(密度约1×105cell/孔),每孔100 μL。分别设立对照组,BAI组,BAI+HCMV组和HCMV组,各组5个复孔。24 h后弃去培养液,BAI组和BAI+HCMV组加入100 μL含不同浓度(10、20、40、80、160 μmol/L)由2%FBS的DMEM/F12培养液配制的BAI,HCMV组和对照组加入等体积2%FBS的DMEM/F12培养液。4 h后BAI+HCMV组和HCMV组加入HCMV(MOI=5),BAI组和对照组只加入等体积的DMEM/F12培养液。分别在病毒感染后0、24、48、72 h后弃上清,每孔加入10 μL MTT(5 mg/mL)和90 μL DMEM/F12,避光培养4 h后弃掉培养上清液,加入150 μL DMSO,置于摇床上低速振荡10 min,使结晶物充分溶解。使用SUNRISE酶标仪检测各孔在492 nm波长处的OD值,实验中同时设立调零孔(不含细胞)。以上实验重复3次,取平均值进行统计学分析。
1.2.3 RNA提取与Real-Time PCR 取对数生长期的AS细胞接种细胞培养皿(密度约105/mL),培养24 h后加入含20 μmol/L BAI的2%DMEM/F12培养液,4 h后加入HCMV 120 μL(MOI=5),分别培养48、72 h后收集细胞,设置相同检测点病毒感染组细胞作为阳性对照。用Trizol试剂按说明书提取细胞总RNA。两步法Realtime PCR,第一步,AMV Reverse Transcription System Kit试剂盒扩增第一链cDNA,第二步为PCR扩增,IE1、IE2、pp65基因和β-actin引物均由上海生工合成。IE1基因引物序列:IE1-F:CAAGTGACCGAGGATTGCAA,IE1-R:CACCATGTCCACTCGAACCTT。IE2基因引物序列:IE2-F:TGACCGAGGATTGCAACGA,IE2-R:CGGCATGATTGACAGCCTG。pp65基因引物序列:pp65-F:GTC AGC GTT CGT GTT TCCCA,pp65-R:GGGACACAACACCGTAAAGC。β-actin引物序列:β-actin-F:TGGAACGGTGAAGGTGACAG,β-actin-R:GGCTTTTAGGATGGCAAGGG。应用BIO RAD实时荧光定量PCR仪进行扩增,反应参数:95℃预变性2 min,95℃ 10 s、55℃ 30 s、70℃ 30 s扩增,循环40次,绘制溶解曲线。以双ΔCt值法计算各组各时间点IE1、IE2、pp65cDNA模板数和βactin模板数比值。
1.2.4 细胞爬片与免疫荧光 取对数生长期的AS细胞接种到含已包被玻片的24孔板内(密度约105/mL),培养24 h后加入含20 μmol/L BAI的2%DMEM/F12,对照组加入等量的2%DMEM/F12培养液,4 h后加入HCMV 20 μL(MOI=5),分别培养48、72 h后多聚甲醛固定细胞,0.1%Trionx-100室温透化30 min,10%山羊血清室温封闭30 min,过夜孵育小鼠抗HCMV IE蛋白单克隆抗体和兔抗HCMV pp65多克隆抗体,PBS充分洗涤后,与FITC标记的山羊抗小鼠IgG和Cy3标记的山羊抗兔IgG 37℃孵育2 h,hoechst室温染核10 min,75%甘油封片后在激光共聚焦显微镜下观察、拍照。
1.2.5 蛋白提取与Western blot 取对数生长期的AS细胞接种细胞培养瓶(密度约105/mL),培养24 h后加入含20 μmol/L BAI的2%DMEM/F12培养液,4 h后加入HCMV 120 μL(MOI=5),分别培养1、2、3、4 d后收集细胞,设置相同检测点病毒感染组细胞作为阳性对照,不染毒细胞作为阴性对照。提取总蛋白,检测IE1和IE2蛋白的变化,鼠抗IE抗体稀释比例1∶800,兔抗βactin稀释比例1∶1 000,HRP标记的羊抗兔IgG和HRP标记的羊抗鼠IgG稀释比例为1∶2 500。Quantity One软件进行灰度分析,以目的条带与内参灰度比值为其相对表达含量。
1.2.6 统计学分析 采用SPSS 17.0软件处理数据,所得数据计量资料用均数±标准差±s)表示,组间均数比较用重复测量数据的方差分析,两两比较选用LSD法,P<0.05为差异有统计学意义。
2 结果与分析
2.1 各组AS细胞增殖结果比较(表1)
不同处理组之间的差别具有高度统计学意义(F=27.265,P<0.05)。20 μmol/L BAI+HCMV组感染24、48和72 h后的MTT值均高于HCMV组(P<0.05)。因此,选取20 μmol/L BAI进行下步实验。
表1 BAI组、BAI+HCMV组、HCMV组和对照组AS细胞MTT值的变化±s)Table1 Changes of MTT value in different groups±s)
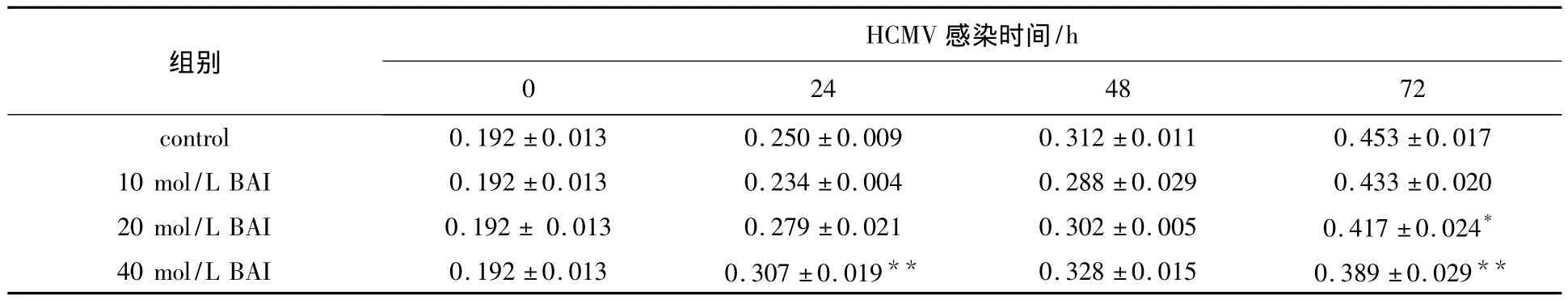
表1 BAI组、BAI+HCMV组、HCMV组和对照组AS细胞MTT值的变化±s)Table1 Changes of MTT value in different groups±s)
HCMV感染时间/h 0.453±0.017 10 mol/L BAI 0.192±0.013 0.234±0.004 0.288±0.029 0.433±0.020 20 mol/L BAI 0.192± 0.013 0.279±0.021 0.302±0.005 0.417±0.024*40 mol/L BAI 0.192±0.013 0.307±0.019** 0.328±0.015 0.389±0.029 24 48 72 control 0.192±0.013 0.250±0.009 0.312±0.011组别0**
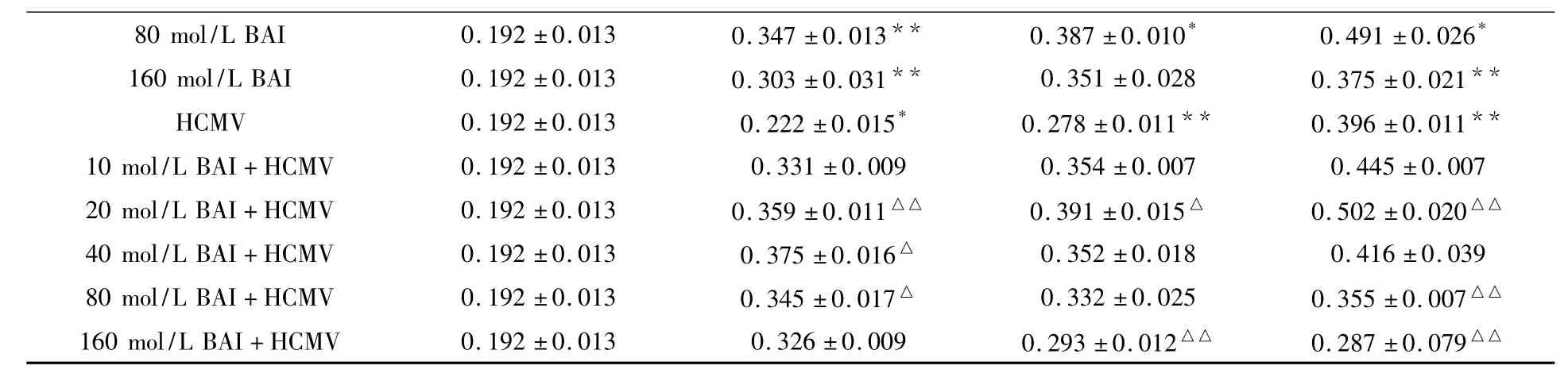
续表
2.2 各组细胞感染HCMV48、72 h的形态学观察(图1)
与对照组相比,HCMV组细胞感染后逐渐出现融合,细胞间隙变大,48 h后出现较为明显的细胞病变效应(Cytopathic effect,CPE)。而20 mol/L BAI+HCMV组细胞感染48 h融合较少,且大部分细胞仍为正常形态。单独BAI组对细胞无毒性作用。
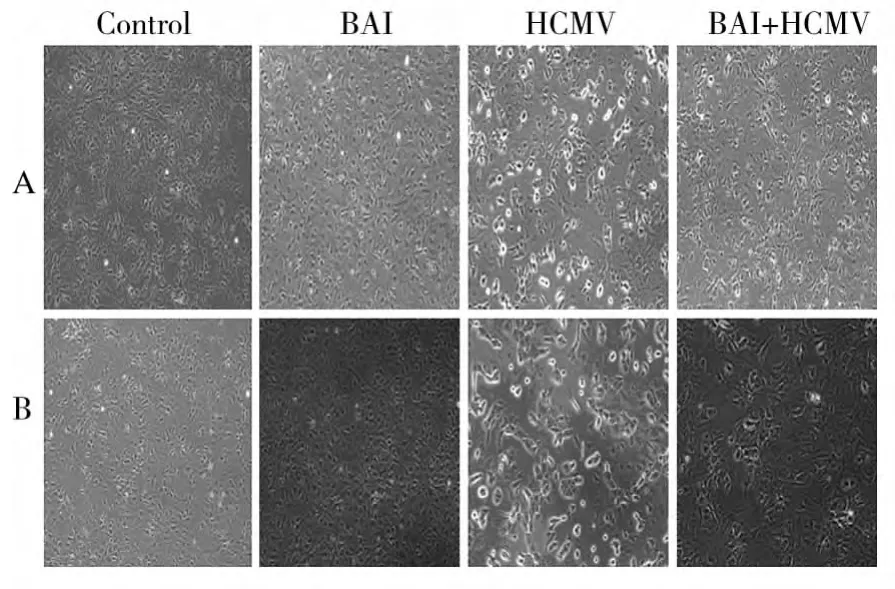
图1 各组AS细胞感染HCMV 48、72 h的形态学变化(100×)Fig.1 Morphological changes of AS cells in different groups(100×)
2.3 各组细胞感染HCMV48 h和72 h的IE1、IE2和pp65基因 mRNA相对表达量变化比较(图2)
各组细胞在各时间段均有IE2、pp65的表达,并且BAI+HCMV组明显低于HCMV组,差异具有统计学意义(P<0.01)。
2.4 各组细胞感染HCMV48、72 h时免疫荧光检测IE和pp65蛋白水平变化(图3)
各组均有IE、pp65蛋白的表达,其中BAI+HCMV组的pp65的荧光亮度明显弱于HCMV组,IE的表达量也弱于HCMV组,但其降低强度弱于pp65。
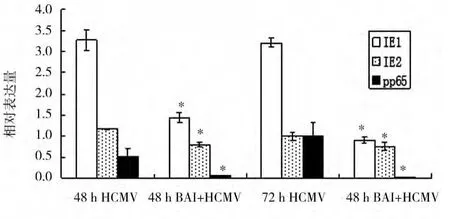
图2 BAI+HCMV组和HCMV组IE1、IE2、pp65 mRNA的相对表达量Fig.2 Relative expression of IE1,IE2,pp65 mRNA in HCMV group and BAI+HCMV group
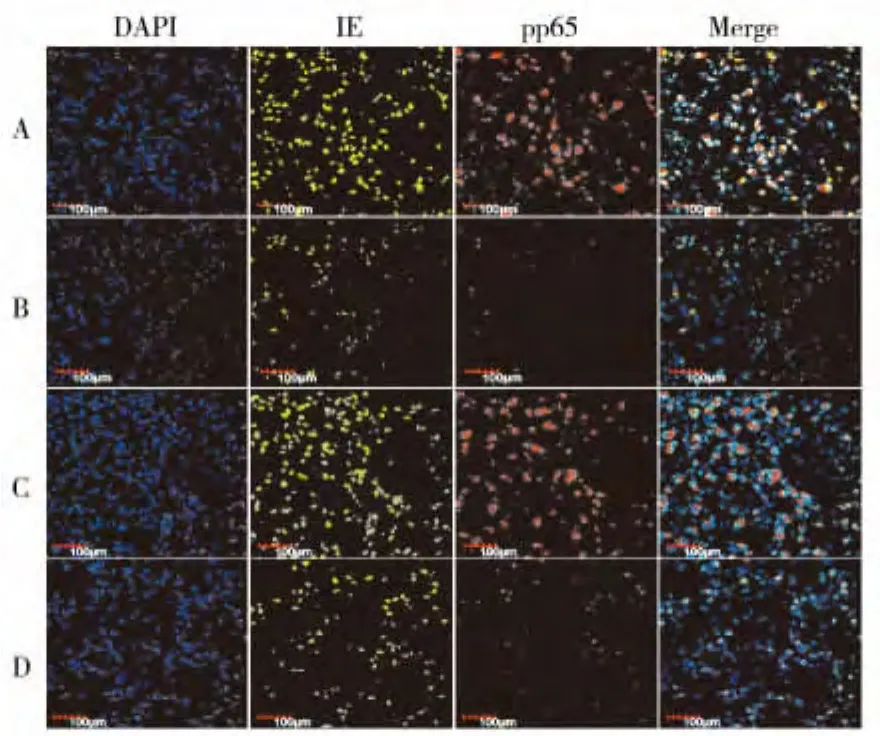
图3 各组AS细胞感染HCMV 48、72 h时IE、pp65蛋白荧光图(100×)Fig.3 Expression of IE,pp65 protein in each group by immunoflurescence assay(100×)
2.5 各组细胞感染HCMV1、2、3和4 d时Western blot检测IE1、IE2蛋白水平的变化(图4,表2)
正常细胞组没有IE1、IE2蛋白的表达,HCMV感染组细胞均有IE1蛋白表达,而IE2在病毒感染第1天时基本观察不到,灰度于背景色相似。BAI+HCMV组在相应时间点IE1和IE2蛋白的表达量明显弱于HCMV组(P<0.01)。
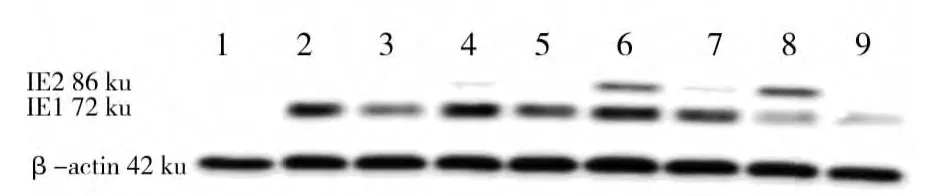
图4 各组AS细胞感染HCMV不同时间点IE1、IE2蛋白的表达变化Fig.4 Changes of IE1,IE2 protein in different group after HCMV infection
表2 不同处理组AS细胞的IE1、IE2蛋白与β-actin灰度比值的变化(±s)Table2 The relative value of IE1,IE2 protein in different groups(±s)
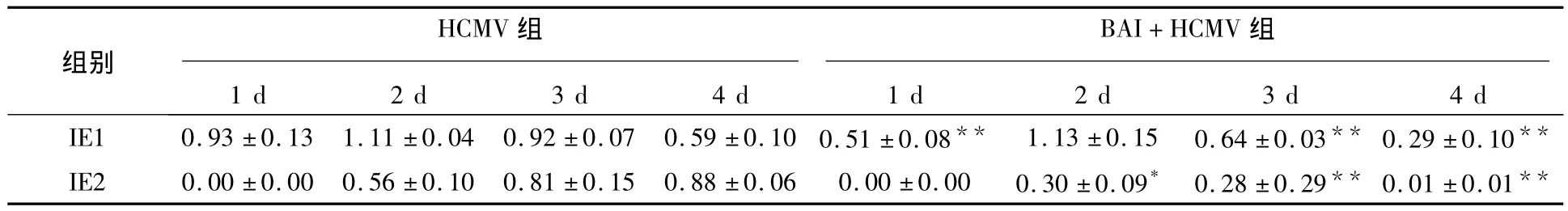
表2 不同处理组AS细胞的IE1、IE2蛋白与β-actin灰度比值的变化(±s)Table2 The relative value of IE1,IE2 protein in different groups(±s)
注:与HCMV 组比较,*P<0.05,** P<0.01
HCMV组BAI+HCMV 组组别1 d 2 d 3 d 4 d 1 d 2 d 3 d 4 d IE1 0.93±0.13 1.11±0.04 0.92±0.07 0.59±0.10 0.51±0.08** 1.13±0.15 0.64±0.03** 0.29±0.10**IE2 0.00±0.00 0.56±0.10 0.81±0.15 0.88±0.06 0.00±0.00 0.30±0.09* 0.28±0.29** 0.01±0.01**
3 讨论
HCMV为一种双链DNA病毒,具有嗜神经性,是人类重要的致畸致神经损伤病原体,也是发展中国家最常见的宫内感染病原体,可通过胎盘传播直接使胎儿感染进而引起小头畸形、认知能力发育落后等异常[6-7]。目前,尚无任何获得批准的疫苗用于预防HCMV宫内感染,也没有任何获得批准的药物用于治疗妊娠期感染[8]。
黄芩素是中药黄芩所含的主要黄酮之一,具有抗菌、抗病毒、抗炎、保肝、利胆、抗癌等作用,还能抗氧化、抗自由基损伤,具有较好的临床应用价值。目前有研究证实黄芩素在体外具有一定的抗流感病毒[9]的作用,以及抗HCMV和HSV-1的作用[10],在人胚肺成纤维细胞中黄芩素抗HCMV的效果高于常用抗病毒药物更昔洛韦[11]。HCMV作为一种嗜神经病毒,可以感染多种神经细胞,但以星形胶质细胞最易感染,而有关黄芩素抑制HCMV感染人星形胶质细胞的研究目前还没有报道。因此本研究采用星形胶质细胞为模型,通过研究感染HCMV后病毒IE、pp65基因与蛋白水平的变化,探究黄芩素对HCMV在基因和蛋白水平的抑制作用。
已有研究发现,星形胶质细胞是HCMV感染的容纳细胞[12-13],本研究中AS感染HCMV后出现形态上明显的细胞特征性病变效应,基因和蛋白水平均有IE和pp65的表达,此结果进一步证实人星形胶质细胞是HCMV的完全容纳细胞。
本研究采用MTT法检测药物对AS细胞增殖的影响,结果显示黄芩素在一定范围内能促进人星形胶质细胞的增殖,不同浓度BAI+HCMV组的细胞活性均高于HCMV组,其中以20 μmol/L BAI+HCMV组的活性最高,因此后续实验均以黄芩素浓度为20 μmol/L时进行。目前文献所提到的黄酮类药物的抗病毒机制有两种可能,一是抑制病毒的复制,二是影响病毒复制过程所必需的信号转导途径[14],已有研究证实黄芩素能抑制EGFR上酪氨酸激酶的活性[10,15],而细胞表面的EGFR能与HCMV直接作用参与HCMV进入细胞的过程[15]。在本研究中除对照组外其余各组的mRNA和蛋白水平均有IE和pp65的表达,其中BAI+HCMV组的IE和pp65表达量显著低于HCMV组(P<0.05),但黄芩素对pp65的抑制效果显著高于IE,提示黄芩素可能一方面影响病毒的进入,另一方面影响IE蛋白对其后续蛋白的正常调控而抑制病毒在细胞内的复制。
综上所述,本研究用人星形胶质细胞复制HCMV感染模型,证明了黄芩素作为一种潜在抗病毒药物对抑制HCMV感染具有良好的应用前景,其抗HCMV感染可能是通过影响病毒的进入,改变IE蛋白对后续蛋白的调控进一步影响病毒复制阶段而实现的,而黄芩素抗HCMV感染的机制还需进一步的研究来证实。
[1]Fang F Q,Fan Q S,Yang Z J,et al.Incidence of cytomegalovirus infection in Shanghai,China[J].Clin Vaccine Immunol,2009,16(11):1700-1703.
[2]Gaytant M A,Steegers E A,Semmekrot B A,et al.Congenital cytomegalovirus infection:review of the epidemiology and outcome[J].Obstetrical & gynecological survey,2002,57(4):245-256.
[3]宋扬文,陈忻.中药黄芩药理作用的研究进展[J].中国中医药科技,2010,17(4):375-376.
[4]张喜平,李宗芳,刘效恭.黄芩素的药理学研究概况[J].中国药理学通报,2001,17(6):711-713.
[5]Johari J,Kianmehr A,Mustafa M R,et al.Antiviral Activity of Baicalein and Quercetin against the Japanese Encephalitis Virus[J].International journal of molecular sciences,2012,13(12):16785-16795.
[6]Kenneson A,Cannon M J.Review and meta-analysis of the epidemiology of congenital cytomegalovirus(CMV)infection[J].Reviews in medical virology,2007,17(4):253-276.
[7]Simioni C,Sanchez O R C,Moscovi T,et al.Twin pregnancy and congenital cytomegalovirus:case report and review[J].J Matern Fetal Neonatal Med,2013,26(6):622-624.
[8]Schleiss M R.Prospects for development and potential impact of a vaccine against congenital cytomegalovirus(CMV)infection[J].J Pediatr,2007,151(6):564-570.
[9]吴莹,金叶智,吴珺,等.黄芩主要成分体外抗甲型流感病毒作用的研究[J].北京中医药大学学报,2010,33(8):541-545.
[10]Cotin S,Calliste C A,Mazeron M C,et al.Eight flavonoids and their potential as inhibitors of human cytomegalovirus replication[J].Antiviral Res,2012,96(2):181-186.
[11]乔媛,方建国,肖娟,等.黄芩素抗人巨细胞病毒的体外实验研究[J].中西医结合研究,2013,5(1):13-20.
[12]Lokensgard J R,Cheeran M C,Gekker G,et al.Human cytomegalovirus replication and modulation of apoptosis in astrocytes[J].J Hum Virol,1999,2(2):91-101.
[13]Lecointe D,Hery C,Janabi N,et al.Differences in kinetics of human cytomegalovirus cell-free viral release after in vitro infection of human microglial cells,astrocytes and monocyte-derived macrophages[J].J Neurovirol,1999,5(3):308-313.
[14]Evers D L,Chao C F,Wang X,et al.Human cytomegalovirus-inhibitory flavonoids:studies on antiviral activity and mechanism of action[J].Antiviral Res,2005,68(3):124-134.
[15]Wang X,Huong S M,Chiu M L,et al.Epidermal growth factor receptor is a cellular receptor for human cytomegalovirus[J].Nature,2003,424(6947):456-461.

