停乳链球菌isp基因的克隆与原核表达
剧慧栋,李月颖,马 宁,李晓丽,赵宝华,秦丽云,吕国平,郭玉梅,王 苋,徐保红*
(1.石家庄市疾病预防控制中心,河北 石家庄 050011;2.河北师范大学,河北 石家庄 050024;3.石家庄市环境检测中心,河北石家庄 050000)
停乳链球菌(Streptococcus dysgalactiae)为革兰阳性球菌,是奶牛乳房炎主要致病菌之一,给奶牛养殖造成巨大的经济损失,同时能引起人类菌血症、心内膜炎、脑膜炎、关节炎、呼吸道和皮肤感染。停乳链球菌广泛存在于畜牧养殖场所,在牛口腔、皮肤、垫草、运动场所均能检测出[1]。能引起隐性和临床的奶牛乳房炎,常规的抗生素治疗效果不佳,因此未来防治停乳链球菌的办法,应该从停乳链球菌保守的细胞毒力分泌免疫因子作为潜在的疫苗靶点入手[2]。与停乳链球菌的黏附或侵袭以及抗调理吞噬或抵抗机体吞噬作用有关的表面蛋白有IgG、白蛋白、玻璃体结合蛋白等[3-5]。致病物质A群链球菌产生多种侵袭性酶和外毒素,链球菌致热外毒素B就是A群链球菌以酶原形式分泌到胞外后形成的活性巯基蛋白酶。其能降解宿主胞外基质、免疫球蛋白和补体成分以及A群链球菌自身表面黏附素M蛋白、F1蛋白、C5α肽酶和其他一些分泌蛋白,破坏宿主防御系统,帮助细菌逃避免疫清除,协助A群链球菌最初感染部位的扩散和入侵宿主深层组织[6]。SignalP算法基于神经网络方法和隐马科夫模型2种算法,预测蛋白质N端信号肽的有无。跨膜区螺旋预测软件(TM-HMM)用于预测分析蛋白跨膜螺旋的数目。若跨膜数目等于0,则可认定该蛋白为分泌蛋白[7]。本研究首先是对停乳链球菌的基因组应用SignalP和TMHMM互联网服务器联合进行筛选,筛选出在国内外从未报道过的免疫分泌蛋白基因(Immunogenic secreted protein)isp并从停乳链球菌中克隆到isp基因,进行原核表达,为蛋白的结构与功能的实验室检测提供依据,验证分子信息学对isp蛋白基因的预测正确与否提供了可能,为下一步探讨其分子致病机制、检测试剂的开发和疫苗的研制奠定基础[8-9]。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 停乳链球菌、受体菌BL21(DE3)、表达质粒pET-25b由河北师范大学微生物实验室保存。
1.1.2 仪器与试剂 PCR仪(美国PE公司);克隆载体pMD19-T、T4 DNA连接酶、dNTPs、TaqDNA聚合酶、限制性核酸内切酶(NdeI,XhoI)购自大连宝生物公司;低分子量标准蛋白Marker购自北京全式金公司;DNA凝胶回收纯化试剂盒和质粒小提试剂盒购自威格拉斯生物公司;丙烯酰胺、N N'-亚甲双丙烯酰胺、Tris Base、Glycine、过硫酸铵、2-巯基乙醇、溴酚蓝、考马斯亮蓝R-250购自宝泰克生物科技公司;辣根过氧化物酶标记羊抗兔酶标抗体IgG、兔抗组氨酸标签(his)购自Promega。
1.2 方法
1.2.1 引物设计 根据停乳链球菌isp基因(GenBank:CP002215.1)设计PCR扩增引物详见表1。
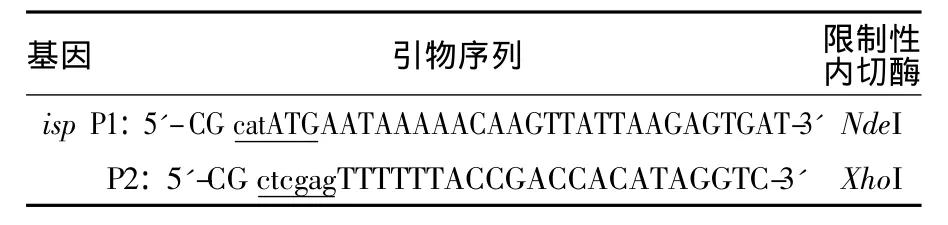
表1 引物设计Table1 Primer design
1.2.2isp基因 PCR扩增及表达载体的构建以停乳链球菌基因组DNA作为模板。反应条件:94℃ 5 min、94℃ 1 min、50℃ 1 min、72℃ 1 min,共进行30个循环,最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳后用长波紫外灯观察并记录结果和拍照。利用DNA快速纯化/回收试剂盒回收阳性PCR产物,将isp基因PCR产物连接到pMD19-T载体上并转化感受态细胞E-.coliDH5α,将转化产物均匀涂布到含X-gal和IPTG的氨苄青霉素平板上,37℃培养过夜。挑取适量平板中白色菌落,提取质粒。用NdeI和XhoI双酶切鉴定,并挑取阳性克隆送测序。将重组质粒pMD19-T-isp和原核表达载体质粒pET-25b均用NdeI和XhoI双酶切,将回收的isp基因片段与pET-25b/NdeI+XhoI片段连接,连接产物转化到受体菌BL21中。提取质粒并进行酶切鉴定,筛选出阳性重组质粒,命名为pET-25b-isp。
1.2.3 重组菌株的诱导表达 将含空质粒pET-25b的大肠埃希菌BL21和重组菌株(BL21)(pET-25b-isp)接种于5 mL含卡那霉素的LB培养液中,37℃摇培过夜后,按体积比1%接种于卡那霉素的新鲜LB培养液中,在37℃摇床培养OD600达到0.4~0.6,加IPTG至终浓度为0.5和1 mmol/L,诱导培养过夜。于诱导前后取菌液1 mL,离心集菌重悬于50 μL dH2O中。诱导后样品经超声裂菌,离心后分别收集上清和沉淀,加入等体积2倍上样缓冲液。将样品煮沸10 min。取15 μL样品进行SDS-PAGE,凝胶于考马斯亮蓝液中染色。以pET-25b空载体为表达阴性对照。
1.2.4 isp蛋白的纯化 将阳性重组菌株大量培养后超声破碎,离心去上清,向上清液中加入2 mL 50%Ni-NTA agrose slurry,4℃低速混匀1 h,使目的蛋白与填充柱材充分结合,将溶液转入Ni-NTA Column中,滤去结合液。向Ni-NTA Column中加入5 mL漂洗缓冲液洗柱,洗涤3次,充分除去未结合的杂蛋白。加入0.5 mL洗脱缓冲液,反复洗脱4~6次,收集洗脱液。洗脱液收集后采用Amicon Ultra-15离心浓缩管(30 K MWCO,Millipore)浓缩蛋白,并将溶液更换为标准缓冲液(10 mmol/L 磷酸钾溶液,pH 8.0,0.5 mmol/L EDTA,0.01%(v/v)2-mercaptoethanol),同时添加10 μmol/L PLP和10%甘油,取5 μL进行SDSPAGE。
1.2.5 isp蛋白的Western blot鉴定 将纯化后的产物分别经SDS-PAGE电泳后转印硝酸纤维素膜上75 V,20 min。转好的膜放入封闭液中封闭过夜。取出膜,TBST洗4次。一抗为兔抗组氨酸标签(his),用封闭液稀释的一抗孵育2 h。TBST洗4次,每次10 min。用封闭液稀释HRP标记的羊抗兔IgG,孵育二抗2 h。TBST洗4次,每次10 min。用TMB显色,出现特异条带立即停止显色。
2 结果与分析
2.1 isp基因的PCR扩增结果
采用特异性引物,以停乳链球菌基因组DNA为模板,扩增出约1 500 bp大小的片段,与目的基因isp大小一致,见图1。
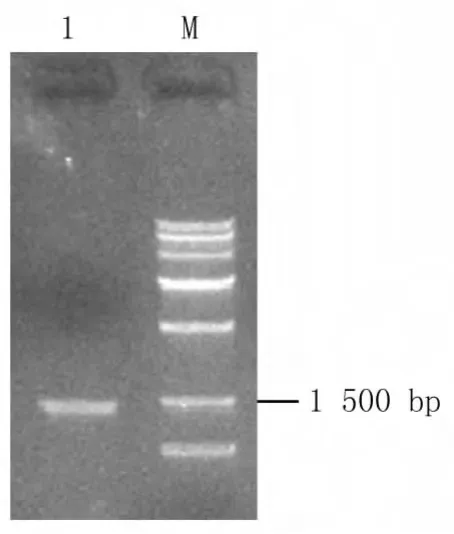
图1 isp基因的PCR结果Fig.1 Amplification of isp gene by PCR
2.2 克隆载体重组质粒的鉴定结果
将上述片段克隆入pMD19-T中,经NdeI/XhoI双酶切得到1 500 bp的片段,挑取阳性克隆进行序列测定和BLAST后,结果表明所获片段与停乳链球菌isp基因序列的同源性为98.57%,表明克隆载体构建正确。阳性克隆命名为pMD19-T-isp。
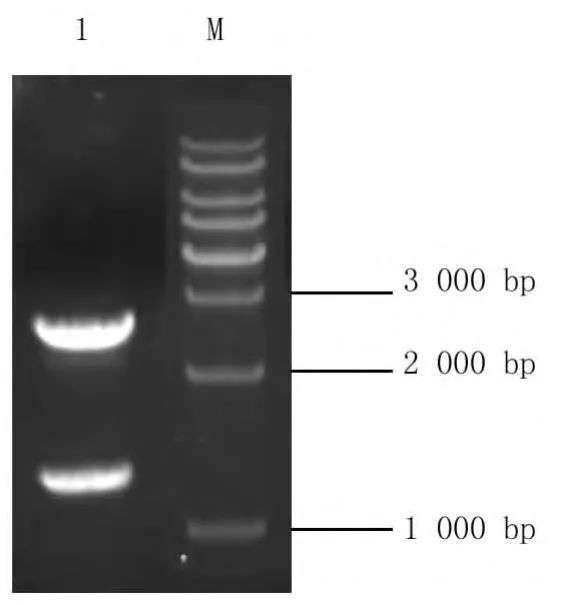
图2 重组质粒pMD19-T-isp的酶切结果Fig.2 Identification of clone plasmid pMD19-T-isp gene
2.3 表达载体重组质粒的鉴定结果
将isp基因片段与表达载体pET-25b连接,转化后提质粒,进行双酶切鉴定,得到结果如图3所示的载体片段和1 500 bp左右的isp片段。酶切结果表明isp基因的原核表达质粒构建成功,命名为pET-25b-isp。
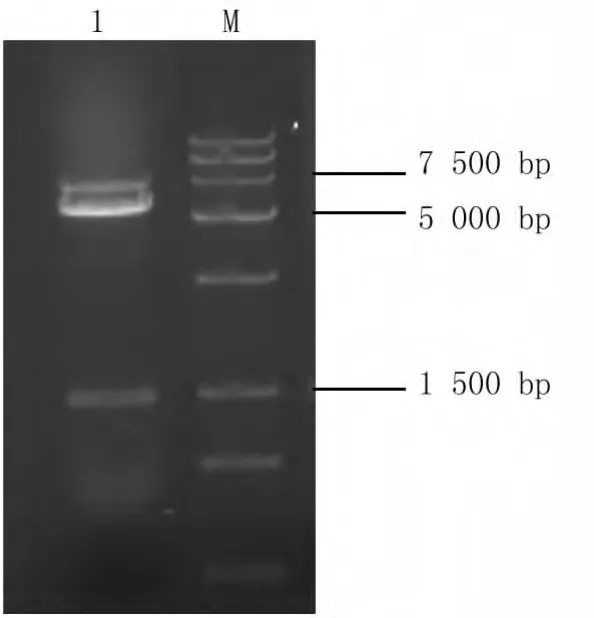
图3 停乳链球菌isp基因表达载体重组质粒的酶切鉴定Fig.3 Identification of recombinant plasmid pET-25b-isp
2.4 重组质粒表达产物SDS-PAGE分析结果
isp基因诱导后制备蛋白样进行SDS-PAGE,可见分子量为53 ku左右的目的条带,这与预期的蛋白表达的分子量一致,结果见图4,表明目的蛋白可在宿主菌中得以高效表达。纯化后蛋白SDS-PAGE结果见图5。
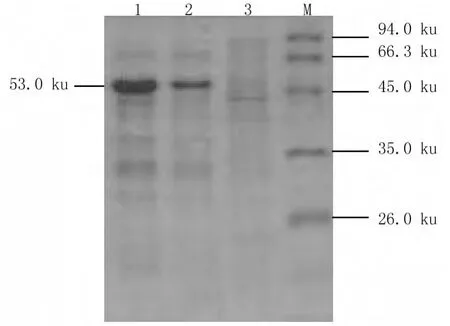
图4 表达产物的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the expressed protein in E.coli

图5 纯化的表达产物的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the pure expressed protein in E.coli
2.5 Western blot检测表达产物结果
纯化蛋白经Western blot分析,在53 ku左右出现特异性杂交条带,证实表达目的蛋白为特异性表达产物,见图6。
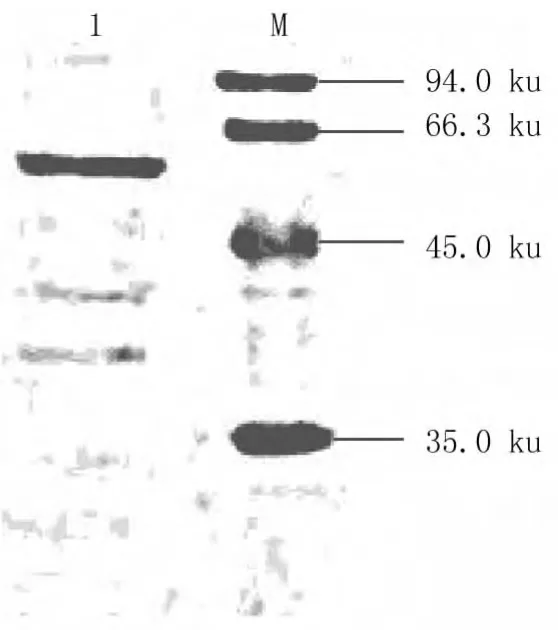
图6 Western blot结果Fig.6 Western blot analysis
3 讨论
分泌蛋白质是一大类介导与细胞外环境之间相互作用的蛋白质,如受体、黏附素、运载蛋白,细胞表面结构复合物如菌毛、分泌性酶类、毒素和毒力因子等。但由于目前的蛋白检测技术水平远远跟不上新基因的数量,因此利用生物信息学工具快速预测基因组信息具有较大的理论指导和实践价值。通过生物信息学的手段,高通量地捕获生物中某一类型的重要蛋白,并在此基础上进一步选择感兴趣的蛋白,是一种较为快速、有效的研究方法。本研究首先对停乳链球菌的基因组应用SignalP和TMHMM互联网服务器联合进行筛选,筛选出在国内外未报道过的免疫分泌蛋白基因(isp)并预测该蛋白的结构和功能,发现该蛋白具有很强的免疫原性、免疫反应性和分泌功能,需要通过实验室对该基因原核表达后进行二维凝胶电泳和质谱鉴定的蛋白质组数据库进行比较验证。陈建森等[10]对幽门螺杆菌分泌蛋白应用SignalP和TMHMM互联网服务器对其结构和功能进行了预测,并在实验室对该蛋白二维凝胶电泳和质谱鉴定的蛋白质组数据库进行比较,结果与生物信息学技术的预测一致。DebRoy等[11]预测了嗜肺军团杆菌中部分未被实验证实的分泌蛋白。刘玉岭等[12]对粟酒裂殖酵母基因组中含信号肽的分泌蛋白做了预测,获得了该物种分泌蛋白组的较全面的资料。因此,利用生物信息学预测和实验验证相结合的研究手段将加速发现停乳链球菌致病的分子机制,并有助于挖掘出具备停乳链球菌特异性诊断和保护性免疫的候选抗原。而isp基因成功地克隆与原核表达为验证生物信息学方法预测的准确性奠定了基础。本文以停乳链球菌基因组DNA作为isp构建的模板,成功扩增出isp基因,经测序检测,与GenBank公布的停乳链球菌(AF354651)中利用SignalP和TMHMM互联网服务器联合预测的isp的基因序列有98.57%的同源性,说明其保守性很强。在试验中观察到,对成功构建的菌株BL21(pET-25b-isp)表达条件经优化后,在温度37℃,诱导时间12 h,IPTG浓度为1 mmol/L时,得到较高的蛋白表达量。Western blot分析结果显示,原核表达得到的融合蛋白具有良好的抗原性,为实验室验证该蛋白的结构功能奠定了基础,对于研究停乳链球菌的分子致病机制、检测试剂的开发和疫苗的研制均具有较好的实践运用价值。
[1]W atts J L.Characterization and identification of streptococci isolated from bovine m am m ary glands[J].J Dairy Sci,1988,71(6):1616-1624.
[2]褚明亮,陈创夫,刘君,等.停乳链球菌MIG基因的克隆和原核表达[J].中国预防兽医学报,2008,30(7):430-434.
[3]Calvinho L F,Almeida R A,S P Oliver.Potential virulence factors ofStreptococcus dysgalactiaeassociated with bovine mastitis[J].Vet Microbiol,1998,61(1-2):93-110.
[4]Rantamki L K,Müller H P.Phenotypic characterization ofStreptococcus dysgalactiaeisolates from bovine mastitis by their binding to host derived proteins[J].Vet Microbiol,1995,46(4):415-426.
[5]Vasi J L,Frykberg L E,Carlsson M,et al.M-like proteins ofStreptococcus dysgalactiae[J].Infect Immun,2000,68(1):294-302.
[6]Chiang-Ni C,WuJJ.Effects of streptococcal pyrogenic exo-toxin B on pathogenesis of streptococcus pyrogenes[J].J Formosmed Assoc,2008,107(09):677-685.
[7]刘雅婷,李成云,李永忠,等.应用计算机手段分析植物病原细菌Ralstonia solanacearum的蛋白质序列[J].云南农业大学学报,2007,22(4):486.
[8]张大生,崔玉东,朱战波,等.金黄色葡萄球菌CHIPS基因克隆及原核表达[J].微生物学杂志,2006,26(2):63-67.
[9]季爱加,宁喜斌.原核表达载体pET28a-EGFP的构建与表达[J].微生物学杂志,2011,31(4):69-73.
[10]陈建森,佘菲菲.全基因组预测幽门螺杆菌的分泌蛋白[J].中国人兽共患病学报,2008,24(7):607-611.
[11]DebRoy S,Dao J,SoderbergM,et al.Legionella pneumophila type II secretome revealsunique exoproteins and a chitinase that promotes bacterial persistence in the lung[J].Proc Natl Acad Sci USA,2006,103(50):19146-19451.
[12]刘玉岭,柳云帆,谢建平.粟酒裂殖酵母全基因组中含信号肽的蛋白质的研究[J].遗传,2007,29(2):250-256.

