一小型温泉中降解淀粉细菌的筛选、鉴定与淀粉酶性质初步分析
莫 芹,李腾云,沈 微*,樊 游,陈献忠,王正祥,石贵阳
(1.江南大学工业生物技术教育部重点实验室,江苏无锡 214122;2.江南大学中国高校工业微生物资源数据平台,江苏 无锡 214122;3.福喜(威海)农牧发展有限公司,山东 乳山 264500)
淀粉酶是催化淀粉分子中α-1,4糖苷键或α-1,6糖苷键水解的一类水解酶。在常温条件下,淀粉均以不溶于水的结晶颗粒形式存在,淀粉酶不能与淀粉分子接触,因此不能起到水解淀粉的作用。当淀粉悬液加热到较高温度时,淀粉颗粒吸水膨胀,发生糊化现象,这时淀粉水解酶才可以充分接触淀粉分子从而使淀粉水解。淀粉的糊化温度一般在60℃以上,因此工业上使用的淀粉水解酶一般需要具有较高的耐热性。温泉是筛选耐热细菌的宝库,同时也是获得耐热型淀粉水解酶及其基因资源的宝库。我国科学家对腾冲温泉中耐热细菌资源的多样性及组成进行了详细的研究,并从中筛选出大量有应用价值的耐热型细菌[1-6]。云南省腾冲县是我国温泉资源最丰富的地区之一,拥有大小数百个温泉。本文以腾冲县腊幸村温泉群中一个未经开发的小型温泉为例,对其中具有淀粉降解能力的细菌进行分离鉴定,为进一步开发新型耐热淀粉酶提供一定的参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 云南省腾冲县腊幸村一小型温泉。
1.1.2 培养基 高温菌培养基:酵母膏1 g,蛋白胨1 g,硫酸镁0.1 g,硝酸钾0.1 g,硝酸钠0.69 g,磷酸钠0.1 g,硫酸亚铁0.002 g,微量元素溶液1 mL,琼脂粉15 g,定容至1 L并调整pH至7;微量元素溶液:在2 L烧杯中加入900 mL纯净水,煮沸后冷却至50℃以下,加入EDTA0.1 g充分溶解,依次加入硫酸锰0.05 g,硫酸铜0.02 g,六水硝酸钴0.01 g,十水硼酸钠0.02 g,钼酸铵0.01 g,硫酸锌0.096 g;淀粉-台盼蓝培养基:可溶性淀粉10 g/L,蛋白胨2 g/L,酵母膏2 g/L,NaCl 5 g/L,Trypan blue 0.1 g/L,pH 7.2~7.4。
1.2 方法
1.2.1 产淀粉酶高温菌的筛选 称取样品悬浮于水中,适当稀释后涂布于高温菌培养基上,65℃培养24 h。选择单菌落点种淀粉培养基平板,55℃培养48 h,观察透明圈。根据菌落形态,挑取淀粉平板上不同形态透明圈的菌落,在淀粉培养基平板上划线分离,55℃培养48 h,进一步观察菌落周围是否有透明圈。有透明圈的细菌初定为产淀粉酶细菌,斜面保存。
1.2.2 产淀粉酶细菌的分子鉴定 细菌染色体DNA的提取按文献[7]介绍的方法进行。斜面上挑取1环菌体于50 μL无菌水中,混匀后加入100 μL裂解液,混匀,85℃保温15 min即得到染色体DNA粗提液,离心后取1 μL直接用于后续PCR。细菌16S rDNA基因扩增方法如下:取200 μL PCR管1支,分别加入36.5 μL去离子水,10×Buffer 5 μL,dNTP 5 μL,引物P16sUP和P16sDW,各1 μL,Taq酶0.5 μL,上述染色体DNA粗提液1 μL。PCR程序:95℃ 5 min;95℃ 0.5 min,50℃ 1 min,72℃,1.5 min,30个循环;72℃ 10 min。PCR反应引物序列:P16sUP:5'-AGAGTTTGATCCTGGCTCAG-3';P16sDW:5'-ACGGCTACCTTGTTACGACTT-3'。PCR产物送上海生工生物工程公司测序。利用美国国家生物技术信息中心的BLAST软件将测序结果与GenBank收录的序列进行同源性搜索比对。
1.2.3 淀粉酶发酵摇瓶培养条件 培养基组成:玉米淀粉2%,豆饼粉2%,(NH4)2SO40.2%,CaCl20.01%。接种细菌斜面培养物1环于上述液体培养基中,55℃摇瓶培养48 h,检测淀粉酶酶活。淀粉酶酶活的测定参照“中华人民共和国行业标准QB1805.1-93:2-淀粉酶活力的试验方法”[8]进行。酶活定义:1 h液化1 g可溶性淀粉所需酶量为1个酶活力单位,以U/mL表示。
1.2.4 酶学性质的测定 分别配制pH 5~9(间隔0.5)的磷酸氢二钾-柠檬酸缓冲液,测定酶在不同pH缓冲液中的酶活力,以最高酶活为100%计算相对酶活确定酶的最适作用pH。在pH 8.5的磷酸氢二钾-柠檬酸缓冲液中,将酶液适当稀释,分别在50~80℃(间隔10℃)条件下检测酶活。以最高酶活力为100%计算相对酶活确定酶的最适反应温度。
2 结果与分析
2.1 样品初筛结果
所有样品用生理盐水适当稀释后直接涂布LB以及pH为7和9的高温菌培养基,65℃培养24 h。根据样品稀释情况推算每克样品形成的菌落数,结果见表1。

表1 不同培养基样品微生物菌落数量统计Table1 Colony counts of hot spring samples on different culture plates
由表1可见,LB培养基虽然是细菌通用培养基,但是对于高温菌的培养效果不佳。在所研究的样品中,只有温泉底部沙土中有3株菌可以在24 h内形成菌落。本文所采集的水、沙土及腐殖质均为碱性,但在中性高温菌培养基上形成的菌落数远高于在pH 9的培养基上形成的菌落数,这说明自然界中嗜中性的细菌比较多。
2.2 降解淀粉细菌的筛选与鉴定
选择上述平板上形态有差异的菌落,点种到淀粉-台盼蓝平板上,55℃培养48 h,观察透明圈。结果显示,在所选择的共计约300个菌落中,大约有10%的菌落可以在淀粉-台盼蓝平板上形成透明圈。不同样品获得的菌落产生透明圈的情况见表2。

表2 样品产淀粉酶菌落数量统计Table2 Colony counts of amylase producing bacteria in hot spring samples
由表2可见,从水样中获得的菌落数量少,且均不具有降解淀粉的能力。从菌落形态看,来源于水样的细菌形成的菌落形态差异小,很可能来源于同一个或亲缘关系接近的物种。在温泉水底泥沙中获得的菌落大约有8%具有降解淀粉的能力。腐殖质中获得的菌落大约有1/3具有降解淀粉的能力。腐殖质中降解淀粉微生物含量高可能是这一环境中含有较多的淀粉等高分子有机物,具有这一类高分子分解能力的微生物具有生长优势。
2.3 降解淀粉细菌的分子生物学鉴定
将上述34株具有淀粉降解能力的细菌划线分离,取单菌落进行16S rDNA基因序列分析。结果显示,从腐殖质中获得的25株菌的16S rDNA序列几乎完全一致,将这些序列提交美国国家生物技术信息中心利用Blast软件进行序列相似性搜索比对,结果显示,25株菌均与Anoxybacillus flavithermus(NCBI登录号:CP000922.1)最为接近,序列完全一致或仅有1~2个碱基差异。从菌落形态看,腐殖质样品中细菌含量丰富,但所形成的菌落形态差异小,分子鉴定的结果同样显示,这个样品中降解淀粉的细菌种类不多。沙土来源的9株菌的鉴定结果如表3所示。

表3 沙土样品中降解淀粉细菌分子鉴定结果Table3 Molecular identification of bacteria which could degrade starch in heat soil samples
由表3可见,沙土样品中降解淀粉细菌的种类比较丰富,筛选获得的9株菌分别属于7个种、3个属。从样品涂布平板后形成的菌落情况看,温泉底部沙土中细菌的数量虽然不大,但是细菌种类非常丰富,主要表现为2个特点:一是菌落形态具有多样性,二是在不同培养基上生长的细菌较多。分子鉴定的结果与根据菌落情况推测的结果一致。图1为根据16S rDNA部分序列绘制的上述9株菌的分类与亲缘关系。

图1 温泉沙土中产淀粉酶细菌的亲缘关系Fig.1 Genetic relationships of amylase producing bacteria in heat soil samples of hot spring
2.4 部分细菌淀粉酶性质初步分析
根据细菌在淀粉-台盼蓝平板上形成透明圈的情况看,其中201、208、207、209四株菌在平板上形成的透明圈较大。其中207和209分别为嗜热脂肪土芽胞杆菌和地衣芽胞杆菌,国内外对这2种细菌的淀粉酶及其基因已经有很多研究。201和208两株菌分别为热葡糖苷酶地芽胞杆菌和黄热厌氧芽胞杆菌。这2株菌的淀粉酶性质国内外均未见报道,因此本研究对这2株菌进行摇瓶发酵后对其淀粉酶性质进行了初步研究。201菌株摇瓶发酵48 h后发酵液酶活达到0.2 U/mL,208菌株酶活为0.3 U/mL。2株菌所产淀粉酶基本性质如图2、图3所示:201菌株淀粉酶最适温度为70℃,在70~80℃范围内酶活基本稳定,最适pH为8,在pH 8~9范围内酶活稳定,是一种有较高耐热性的碱性淀粉酶;208菌株淀粉酶最适反应温度为60℃,最适pH为7,在pH 7~8范围内酶活基本稳定,是一种中性中温淀粉酶。虽然上述2株菌均来源于pH 9的碱性环境,但其淀粉酶在pH 10的环境中酶活大部分丧失。
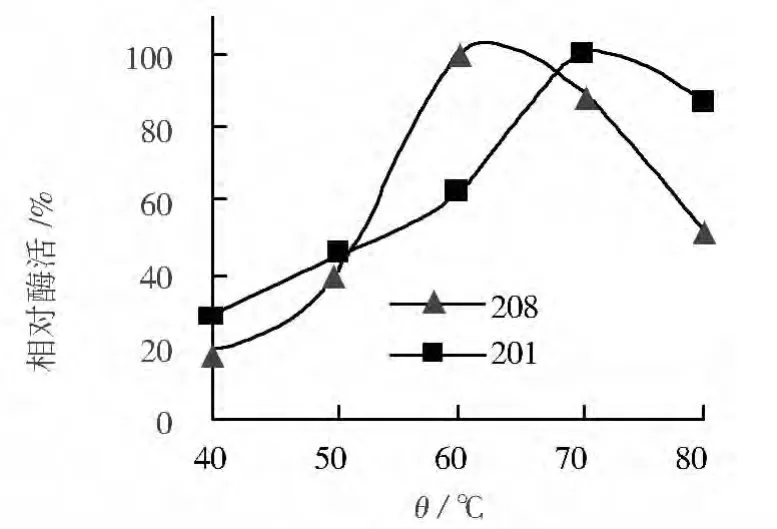
图2 温度对淀粉酶活力的影响Fig.2 Effects of temperature on the activity of amylase

图3 pH对淀粉酶活力的影响Fig.3 Effects of pH on the activity of amylase
3 讨论
本研究采用纯培养技术从温泉中筛选产淀粉酶的耐热细菌。从培养结果看,采用高温菌培养基培养获得的细菌数量和种类均远大于LB培养基,这表明改进培养方法对更好地开发温泉细菌资源具有重要的作用。对温泉不同部位微生物研究结果显示,温泉底部腐殖质和沙土中微生物种类和数量较大。李华兰[3]等利用变性凝胶电泳(DGGE)方法对腾冲热海大滚锅和龙陵县邦腊掌大沸泉中细菌进行分析发现,其底部细沙中存在丰富的原核生物多样性。李沁元等[2]利用DGGE技术分析腾冲热海三温泉中细菌多样性,发现温泉中菌藻席和底部沉积物中细菌种类非常丰富。在近期的一项研究中,研究者采用454焦磷酸测序技术对腾冲县热海和瑞滇2个温泉群的细菌群落进行了详细的分析[9]。瑞滇温泉群与本文采样区腊幸温泉群可能属于同一温泉群,该项研究结果显示,瑞滇温泉沉淀物中的细菌多样性高于水体。本文采用微生物纯培养技术进行研究,结论与上述研究者利用免培养技术获得的结果相似,即温泉中泥沙等固体上附着了大量微生物,并且具有丰富的细菌多样性。温泉底部沙土中微生物的数量比腐殖质中的少,但其微生物种类非常丰富,从沙土中筛选获得的9株降解淀粉的细菌,分别属于7个种,3个属,各菌株间16S rDNA序列均有一定的差异。其中201号和208号2株菌分别为Geobacillus thermoglucosidasius和Anoxybacillus flavithermus,对其胞外淀粉酶进行初步分析,结果显示2株菌所产胞外淀粉酶最适温度分别为60和70℃,接近或超过淀粉糊化温度,具有一定的应用潜力。
[1]郭春雷,彭谦.高温菌研究进展[J].生物学杂志,2003,20(4):1-6.
[2]李沁元,崔晓龙,张东华,等.云南腾冲热海三热泉细菌多样性的研究[J].微生物学通报,2004,31(5):49-54.
[3]李华兰,王涛,李沁元,等.滇西二高温热泉原核生物多样性的比较分析[J].安徽农业科学,2009,37(28):13480-13481,13531.
[4]Lin LB,Chen CY,Peng Q,et al.Thermus rehaisp.Nov.,isolated from Rehai of Tengchong,Yunnan Province,China[J].Basic Microbiology,2002,42(5):337-344.
[5]夏静,陈朝云,上官俊龙,等.一株产异淀粉酶栖热菌的生长和产酶初步研究[J].微生物学杂志,2005,25(5):107-109.
[6]Pagaling E,Grant WD,Cowan DA,et al.Bacterial and archaeal diversity in two hot spring microbial mats from the geothermal region of Tengchong[J].China.Extremophiles,2012,16(4):607-618.
[7]陈源源,牛丹丹,王正祥.一种快速鉴定细菌的方法[J].食品与发酵工业,2007,33(5):29-31.
[8]姜锡瑞,段钢.新编酶制剂实用技术手册[M].北京:轻工业出版社,2002:383-395.
[9]Hou W,Wang S,Dong H,et al.A comprehensive census of microbial diversity in hot spring of Tengchong,Yunnan province China using 16s rRNA gene pyrosequencing[J].PLoS ONE,2013,8(1):e53350.

