双面朊病毒
20世纪50年代,两名医生在偏远的新几内亚高地上研究库鲁病(一种当地流行的怪异神经疾病)的病因。在对死于库鲁病的患者进行尸检后,他们发现:患者大脑部分神经元缺失,并存在大量微孔。这一发现引起一名兽医的注意,他注意到库鲁病和羊瘙痒症之间的相似之处,并建议将库鲁病患者的大脑提取物接种到动物体内,以验证这两种疾病之间的关联。身处新几内亚的医生采纳了这一意见,并在黑猩猩身上进行了接种实验,结果黑猩猩果然表现出类似库鲁病的症状。
“库鲁病是怎么传播到了人身上”仍然是个谜。不过,新几内亚高地人(唯一已知的感染过库鲁病的人群)曾经的一种奇特习俗最有可能是这种病的源头——在族人死去后,生者会吃掉其肌肉和大脑。在这种习俗停止后,当地新出生的人中再也没有出现库鲁病患者,这就进一步佐证了这种推测。
1980年,美国神经学家普鲁西纳宣布他找到了羊瘙痒症的病因。彼时,普鲁西纳研究这种疾病已有多年,他宣称:羊瘙痒症的致病因子没有基因及其他任何遗传物质,该因子是一种此前未被发现的、具有传染性的蛋白质。他将其命名为“朊病毒”。
这个观点一经发表,便遭到许多学者反对。所幸,普鲁西纳在质疑声中坚持了下来,并于1997年因“朊病毒的發现”获得诺贝尔奖。那一年,人们已经意识到克雅氏病和牛海绵状脑病(疯牛病)都和朊病毒有关。还有科学家认为,朊病毒对于阿尔茨海默病等常见神经退行性疾病也有影响。但当时没有人预料到,世界上还存在 “有益”朊病毒——朊病毒出现于生命进化早期,并在其中发挥了重要的生物作用。例如,酵母的环境适应性、动物长期记忆的形成,都离不开朊病毒。

疯牛病
普鲁西纳正在研究库鲁病和疯牛病
人类现在已知,传染性海绵状脑病都有着类似的传播方式:羊之所以感染羊瘙痒症,是因为食用了受到朊病毒污染的草类或羊胎盘;牛之所以感染疯牛病,是因为食用了受感染动物制成的饲料;每年,平均每百万人中有一人罹患克雅氏病,这种病的传染源曾一度被认为是不洁的手术用品,或是提取自人类遗体的生长激素。
普鲁西纳当初提出“朊病毒”概念时,大多数人认为“蛋白质具有传染性”是无稽之谈。当时,人们坚信传染病都是由细菌、真菌或病毒引起的,这些微生物都有基因,以进行复制和传播。
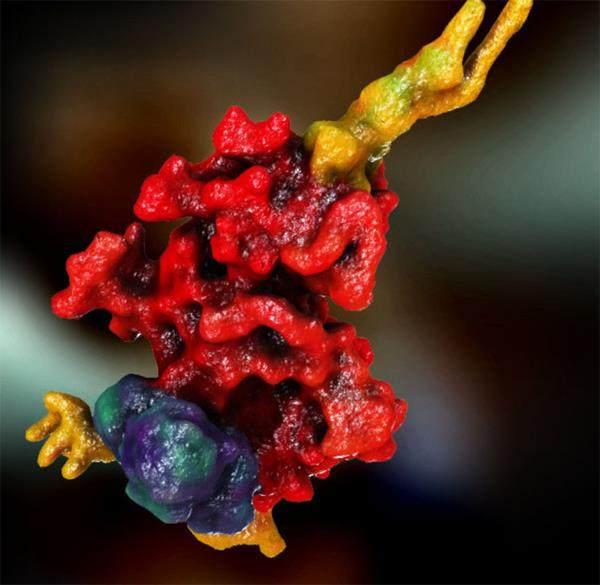
随着科学的进步,人类已经渐渐揭开了朊病毒传染性之谜。蛋白质是由氨基酸组成的。氨基酸链必须以某种方式精确折叠,才能形成具有特定形状和功能的蛋白质。然而,朊病毒蛋白是一种天然无序蛋白。它们会折叠、展开成成千上万种不稳定的中间形态,其中每种形态仅持续几毫秒。朊病毒蛋白通过一种特殊手段折叠成稳定形态——两个构型相同的不稳定中间体彼此结合。这个过程叫作自模板化,其结果就是朊病毒的形成。虽然它发生的概率极低,但是一旦发生,结合就非常稳定。由此诞生的朊病毒会继续结合、稳定更多具有相同形态的朊病毒蛋白,最终形成一条长长的链(具有危害性的蛋白质纤维)。
细胞拥有一套质量控制系统,如果蛋白质折叠出现偏差,这个系统就会介入,纠正这个偏差。正常情况下,错误折叠的蛋白质要么被展开,重新折叠成正确形态,要么直接被分解。然而,控制系统也有好心办了坏事的时候——蛋白质纤维分解成碎片后,反而成了数量更多、尺寸更小的“种子”,这些“种子”会导致其他蛋白质错误折叠。学界认为,这就是朊病毒从一个细胞传播到另一个细胞的秘密。
朊病毒如何导致疾病,人们尚不清楚。有一种可能的解释是:正常蛋白质大量转化为朊病毒形式后,细胞会丢失某种重要组分。不过,“与朊病毒有关的疾病不止传染性海绵状脑病”已经逐渐成为一个不争的事实。虽然目前人们对于朊病毒的研究主要集中在脑部(因为脑细胞难以再生,甚至不能再生,所以更容易受到朊病毒的影响),但是人体的其他部位也有朊病毒疾病发生,比如2型糖尿病。
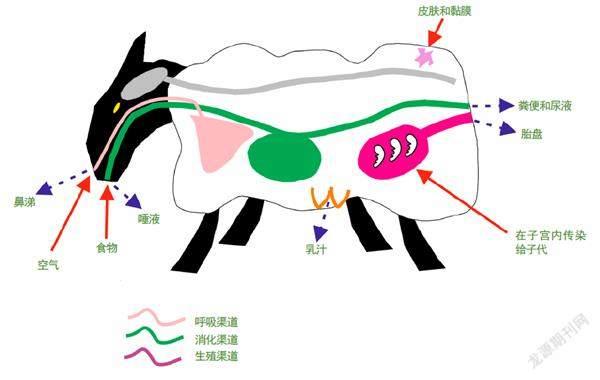
朊病毒的传播途径
朊病毒似乎也与一系列神经退行性疾病密切相关。阿尔茨海默病、帕金森病和肌肉萎缩,这些都是蛋白质聚集引发的大脑病变。目前,学界普遍认为这些致病蛋白质是朊病毒,它们在脑部蔓延是引起这类病的原因。
另一项发现更耐人寻味——朊病毒在进化史上非常古老。人们在动物、植物、细菌、真菌甚至病毒中都发现了能够折叠成两种不同功能结构、其中一种结构能够自主增殖的蛋白质。这些蛋白质能够存续至今,表明朊病毒不只会致病,还可能有利于进化。近年来,越来越多的实验证实了这一猜想。
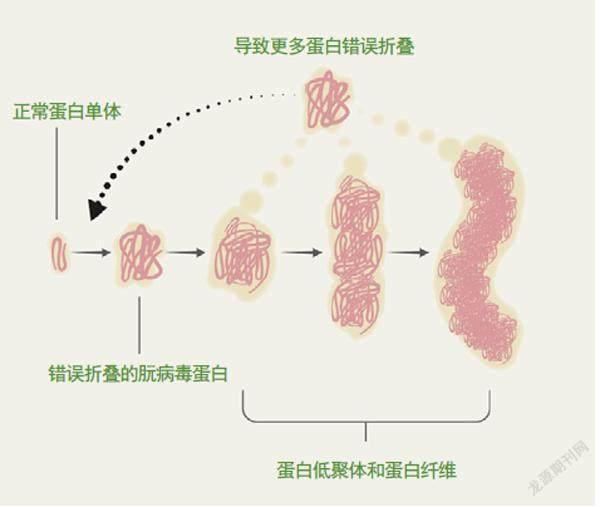
朊病毒的增殖方式
适应不断变化的环境,是生命必然面对的挑战。基因突变随机发生,生命必须接受自然选择,优胜劣汰。同样,如果环境恢复如初,就需要反过来再适应原来的环境。这个过程十分缓慢,即便是酵母这类快速分裂的生物也要花很久。然而,朊病毒蛋白却能赋予生物快速适应的能力。研究表明,如果酵母周围的环境发生变化,比如营养物质成分改变,酵母中的朊病毒蛋白就会转换成新的形态,帮助酵母利用新的食物,适应新的环境。更重要的是,对新环境的适应能力会通过非遗传的方式传递给酵母的所有后代。
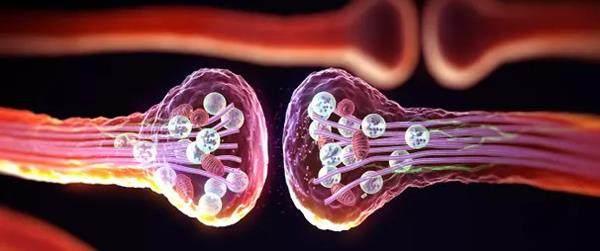
截至目前,仍然只有酵母实验表明朊病毒可以给生物体带来进化优势。然而,科学家已经在各种动物体中发现了“有益”的朊病毒(在生物体内发挥积极作用的朊病毒)。这方面的研究始于20世纪70年代。那时,美国科学家坎德尔和他的研究小组正着眼于从分子层面探究“记忆的机理”。他和同事斯伊在研究海蛞蝓时提出一个问题:长期记忆的形成与突触(神经元之间的接触点)增大有关,而一个神经元可能有数千个突觸,神经元如何知道哪个突触受到了神经冲动的刺激,并据此增大对应的突触?他们认为,一种叫作CPEB的蛋白质可能是其关键所在。CPEB存在于突触中,并且能触发其他组成突触的蛋白质的合成。两人还注意到,CPEB是一种天然无序蛋白。那么,它可能是一种朊病毒吗?为了解答这个问题,他们与其他科学家合作,将酵母中的一种朊病毒替换成了CPEB。结果,这一操作对酵母起到了和朊病毒同样的作用。
坎德尔和斯伊基于这个实验现象指出:反复刺激突触,可以导致CPEB折叠成朊病毒,最终形成长期记忆。CPEB朊病毒作为自模板化的产物,体积太大,无法移动到神经元中。因此,CPEB通过激活其他蛋白质的合成,实现对突触结构的永久改变。2020年,斯伊和同事的果蝇实验证实了这一猜想。坎德尔带领的团队在同一时间报道了类似结果:他们对小鼠的CPEB进行灭活,发现小鼠的长期记忆受到损伤。
从海蛞蝓到果蝇,再到哺乳动物,朊病毒似乎在生物的学习行为中扮演着核心角色。CPEB并不是唯一已知的有益朊病毒蛋白。人们还发现,有一种蛋白质有助于抗病毒蛋白快速传递,在哺乳动物的病毒免疫反应中不可或缺。
科学家正在发掘更多的有益朊病毒蛋白,也在逐步了解它们与有害朊病毒的区别。两者的基本特性有共同之处,比如它们都能够自模板化。然而,与有害朊病毒不同,迄今研究到的有益朊病毒都不会扩散。另外,有益朊病毒的折叠是在外部刺激的作用下发生的,例如化学刺激之于神经突触、环境化学物质之于酵母。这种作用精确而高效,其中的机制在数百万年的进化过程中日趋完善。相反,蛋白质折叠成有害朊病毒的过程既不确定,又难以发生。这就可以解释阿尔茨海默病为何是一种“老年病”:活得越久,有害朊病毒形成的机会就越多。
长期记忆
人类对于朊病毒在生物学中的重要性的认识才刚刚起步。虽然朊病毒确实在一定程度上会把事情搞砸,导致疾病的发生,但是朊病毒“白名单”正一天天丰富起来。当年,身处新几内亚的两位医生在探究食人习俗与库鲁病传播的关系时,能预料到如今的发展吗?也许不能。朊病毒的故事再次告诉我们:好奇心可以改变我们对世界的理解。
突触
——防控专家访谈录

