34例肺曲霉菌病的外科治疗
何 嘉,陈野野,李单青
中国医学科学院 北京协和医学院 北京协和医院胸外科, 北京 100730
·论 著·
34例肺曲霉菌病的外科治疗
何 嘉,陈野野,李单青
中国医学科学院 北京协和医学院 北京协和医院胸外科, 北京 100730
目的 探讨外科手术治疗肺曲霉菌病的原则、方法及效果。方法 回顾性分析北京协和医院1986年1月至2013年12月经手术治疗的34例肺曲霉菌病患者的临床资料及随访结果。3例CT表现为弥漫性病变的患者采用肺楔形切除术获得病理组织;31例局限性病变患者均行病变完整切除,其中肺叶切除术26例,肺段切除术3例,肺楔形切除术2例。27例行开胸手术,7例行胸腔镜手术。结果 无手术死亡病例,所有病例均由病理诊断为曲霉菌感染。术后出现并发症的患者5例(14.7%),分别为肺栓塞1例,急性肺水肿1例,胸腔积液1例,支气管胸膜瘘1例,切口裂开1例。术后2~34 d出院,平均住院时间(10.1±6.2)d。随访1~16年,全部治愈,无复发。结论 对于弥漫性肺部病变怀疑肺曲霉菌病无法明确诊断时,手术肺组织活检可提供病理及病原学诊断的金标准;对于局限性肺曲霉菌病变,外科手术可将病灶完整切除,提供明确的病理诊断,并有效缓解症状,避免复发。
肺曲霉菌病; 胸外科手术
MedJPUMCH,2014,5(3):318-322
肺曲霉菌病是一种罕见的肺部机会感染,多继发于免疫缺陷患者,或肺部存在陈旧性结核、支气管扩张等所致空洞性病变的患者[1]。近年来,随着广谱抗生素、免疫抑制剂、肾上腺皮质激素、抗肿瘤化疗药等的广泛应用,以及诊断手段的不断提高,肺曲霉菌病的发病率呈逐年增高趋势[2]。随着CT、纤维支气管镜、病原学技术的逐渐发展,肺曲霉菌病的诊断率较以往大大提高[3],但它仍然是临床上较易误诊的肺部疾病之一。本研究对本院近28年来手术治疗的34例肺曲霉菌病患者临床资料进行分析,探讨外科手术对于肺曲霉菌病治疗的原则、方法及效果,以提高临床医师对该疾病的认知及诊治水平。
资料和方法
资料
1986年1月至2013年12月北京协和医院胸外科手术治疗的肺曲霉菌病患者共34例,其中男10例,女24例;平均年龄(45.9±15.5)岁(4~70岁),病程1个月~30年,症状包括:咯血(23例,67.6%)、咳嗽(16例,47.1%)、憋气(5例,14.7%)、发热(6例,17.6%)、胸痛(3例,8.8%),3例(8.8%)无症状。既往病史包括肺结核(6例,17.6%)、支气管扩张(4例,11.8%)、先天性肺囊肿(2例,5.9%)。
辅助检查
术前特殊辅助检查主要包括影像学检查(胸部X线片、胸部CT)、支气管镜、痰病原学、经皮肺穿刺活检等。术前行CT检查的患者33例,具有典型影像学表现并诊断为曲霉菌病的患者16例(48.5%),其中5例有新月形气体影征,11例有空洞病变伴内结节影(图1);影像学诊断考虑为结核者6例(18.2%);考虑为肿瘤者3例(9.1%);仅有描述性影像学诊断者8例(24.2%),其中3例为实性占位性病变(局限),1例为双肺弥漫间质性病变,4例为斑片影。1例术前行胸部X线检查,显示薄壁空洞。术前行支气管镜检查者11例,均未发现明确占位性病变。术前有明确病原学诊断的患者5例,其中2例为痰真菌培养,2例为CT引导下经皮肺穿刺组织活检+培养,1例为支气管镜肺泡灌洗液真菌培养。
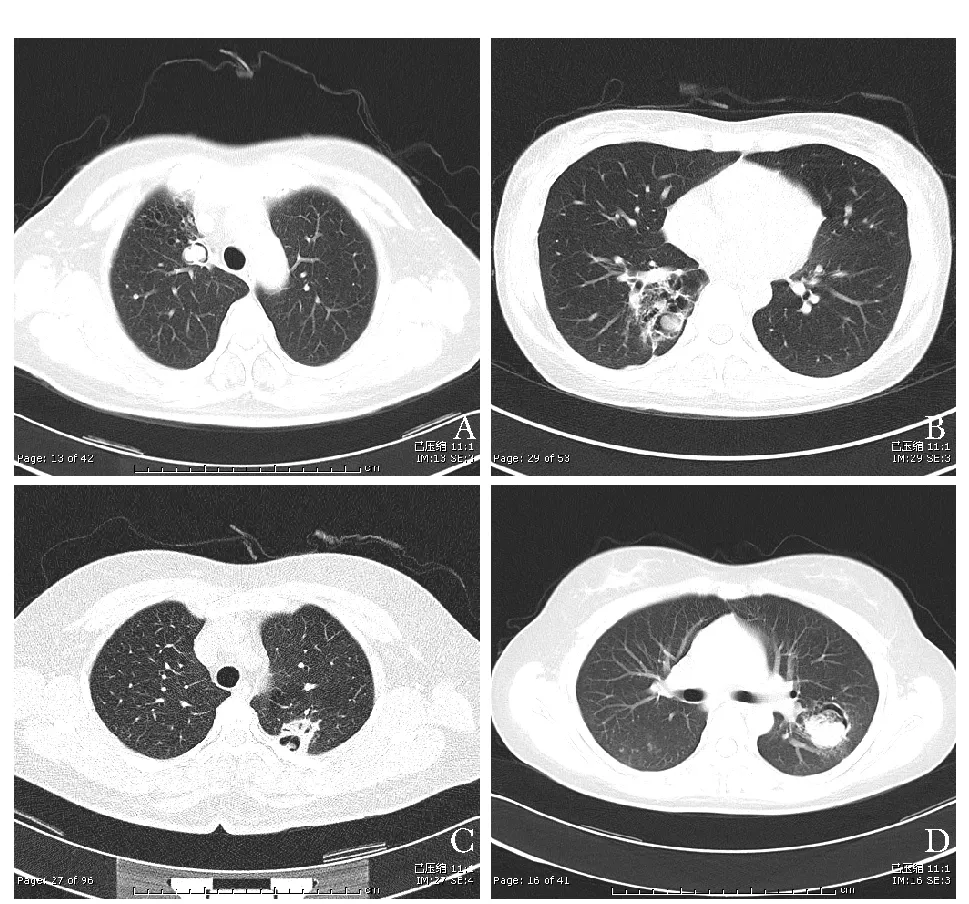
图 1 肺曲霉菌病患者的典型CT表现A.右肺上叶前段局限性簇样多发囊状扩张支气管影,纵隔旁可见一球形软组织密度影,周边可见新月形气体影;B.右肺下叶多发囊状透亮影及厚壁空洞,空洞内可见团片状略低密度影,呈“海蚌含珠征”,右肺下叶支气管扩张,右侧胸膜局部增厚;C.左上肺尖后段结节影,可见孤立厚壁空洞,空洞内软组织密度影;D.左肺下叶背段结节影,边缘见新月形气体影(气体新月征),周围可见斑片影(晕轮征)
临床诊断
术前临床诊断为肺曲霉菌病的患者有22例(64.7%),其中影像学表现为典型曲霉菌病者16例,影像学诊断考虑为结核者6例,影像学描述为斑片影者4例。术前临床诊断误诊为肿瘤者3例(8.8%),误诊为结核者3例(8.8%);术前诊断为性质不明实性占位性病变4例(11.8%),双肺弥漫间质性肺炎并纤维化1例(2.9%)。在术前病程中曾被误诊为结核并应用过抗结核药物治疗的患者有5例(14.7%)。
手术方法
所有患者采用全身麻醉,双腔气管内插管,术中单肺通气。采用标准后外侧切口,或采用腋中线第7或第8肋间作小切口放入30°胸腔镜,先探查胸腔和病灶具体情况,选肺段切除、肺楔形切除或肺叶切除手术方式。3例CT表现为弥漫性病变的患者采用肺楔形切除术获得病理组织以便于诊断,其中2例为开胸手术,1例为胸腔镜手术;31例局限性病变患者均行病变完整切除,其中肺叶切除术26例(22例开胸手术,4例胸腔镜手术),开胸肺段切除术3例(均为下叶背段),胸腔镜肺楔形切除术2例。
结 果
患者手术时间0.7~5.0 h,平均(2.70±0.98)h。术中出血量50~800 ml,平均(330±230)ml。无手术死亡病例。所有病例均由病理明确诊断为曲霉菌感染(病理发现菌丝、孢子等),病理证实同时合并支气管扩张或囊性变的患者有15例(44.1%),其中1例患者扩张支气管黏膜鳞状上皮重度不典型增生伴癌变。术后出现并发症的患者5例(14.7%),分别为肺栓塞1例,急性肺水肿1例,胸腔积液1例,支气管胸膜瘘1例,切口裂开1例。术后2~34 d出院,平均住院时间(10.1±6.2)d。术后继续接受伊曲康唑(11例)、氟康唑(2例)、制霉菌素(1例)、注射两性霉素B(1例)抗真菌药物治疗的患者15例(44.1%)。全部患者术后随访1~16年,均治愈,无复发。
讨 论
肺曲霉菌病为条件致病性肺部真菌感染疾病,包含四大类:侵袭性肺曲霉菌病(invasive pulmonary aspergillosis,IPA)、慢性坏死性曲霉菌病(chronic necrotizing aspergillosis,CNA)、曲霉菌球(aspergilloma)和过敏性支气管肺曲霉菌病(allergic bronchopulmonary aspergillosis,ABPA)[1]。IPA主要是以免疫缺陷为基础(如粒细胞缺乏症、器官移植术后、长期大剂量激素使用、血液系统恶性肿瘤、细胞毒性药物治疗、进展期艾滋病等)的曲霉菌感染[4],病理表现为对肺实质组织的破坏[5],开胸或胸腔镜肺组织活检仍为诊断金标准[6]。CNA是轻度免疫功能缺陷或合并肺部基础疾病(如慢性阻塞性肺疾病)的曲霉菌感染,亚急性病程(大于1个月),影像学发现新生成的或逐渐增大的空洞病变、空洞病变周围有晕(渗出表现),病理表现为肺组织坏死,空洞壁有急慢性炎症,并发现曲霉菌丝[7]。曲霉菌球是最常见也最容易被辨识的肺曲霉菌病表现形式[8],继发于肺部已有空洞病变的曲霉菌感染,肺结核、结节病、支气管扩张、支气管囊肿、肺大疱、肺炎等均可形成空洞并继发肺部感染[9]。对于无肺部空洞病史或无既往影像资料的患者,鉴别曲霉菌球和CNA较为困难,因为无法了解是真菌感染导致的肺部坏死形成空洞,还是空洞形成继发真菌感染[10]。ABPA为对曲霉菌抗原的超敏反应介导的肺部疾病,绝大多数发生在有哮喘或囊性纤维化的患者中[8]。本组病例中,无长期应用激素及免疫抑制剂的患者,明确合并有结核、支气管扩张、先天性肺囊肿基础病史的有12例(35.3%);肺部基础病史阴性的患者中,术后病理证实合并不同程度支气管扩张及囊性变的患者有9例(26.5%)。肺曲霉菌病最常见的症状为咯血,发生率达80%,可能危及生命的大咯血发生率达30%。本组中有咯血症状的患者23例(67.6%),其中出现大咯血(每次大于100 ml)的患者2例(占咯血患者的8.7%),1例于外院行血管造影及左侧支气管动脉、左侧锁骨下动脉、左侧乳内动脉栓塞。咯血的主要机制包括:对病变临近血管的侵袭破坏、真菌释放的内毒素、真菌球在病变内部移动对暴露血管的机械刺激[11- 12]。国外文献报道曲霉菌球引起咯血的死亡率在2%~14%[13- 14]。其他症状包括咳嗽、憋气、发热,可能来自于肺部的真菌感染本身,也可能与患者肺部基础疾病相关。
对于具有典型影像学表现的肺曲霉菌病,应用CT诊断并非难题。典型表现包括:空洞性病变内有结节影、结节状伴周围新月状或环状的空气半月征等[15]。但对于影像学表现不典型的病变,诊断较为困难,例如部分表现为团块影或结节影,缺乏周边的晕征、无空洞表现,常被误诊为结核、肿瘤等,还有部分表现为弥漫性斑片影、磨玻璃影等,常被诊断为其他肺部炎性疾病[16]。本组病例中有33例术前行CT检查,其中16例有典型的CT表现,术前诊断为曲霉菌病,其余17例中仅6例在术前诊断为曲霉菌病,误诊或诊断不明的病例较多。全组病例中有6例在病程中曾被误诊为结核,其中5例曾接受过抗结核药物治疗。
肺曲霉菌病的病原学诊断可通过痰涂片、痰培养获得,亦可通过支气管镜检查,肺泡灌洗液涂片、培养获得。此外,还可通过CT引导下介入穿刺获得组织病理及组织培养。本组病例中术前明确获得病原学诊断者7例(20.6%),其中3例来自痰培养,3例来自CT引导下穿刺,1例来自支气管镜肺泡灌洗液的真菌。
弥漫性的肺曲霉菌病治疗主要有赖于以抗真菌药物为主的内科治疗,外科手术仅在无法明确诊断时,作为提供活检获得病理及病原学标本的手段。本组病例中,术前CT表现为弥漫性病变者3例,术前均有支气管镜及反复痰培养检查,未能获得阳性诊断,遂采用肺楔形切除手术方法获得病理诊断,其中2例为开胸手术,1例为胸腔镜手术。术后患者规律接受抗真菌治疗,全部治愈。
对于曲霉菌球(或局限性肺曲霉菌病)的治疗,目前尚无统一意见。部分医生认为无症状的患者可以不予治疗,除非症状(主要是咯血)出现[8,13]。甚至有部分医生认为对于小咯血的患者,亦可采用保守治疗的办法。但是曲霉菌球的病变及临床症状很难自行消失;Garvey等[14]报道多达30%的小咯血患者会在后续的病程中出现致死性大咯血;抗真菌药物治疗往往毒副作用较大,很多患者无法耐受治疗剂量;对于影像学表现不典型的病例,较难明确诊断,部分病例与早期肺癌难以鉴别[17],甚至有罕见病例为曲霉菌球合并肺癌[18](本组病例中有1例患者术后病理提示合并早期鳞状细胞癌);手术治疗可将病变完整切除,有效控制患者症状,同时提供明确的病理诊断,因此全身情况及肺功能可以耐受的患者,手术仍然是曲霉菌球最主要的治疗方式[18- 19]。手术方式包括肺叶切除、肺段切除、肺楔形切除。切除范围主要取决于病变大小及部位:中心型或较大病变,应行肺叶切除术;病变较小、位于周边时,在保证病变完整切除、残存肺组织良好的情况下,可行肺段切除和肺楔形切除[20]。本组病例中,31例局限性病变的患者均行病变完整切除,其中肺叶切除26例,肺段切除3例,肺楔形切除2例。全组无死亡病例,术后随访,均无复发。术后并发症5例,其中支气管胸膜瘘1例。文献报道肺曲霉菌病手术并发症主要为支气管胸膜瘘,发生率在1.6%~15.8%[18,21],其他并发症包括残余空腔、脓胸、呼吸功能衰竭等,主要与患者基础肺部疾病相关[13,22]。手术前对患者肺部基础病变、残余肺功能评价至关重要。术后应用抗真菌药物,主要用于预防胸腔内继发曲霉菌感染致真菌性脓胸,并减少肺内曲霉菌病的复发。但Ichinose等[23]认为术后辅助抗真菌药物治疗对于病变完整切除、术中病变未破入胸腔的患者并无获益。对于曲霉菌病术后的辅助药物治疗仍需要更多的临床研究提供确切的证据。
近年来胸腔镜技术广泛开展和应用,对于病变较小,胸膜腔没有受累、无明显粘连的肺曲霉菌病病例,适合采用胸腔镜方法切除。本组病例中胸腔镜肺叶切除术4例,胸腔镜肺楔形切除术3例。相比于传统开胸手术,胸腔镜手术具备操作更加精细、术中出血少、创伤小、恢复快等优势[24]。尤其对于肺楔形切除术,操作相对简单,更适合采用胸腔镜的方式。对于胸腔镜手术切除的术后并发症及治疗效果的评价,因本组病例样本量无法达到统计学要求,有待于收集更多胸腔镜手术治疗肺曲霉菌病病例,以行进一步评价。
[1]Soubani AO, Chandrasekar PH. The clinical spectrum of pulmonary aspergillosis[J]. Chest, 2002, 121: 1988- 1999.
[2]Verweij PE, Denning DW. The challenge of invasive aspergillosis: increasing numbers in diverse patient groups[J]. Int J Infect Dis, 1997,2:61- 63.
[3]Adil A, Amraoui F, Kadiri R. Role of computed tomography in pulmonary aspergillosis. 20 case[J]. Presse Med, 2001, 30: 621- 625.
[4]Fukuda T, Boeckh M, Carter RA, et al. Risks and outcomes of invasive fungal infections in recipients of allogeneic hematopoietic stem cell transplants after nonmyeloablative conditioning[J]. Blood, 2003, 102:827- 833.
[5]Chamilos G, Luna M, Lewis RE, et al. Invasive fungal infections in patients with hematologic malignancies in a tertiary care cancer center: an autopsy study over a 15-year period (1989—2003)[J]. Haematologica, 2006, 91:986- 989.
[6]Ruhnke M, Bohme A, Buchheidt D, et al. Diagnosis of invasive fungal infections in hematology and oncology- guidelines of the Infectious Diseases Working Party (AGIHO) of the German Society of Hematology and Oncology (DGHO)[J]. Ann Hematol, 2003, 82:S141- S148.
[7]Binder RE, Faling LJ, Pugatch RD, et al. Chronic necrotizing pulmonary aspergillosis: a discrete clinical entity[J]. Medicine (Baltimore), 1982, 61:109- 124.
[8]Zmeili OS, Soubani AO. Pulmonary aspergilosis: a clinical update[J]. Q J Med, 2007, 100: 317- 334.
[9]Daly RC, Pairolero PC, Piehler JM, et al. Pulmonary aspergilloma, results of surgical treatment[J]. J Thorac Cardiovasc Surg, 1986,92:981- 988.
[10]Denning DW. Chronic forms of pulmonary aspergillosis[J]. Clin Microbiol Infect, 2001, 7:S25- S31.
[11]蒋良双, 李秩川, 陈晖,等. 肺曲菌病的诊断与外科治疗[J]. 中国胸心血管外科临床杂志,2007,14: 232- 234.
[12]Aslam PA, Eastridge CE, Hughes FA Jr. Aspergillosis of the lung-an eighteen-year experience[J]. Chest, 1971, 59:28- 32.
[13]Jewkes J, Kay PH, Paneth M, et al. Pulmonary aspergilloma: analysis of prognosis in relation to haemoptysis and survey of treatment[J]. Thorax, 1983, 38:572- 578.
[14]Garvey J, Crastnopol P, Weisz D, et al. The surgical treatment of pulmonary aspergillomas[J]. J Thorac Cardiovasc Surg, 1977, 74:542- 547.
[15]谢继承.肺曲菌病的CT诊断[J]. 中国医学影像学杂志,2005,13:151- 153.
[16]陈佩荣, 周科峰. 19例肺曲霉菌病的CT诊断[J]. 临床肺科杂志, 2010, 15: 1782- 1783.
[17]Manabu Y, Akira N, Akira H, et al. Aspergilloma mimicking a lung cancer[J]. Int J Surg, 2013, 4: 690- 692.
[18]Chen QK, Jiang GN, Ding JA. Surgical treatment for pulmonary aspergilloma: a 35-year experience in the Chinese population[J]. Interact Cardiovasc Thorac Surg, 2012, 15: 77- 80.
[19]郭楠楠, 李珊珊, 于长海,等. 肺曲霉菌病外科治疗分析(附15例报告)[J].心肺血管病杂志, 2012,31: 299- 301.
[20]Muniappan A, Tapias LF, Butala P, et al. Surgical therapy of pulmonary aspergillomas: a 30-year North American experience[J]. Ann Thorac Surg, 2014, 97: 432- 438.
[21]Brik A, Salem AM, Kamal AR, et al. Surgical outcome of pulmonary aspergilloma[J]. Eur J Cardiothorac Surg, 2008,34:882- 885.
[22]Shakil F, Shaza M, Mohan D, et al. Results of surgery for chronic pulmonary aspergillosis, optimal antifungal therapy and proposed high risk factors for recurrence-a National Centre’s experience[J]. J Cardiothorac Surg, 2013, 8: 180.
[23]Ichinose J, Kohno T, Fujimori S. Video-assisted thoracic surgery for pulmonary aspergilloma[J]. Interact Cardiovasc Thorac Surg, 2010, 10:927- 930.
[24]Chen QK, Chen C, Chen XF, et al. Video-assisted thoracic surgery for pulmonary aspergilloma: a safe and effective procedure[J]. Ann Thorac Surg, 2014, 97: 218- 223.
Surgical Treatment for Pulmonary Aspergillosis: Report of 34 Cases
HE Jia, CHEN Ye-ye, LI Shan-qing
Department of Thoracic Surgery, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100730, China
LI Shan-qing Tel: 010-69152630, E-mail:lsq6768@sohu.com
Objective To summarize the principles, techniques, and effectiveness of the surgical treatment for pulmonary aspergillosis. Methods The clinical data of 34 pulmonary aspergillosis patients who had undergone surgical treatment in our department from January 1986 to December 2013 were retrospectively analyzed. Three patients with diffuse lesions manifested by CT image
wedge resection to obtain pathological tissues. Thirty-one patients with localized lesions received complete resection, in whom the surgical procedures included lobectomy (n=26), segmentectomy (n=3), and wedge resection (n=2). Thoracotomy was performed in 27 patients and video-assisted thoracoscopic surgery in 7 patients. Results No perioperative death was noted. All the 34 patients were pathologically confirmed as with pulmonary aspergillosis. Five patients (14.7%) suffered from postoperative complications including pulmonary embolism (n=1), acute pulmonary edema (n=1), pleural effusion (n=1), prolonged air leak (n=1), and wound disruption (n=1). All patients were successfully discharged 2-34 days after the surgery, and the average hospital stay was (10.1±6.2) days. No relapse was noted during the 1-16 years of follow-up. Conclusions For patients with suspected pulmonary aspergillosis, which may present as diffuse lung lesions, surgical biopsy provides the “golden standard” of pathological and pathogenic diagnosis. For patients with localized pulmonary aspergillosis, surgical treatment can completely remove the lesions, provide definite pathological diagnosis, and effectively relieve the symptoms.
pulmonary aspergillosis; thoracic surgical procedures
李单青 电话:010-69152630,E-mail:lsq6768@sohu.com
R655.3
A
1674-9081(2014)03-0318-05
10.3969/j.issn.1674-9081.2014.03.014
2014- 05- 10)

