全自动尿沉渣分析仪的临床应用评价
杜 娟,徐 佳,郭 野,张 峰,吴 卫,李建英,李 悦,金 晶,程 闽,崔 巍
中国医学科学院 北京协和医学院 北京协和医院检验科,北京100730
·论 著·
全自动尿沉渣分析仪的临床应用评价
杜 娟,徐 佳,郭 野,张 峰,吴 卫,李建英,李 悦,金 晶,程 闽,崔 巍
中国医学科学院 北京协和医学院 北京协和医院检验科,北京100730
目的 对一种全自动尿沉渣分析仪的临床应用进行评价,并建立其对尿液有形成分分析的正常参考范围。方法 从仪器精密度、携带污染率、分析测量范围以及与人工镜检的可比性4个方面进行评价,同时建立仪器检测红细胞(red blood cell,RBC)、白细胞(white blood cell,WBC)、鳞状上皮细胞(squamous epithelial cell,EC)及管型的正常参考范围。结果 RBC低值、中值和高值精密度的变异系数分别为129.10%、20.59%和7.80%;WBC低值、中值和高值精密度的变异系数分别为65.73%、14.30%和13.00%;EC中值和高值精密度的变异系数分别为27.01%和21.46%。RBC、WBC和EC的携带污染率均为0;RBC分析测量范围为0~83 608个/μl,WBC分析测量范围为0~15 624个/μl,细菌分析测量范围根据菌种不同而结果有明显差异。仪器与人工镜检相比,RBC、WBC和EC的一致率分别为82.80%、73.82%和57.56%。男性尿液有形成分的参考范围显示,RBC为0~8个/μl,WBC为0~12个/μl,EC为0~13个/μl,管型为0~4个/μl,结晶为0~34个/μl;女性尿液有形成分的参考范围显示,RBC为0~12个/μl,WBC为0~21个/μl,EC为0~42个/μl,管型为0~4个/μl,结晶为0~2个/μl。 结论 该全自动尿沉渣分析仪对尿中的RBC和WBC有较好的识别性能,对结晶、管型、真菌、异形细胞等难以自动识别的成分,可利用仪器的审核功能进行人工识别,必要时进行人工复检,为临床提供可靠的检验报告。
尿沉渣分析仪;临床应用;参考范围
MedJPUMCH,2014,5(3):290-296
尿液有形成分检查,又称尿沉渣检查,是对尿中可出现的多种有形成分如细胞类、管型类、结晶类、微生物类等物质进行识别、鉴定和计数,它对泌尿系统疾病的诊断和鉴别诊断、病情观察、判断预后等具有重要意义。传统尿沉渣涂片显微镜检查具有操作简便的特点,但这种方法对尿中有形成分检查的精密度很差,不同实验室或同一实验室在不同时间检查的结果缺乏可比性。全自动尿沉渣分析仪(流式或图像识别式)可以快速和定量计数尿液中大量有形成分,使尿沉渣检查实现定量和规范,为临床提供更加准确可靠的检验报告。鉴于尿沉渣有形成分的复杂性和变异性,不同尿沉渣分析仪检测原理和识别能力有较大差别。为了解US 2026尿沉渣分析仪的检测性能是否符合临床需要和要求,本研究参考国际血液学标准化委员会(International Committee for Standardization Haematology,ICSH)对血细胞分析仪的评价方案[1]以及美国临床与实验室标准化协会(Clinical and Laboratory Standards Institute, CLSI)对仪器与方法的评价文件要求[2],对仪器精密度、携带污染率、线性以及与人工镜检的可比性4个方面进行了评价,同时对健康人尿液有形成分进行正常参考范围调查。
对象和方法
对象
随机选择2013年8月至10月北京协和医院1058例门诊患者的新鲜尿液标本用于仪器综合性能的评价。选择2013年6月1日至28日期间北京协和医院健康体检中心的366名表观健康人的新鲜尿液标本用于正常参考范围的建立,其中男性217名,平均年龄为42.97岁(4~81岁);女性149名,平均年龄为43.39岁(18~74岁)。所有入选对象均已签署知情同意书。表观健康人入选标准:近6个月无服药史及发热,无泌尿系统疾病,无高血压、糖尿病、肝炎、风湿病等全身性疾病,无泌尿系统疾病的家族史、泌尿道外科手术史及泌尿道结石史,无浮肿症状,女性在非月经期内,尿液干化学潜血、尿糖、白细胞、蛋白、亚硝酸盐均阴性,生化肌酐、尿素均在正常范围内,腹部超声检查无明显异常。
仪器和设备
US 2026型全自动尿沉渣分析仪及其配套试剂为重庆天海公司产品, SIEMENS ATLAS型全自动干化学分析仪为西门子公司产品,FastRead尿沉渣定量计数板为威士达公司产品。
研究方法
精密度检测:使用低、中、高值门诊患者的新鲜尿液标本,混匀后连续进行11次测定,去除第一个数据,取后10次结果分别计算变异系数。
携带污染率检测:高值标本连续测3次,结果记为H1、H2、H3,立即对低值标本测3次,记为L1、L2、L3,携带污染率(%)=(L1-L3)/(H3-L3)×100%。
分析测量范围:制备富含细胞成分的尿样,高浓度红细胞(red blood cell,RBC)的细胞数为83 608个/μl,白细胞(white blood cell,WBC)的细胞数为15 624个/μl,用正常尿液样本上清液作1∶2、1∶4、1∶16、1∶64、1∶256的系列稀释,以稀释计算值作为理论值,各稀释尿样的实测值与理论值进行回归统计,验证仪器对细胞的分析测量范围。将健康体检者新鲜尿液标本上清液制作成混合尿基质,将不同浓度泌尿系统感染常见革兰阴性杆菌(大肠埃希菌)、革兰阳性球菌(金黄色葡萄球菌)和真菌(白色念珠菌)菌液加入制备混合尿基质中,制备成富含细菌或真菌的尿样,再按上述浓度梯度进行稀释,验证仪器对细菌或真菌的分析测量范围。
仪器与人工镜检的比较:使用1058例门诊患者新鲜尿液标本,用SIEMENS ATLAS干化学法检测尿液各项指标,用该全自动尿沉渣分析仪检测尿液有形成分,同时人工吸取适量标本滴入FastRead定量计数盘计数尿液有形成分,记录RBC(个/μl)、WBC(个/μl)、鳞状上皮细胞(squamous epithelial cell, EC)(个/μl),再准确吸取标本10 ml,400×g离心5 min后,用一次性吸管弃去上清液,准确保留0.5 ml沉渣,再混匀后于高倍镜镜检,记录RBC(最低-最高/高倍视野)、WBC(最低-最高/高倍视野)、EC(最低-最高/高倍视野)、管型种类及数量(最低-最高/低倍视野)和结晶种类。将全自动尿沉渣分析仪及非离心尿人工计数结果(个/μl)分为0≤X<10、10≤X<20、20≤X<30、30≤X<50、50≤X<100、100≤X<200、200≤X<500、X≥500八个等级,计数不同等级下仪器与人工结果的一致性,仪器与人工计数结果在同一等级范围内者视为一致。两名技术人员离心尿镜检结果取交集,管型、结晶取并集,RBC<3个/高倍视野为阴性,≥3个/高倍视野为阳性;WBC<5个/高倍视野为阴性,≥5个/高倍视野为阳性;管型、结晶存在即为阳性。以人工镜检为金标准,对仪器计数结果与人工计数结果作受试者工作特征(receiver operating characteristic,ROC)曲线。曲线下面积越接近于1,说明诊断效果越好。曲线下面积在0.5~0.7时有较低准确性,在0.7~0.9时有一定准确性,在0.9以上时有较高准确性。同时,评估其对RBC、WBC、管型和结晶的诊断灵敏度、特异性。
参考范围的建立:用一次性洁净塑料尿杯留取清洁随机尿液不少于20 ml,用通过严格性能验证后的SIEMENS ATLAS干化学分析仪[3]检测尿液干化学各项指标,用该全自动尿沉渣分析仪检测尿液有形成分,同时人工吸取适量标本滴入FastRead定量计数盘计数尿液有形成分,记录RBC(个/μl)、WBC(个/μl)、EC(个/μl),再准确吸取标本10 ml, 400×g离心5 min后,用一次性吸管弃去上清液,准确保留0.5 ml沉渣,再混匀后于高倍镜镜检,记录RBC(最低-最高/高倍视野)、WBC(最低-最高/高倍视野)、EC(最低-最高/高倍视野)、管型种类及数量(最低-最高/低倍视野)和结晶种类。观察离心尿10个视野以上,将RBC<3个/高倍视野、WBC<5个/高倍视野、无病理管型或结晶视为正常尿液。
统计学处理
采用SPSS 11.5统计软件进行统计分析,所检测的尿液有形成分参数在被调查人群中呈偏态分布,得出中位数和生物参考区间,即以检测健康人群的0~95%为生物参考范围,95%上限的数值为基准界限计算值。比较≤18岁、19~45岁、46~65岁和≥66岁四个年龄段及不同性别尿液RBC、WBC、EC、管型和结晶结果,并确立参考值范围。采用Medcalc专业软件,进行Passing-Bablok回归分析,分析仪器与人工计数结果的一致性;绘制Bland-Altman偏差图,分析仪器与人工计数的差异分布;以人工镜检为金标准,对仪器计数结果与人工计数结果作ROC曲线,分析仪器对尿液有形成分的诊断效能。
结 果
精密度检测结果
对3个不同浓度水平的标本,进行同一项目检测,结果的一致性程度见表1。
携带污染率检测结果
高值标本连续测定3次,随即连续测定低值标本3次,得到仪器检测WBC、RBC及EC的携带污染率均为0(表2)。
分析测量范围结果
RBC数量在0~83 608个/μl之间,全自动尿沉渣分析仪测定RBC线性良好,y=1.008x-1766,R2=0.997,r=0.9986;WBC数量在0~15 624个/μl之间,测定WBC线性良好,y=1.000x+139.4,R2=0.997,r=0.9987。该仪器测定细菌线性根据菌种不同,结果有明显差异:白色念珠菌数量在0~9688个/μl之间时线性良好,y=0.973x+72.18,R2=0.999,r=0.9995;大肠杆菌数量在0~12 414.06个/μl之间时线性良好,y=1.050x-374.3,R2=0.994,r=0.9973;测定金黄色葡萄球菌线性欠佳,y=0.995x-1031,R2=0.897(图1)。
仪器与人工镜检计数结果的比较
1058例标本中,使用全自动尿沉渣分析仪与人工计数RBC结果一致的有876例,一致率为82.80%;计数WBC结果一致的有品781例,一致率为73.82%;计数EC结果一致的有609例,一致率为57.56%(表3~5)。
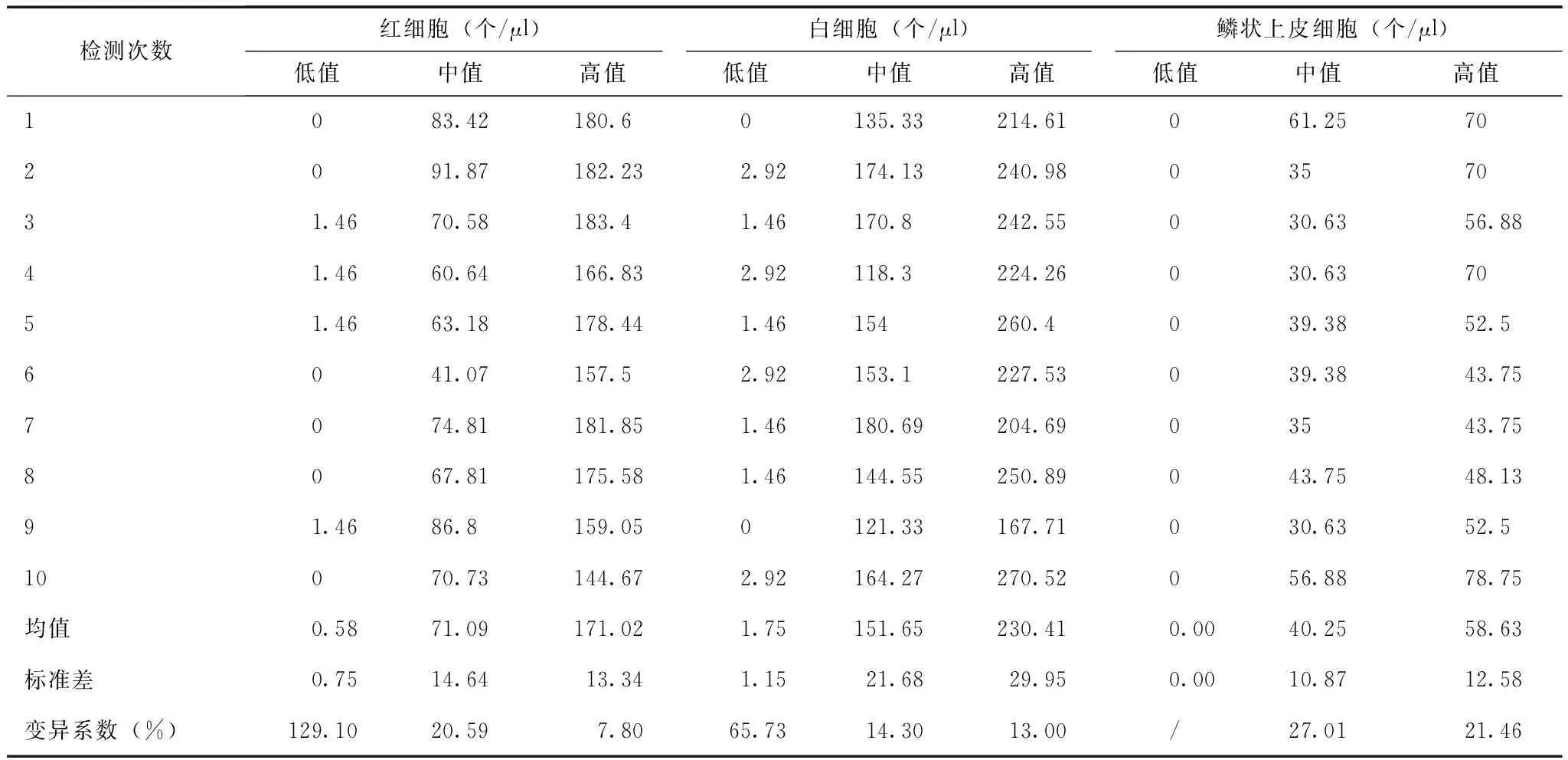
表 1 仪器主要检测项目的精密度结果
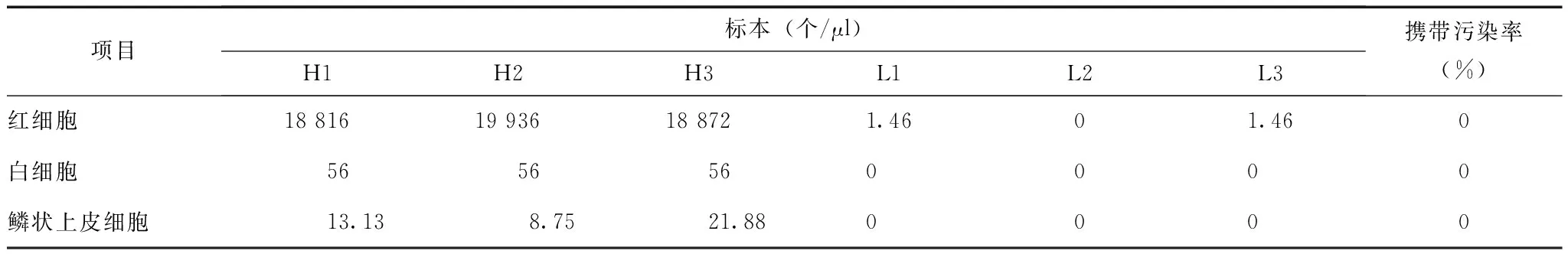
表 2 仪器携带污染率结果
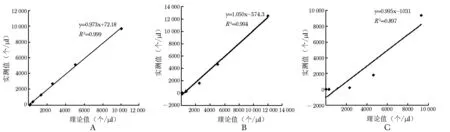
图 1 全自动尿沉渣分析仪对几种泌尿系统感染常见病原菌的分析测量范围 A.白色念珠菌;B.大肠杆菌;C.金黄色葡萄球菌
Bland-Altman偏差图结果
RBC标本共1169例,在Bland-Altman偏差图上一致性界限外的点仅2例,百分比远小于5%,但此2点与理论值差异太大,回顾分析发现此2例均为肉眼血尿标本。人工计数肉眼血尿标本时,细胞密度太大,计数结果受细胞分布情况、人为因素影响大。去除该2例肉眼血尿标本后,仪器和人工计数结果的一致性较好(图2A、B)。此外,WBC仪器和人工计数结果的一致性较好(图2C),但可见仪器计数EC结果基本高于人工计数结果,一致性欠佳(图2D)。
Passing-Bablok回归分析
分析仪器计数结果与人工计数结果(个/μl,未离心尿)间相关性,可见仪器与人工计数RBC、WBC及EC相关性均较好(表6)。
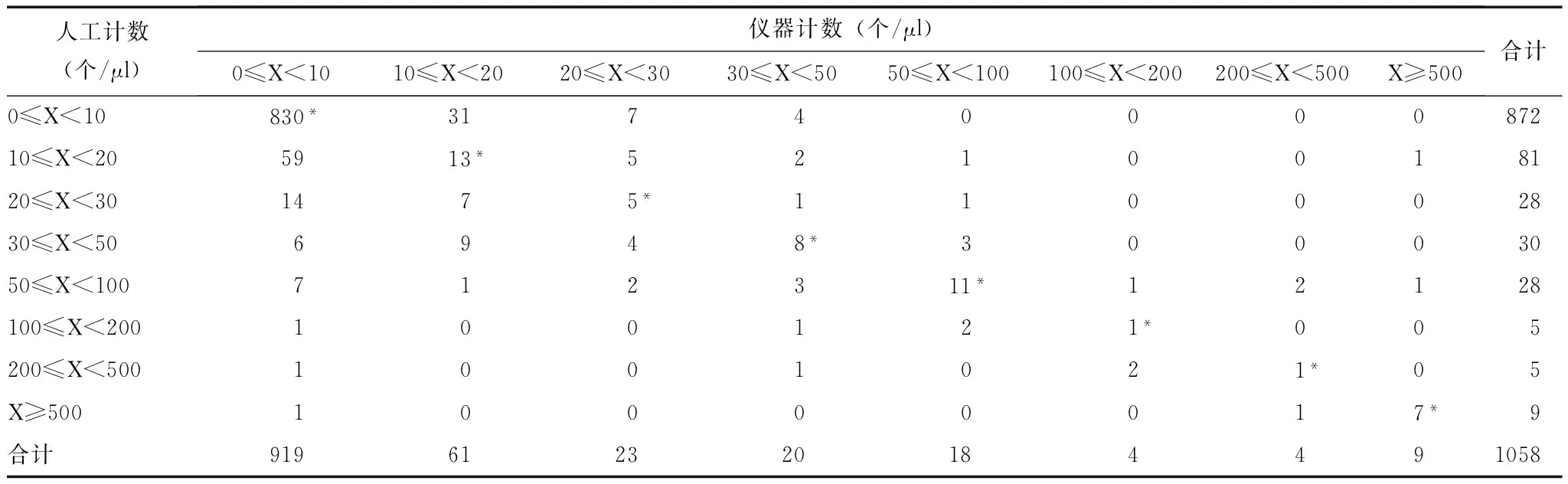
表 3 全自动尿沉渣分析仪与人工计数红细胞的一致性评价
*仪器与人工计数红细胞在同一等级范围内,视为结果一致
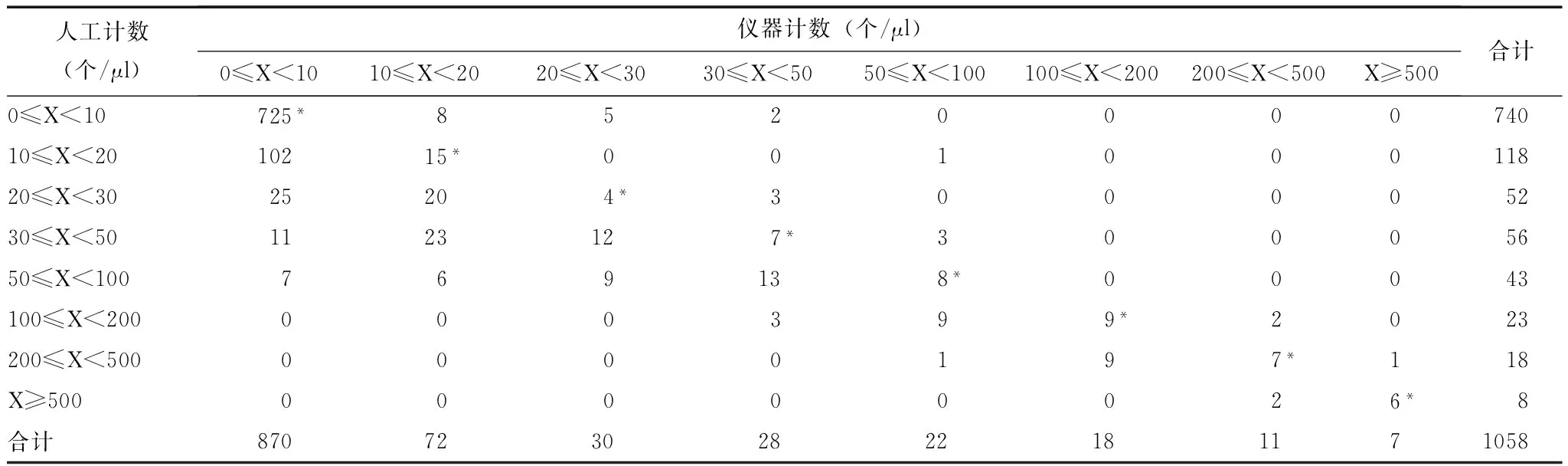
表 4 全自动尿沉渣分析仪与人工计数白细胞的一致性评价
*仪器与人工计数白细胞在同一等级范围内,视为结果一致
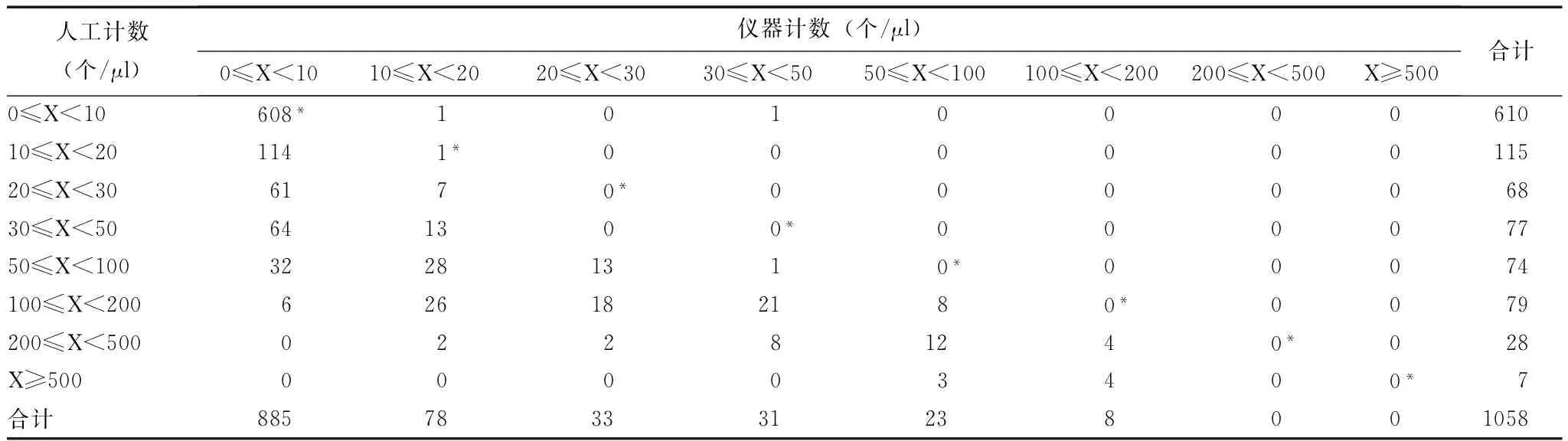
表 5 全自动尿沉渣分析仪与人工计数鳞状上皮细胞的一致性评价
*仪器与人工计数鳞状上皮细胞在同一等级范围内,视为结果一致
ROC曲线
以人工镜检作为金标准,该全自动尿沉渣分析仪检测RBC的ROC曲线下面积为0.84,检测灵敏度为71.5%,特异性为85.8%;检测WBC的ROC曲线下面积为0.92,检测灵敏度为86.4%,特异性为87.0%;对管型的检测效能不佳,ROC曲线下面积为0.59,检测灵敏度为30.9%,特异性为87.6%;检测结晶的ROC曲线下面积为0.79,检测灵敏度为56.0%,特异性为96.7%。
参考范围
尿液有形成分检测结果呈偏态分布,采用中位数(四分位数)表示,结果见表7。经秩和检验后,全自动尿沉渣分析仪检测健康人尿液RBC、WBC、EC、管型及结晶的生物参考区间结果见表8。
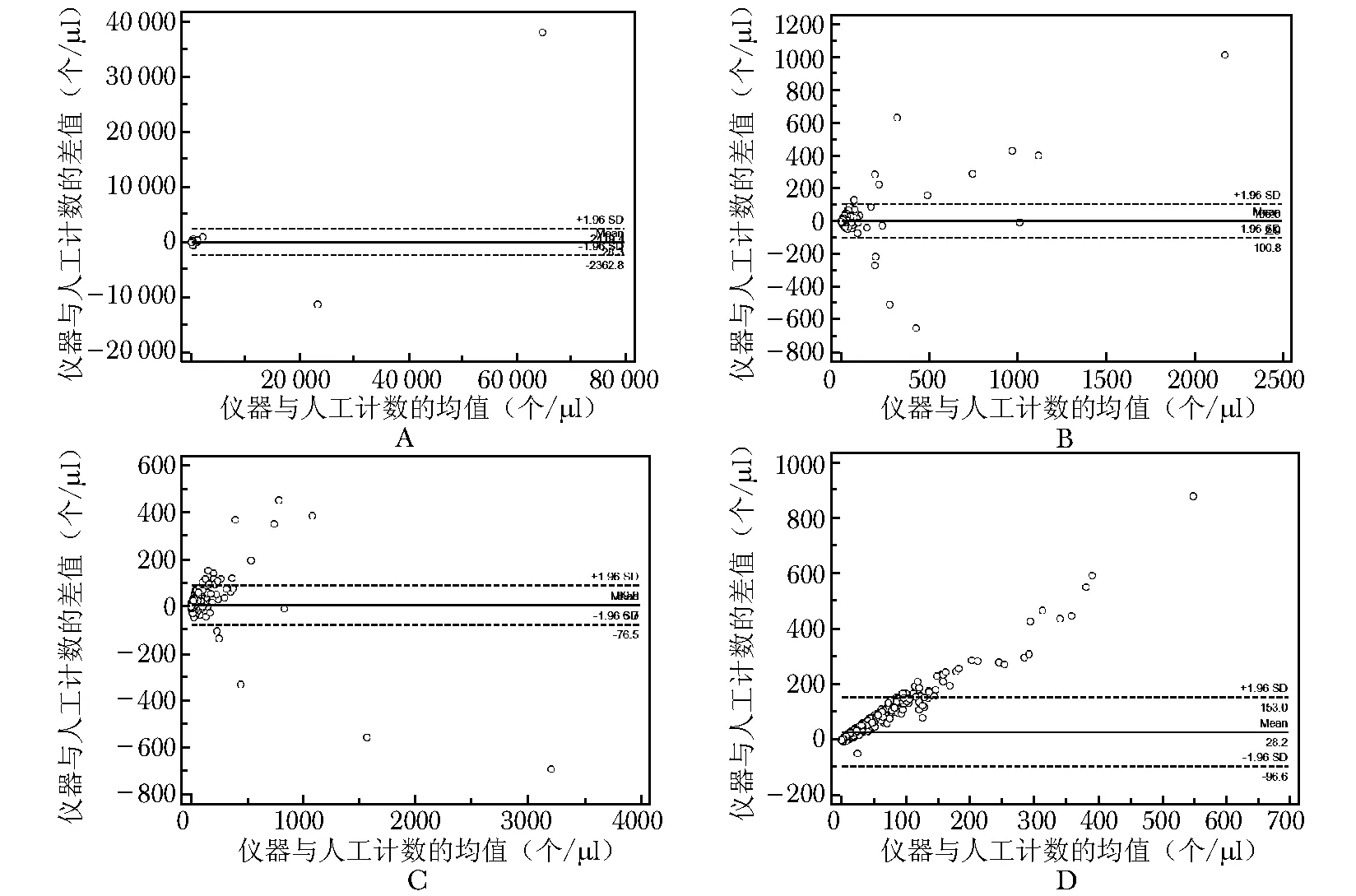
图 2 仪器与人工计数结果的Bland-Altman偏差图 横轴为每个被观察对象评定得到的均值,纵轴为两种评定间的差异值,在纵轴上以差异的均值和理论0值为均值参考线,添加均值±1.96标准差即差异均值的95%置信区间参考线,即95%可接受的一致性界限 A.红细胞;B.去除肉眼血尿后的红细胞;C.白细胞;D.鳞状上皮细胞
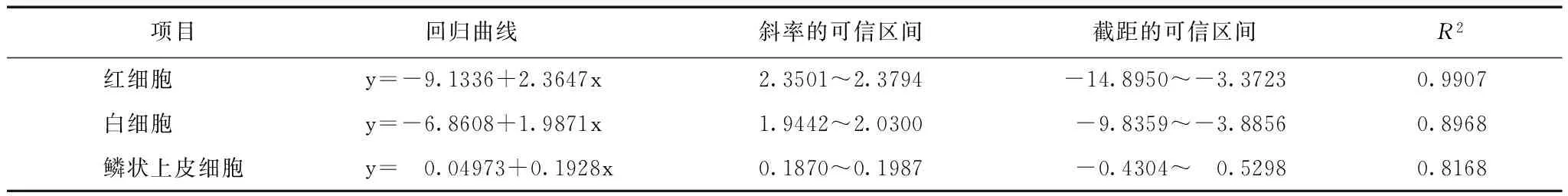
表 6 全自动尿沉渣分析仪与人工法比对结果(Passing-Bablok)

表 7 健康人尿液有形成分检测结果[M(Q1,Q3)]
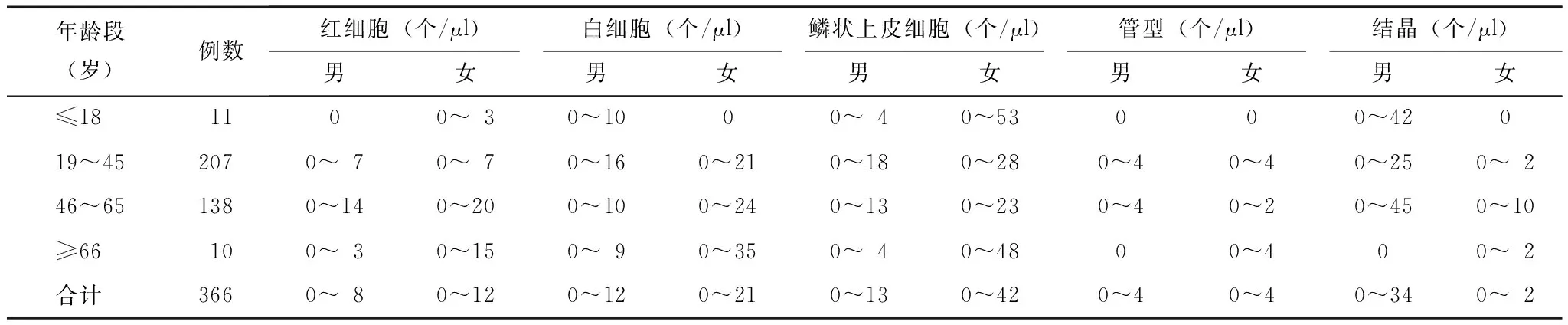
表 8 健康人尿液有形成分参考范围
讨 论
图像识别式尿液有形成分分析系统是在显微镜下拍摄图片,再由计算机进行图像分析,对尿中有形成分的大小、对比度、形状、质地特征进行提取,运用形态识别软件和网络技术进行有形成分的分类和定量报告。其特点是每种成分均可在荧光屏上显示其形态,并可任意选取可疑成分进行人工复核、重新判定。本研究中的这种尿沉渣分析仪是其典型代表,使用此仪器,无须离心标本,每份标本的检测只需1 min,无携带污染,使尿沉渣检测实现自动化,还可满足尿沉渣检测的标准化。但其仍然有一定的不足之处。该仪器检测尿液有形成分时,低值标本检测精密度差,细胞数越多,重复性越好。检测RBC时灵敏度较差(71.5%),可能与聚焦不清,仪器无法识别有关;特异性较好(85.5%)。某些草酸钙结晶大小、形状与RBC相似,会干扰RBC的检测结果,一些类酵母样真菌会被误认为RBC,也会对RBC的检测造成干扰,此类标本就必须人工镜检进行确认。检测WBC时,灵敏度(86.4%)和特异度(87.0%)较好。但当尿液中出现成堆的细菌时,该仪器可能会误认为WBC;当尿液中RBC为满视野时,将原本数量不多的WBC掩盖,会使计数结果偏低。检测管型时,灵敏度很差(30.9%),可能是仪器检测视野个数限制所致,不像人工镜检那样浏览全片;特异性不是太高(87.6%),可能是仪器易将黏液丝或某些上皮细胞等误认为管型所致。检测结晶时,灵敏度较差(56.0%),可能与尿液中结晶的形态多种多样,尤其是无定型结晶,仪器无法识别有关;特异性较好(96.7%)。
泌尿系统感染常见病原菌包括革兰阴性杆菌中的大肠埃希菌、肺炎克雷伯菌、铜绿假单胞菌,革兰阳性球菌中的粪肠球菌、金黄色葡萄球菌以及真菌中的白色念珠菌[4- 5]。本研究通过评价该仪器对几种泌尿系统感染常见细菌或真菌的分析测量范围,首次发现该仪器检测杆菌和酵母样真菌的检测线性良好,而检测球菌时线性不佳。分析原因,可能与球菌呈球形,仪器容易误认为RBC有关。
需要说明的是,本研究涉及到的仪器检测结果均为经人工审核后结果。在进行仪器及人工计数结果一致性评价时,无论是将仪器及人工计数结果(个/μl)分为8个等级,计数不同等级下仪器与人工结果的一致性,还是通过Bland-Altman偏差图观察仪器与人工计数结果之间的差异分布,均可发现仪器与人工计数RBC和WBC的一致性较好,而计数EC的一致性欠佳。总体来说,该仪器各项性能基本能满足临床需求。
在当今许多医院临床标本不断增多的情况下,对每个标本都经严格操作进行人工镜检是很困难的。尿液有形成分图像分析系统虽然有很好的实用价值,但也有局限性,要识别某一目标,数据库中必须具备此目标的模型,否则不能识别。将尿液干化学法与尿液有形成分图像分析技术联合应用,能克服二者各自技术上的缺陷,优势互补,既可提高尿液分析的准确性,又可达到高效率、高通量的目的。因此,制定科学合理的筛选方法就显得尤为重要[6- 7]。并且,尿液形态学检查是复杂的问题,影响因素众多[8]。虽然这种技术的应用能大大减少人力,但目前还不能完全替代人工镜检,当尿液有形成分分析与人工镜检不符时,应以人工显微镜检查为准,以保证结果的准确性。总之,应将尿液有形成分图像分析系统与尿干化学分析联合应用于尿常规过筛检查,建立相应的复检规则,必要时人工镜检以提高检验质量,保证结果的准确性,同时应密切结合临床综合分析,必要时进行动态观察。
[1]熊力凡,李树仁,丁磊,等.临床检验基础[M].3版.北京:人民卫生出版社,2003:62- 65.
[2]Clinical and Laboratory Standards Institute. Precision performance of clinical chemistry devices second edition. EP5-A[S].Wayne,PA:CLSI,1999.
[3]李建英,陈倩,史风梅,等.全自动干化学尿液分析仪及配套试带的临床性能验证[J].中华检验医学杂志,2012,35:1112- 1117.
[4]Dos Santos JC,Weber LP,Perez LR.Evaluation of urinalysis parameters to predict urinary-tract infection[J].Braz J Infect Dis,2007,11:479- 481.
[5]夏少梅,林桢,李婪,等.泌尿系统感染常见病原菌分布与耐药性分析[J].检验医学与临床,2009,19:1603- 1605.
[6]陈雨,程闽,李薇,等.自动化尿液干化学和有形成分分析复检规则的制定和应用[J].中华检验医学杂志,2011,34:501- 506.
[7]任军伟,陈建魁,丛王隆,等.Cobised尿沉渣分析仪与Urisys2400尿液分析仪人工显微镜复查筛选规则的建立[J].现代检验医学杂志,2013,28:39- 47.
[8]顾可梁.尿有形成分的识别与检查方法的选择[J].中华检验医学杂志,2005,28:572- 575.
Clinical Application of A Fully-automatic Urine Sediment Analyzer
DU Juan, XU Jia, GUO Ye, ZHANG Feng, WU Wei, LI Jian-ying, LI Yue, JIN Jing,CHENG Min, CUI Wei
Department of Clinical Laboratory, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100730,China
CUI Wei Tel: 010-69159713,E-mail:cuiw@pumch.cn
Objective To evaluate the clinical application of a fully-automatic urine sediment analyzer and establish the reference range of urinary formed elements. Methods The precision, carryover rate, analytical measurement range, and comparability with manual microscopy method were evaluated, and the reference ranges of red blood cells (RBC), white blood cells (WBC), squamous epithelial cells (EC), and casts by the instrument were analyzed. Results The low, medium, and high values of precision were 129.10%, 20.59%, and 7.80% for RBC,and 65.73%,14.30%,and 13.00% for WBC. The medium and high values of precision for EC were 27.01% and 21.46%. The carryover rate of RBC, WBC, and EC were all 0. The measurement range was 0-83 608/μl for RBC and 0-15 624/μl for WBC. As to the measurement range of bacteria, there were obvious differences according to the different species of bacteria. When compared the instrument results with the manual microscopy, the consistency rates were 82.80% for RBC, 73.82% for WBC, and 57.56% for EC. The reference ranges of urinary formed elements were as follows: the range of urinary RBC was 0-8/μl for males and 0-12/μl for females; the range of urinary WBC was 0-12/μl for males and 0-21/μl for females; the range of urinary EC was 0-13/μl for males and 0-42/μl for females; the range of urinary cast was 0-4/μl for males and 0-4/μl for females; and the range of urinary crystal was 0-34/μl for males and 0-2/μl for females. Conclusions This fully-atomatic urine sediment analyzer has better recognition performance for RBC and WBC. We can carry on the manual recognition using audit function by instruments, and manual morphological examination when necessary, to detect crystals, casts, fungi, and irregular cell components which are difficult to identify automatically.
urinary sediment analyzer; clinical application; reference range
崔 巍 电话:010-69159713,E-mail:cuiw@pumch.cn
R446.12+1
A
1674-9081(2014)03-0290-07
10.3969/j.issn.1674-9081.2014.03.009
2014- 05- 04)

