CardioChek PA床旁血脂检测仪的准确性验证
侯立安,邱 玲,邸 茜,国秀芝,解宏杰,李鹏昌,王 凯,程歆琦,刘 荔
中国医学科学院 北京协和医学院 北京协和医院检验科, 北京 100730
·论 著·
CardioChek PA床旁血脂检测仪的准确性验证
侯立安,邱 玲,邸 茜,国秀芝,解宏杰,李鹏昌,王 凯,程歆琦,刘 荔
中国医学科学院 北京协和医学院 北京协和医院检验科, 北京 100730
目的 验证CardioChek PA床旁血脂检测仪测定全血总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)的准确度及其与全自动生化分析仪结果的可比性。方法 使用同一批号试纸条分别在3台CardioChek PA血脂检测仪上连续检测低、中、高三个浓度水平全血20次,评价TC、TG和HDL-C各项目的批内不精密度和仪器间总不精密度;在同一台仪器上使用三个批号的试纸条检测全血各10次,计算批内不精密度和总不精密度。筛选血脂浓度覆盖高、中、低三个水平的54名志愿者,清晨空腹采集末梢全血,在3台床旁血脂仪上测定血脂;同时采集静脉血,在4种不同的全自动生化分析仪检测血清TC、TG及HDL-C。绘制Bland-Altman图,比较CardioChek PA与各生化分析仪测定结果的离散趋势;将CardioChek PA检测结果与不同生化分析系统及参考方法检测结果进行线性回归;计算CardioChek PA与不同生化分析系统的偏差及百分偏差,同时判定在医学决定水平处偏差是否符合相关要求。结果 3台CardioChek PA仪器低、中、高水平的总不精密度TC分别为:2.69%、4.88%、3.51%,TG分别为5.51%、5.27%、4.96%,HDL-C分别为7.27%、6.84%、6.79%;相同仪器、不同批号试纸间总不精密度TC为4.70%,TG为7.66%,HDL-C为8.61%。CardioChek PA检测系统与4种全自动生化仪分析比对结果显示:TC与各系统的偏差最小,在-2.21%~2.56%之间,HDL-C在-1.12%~5.57%之间,TG除与BeckmanDxC 800偏差较大外(25.85%),与其他3个系统的平均百分偏差在-4.55%~13.34%之间。医学决定水平偏差分析显示:TC在不同医学决定水平处的偏差在-3.27%~1.96%之间,TG在-11.05%~13.06%之间,HDL-C在-5.86%~11.56%之间,均满足美国国家胆固醇教育计划总允许误差标准(15%)。进一步的正确度验证结果显示:与参考方法比对,TC在医学决定水平处偏倚分别为1.96%和0.77%;HDL-C分别为2.34%和4.87%。结论 CardioChek PA床旁血脂检测仪准确度满足临床需求,适用于临床血脂异常筛查及治疗检测。
床旁检验;不精密度;准确度;比对实验
MedJPUMCH,2014,5(3):283-289
材料和方法
仪器与试剂
选用3台美国CardioChek PA POCT血脂检测仪及3个批号的配套检测试纸,选用临床在用的4台大型生化分析仪作为对照,其型号为:Beckman AU 5400、Roche P Modular、Hitachi 7180、BeckmanDxC 800,其中Hitachi 7180使用日本Wako公司试剂,其他均为配套试剂。所有校准品均为试剂制造商提供的配套校准品,且均有溯源性说明。
实验样本
选取高、中、低三个水平的肝素锂抗凝静脉全血用于精密度实验。参考美国临床及实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)EP9-A2文件[6],结合临床按不同血脂浓度分布筛选54名志愿者(表1),所有志愿者均签署知情同意书。采集手指末梢全血直接检测。同时采集9 ml肘静脉全血,室温放置0.5~1.0 h,于3000×g离心10 min。将血清分装到6个冻存管中,其中2管-80 ℃低温冻存,另外4管放置到2~8 ℃保存,12 h内用于4台生化分析仪检测。所有末梢血采集人员及CardioChek PA血脂检测系统使用人员均经过统一培训。
方法
采用厂家提供的校准液,按标准操作规程校准待评价的美国CardioChek PA血脂检测系统。选取高、中、低三个水平的静脉肝素锂抗凝全血,充分混匀后,用移液枪吸取40 μl血液,分别用3台美国CardioChek PA血脂检测系统(SN.3015966/3017711/3016068)采用同一批号的试纸条(Lot.219)连续检测20次,记录结果并分别计算每台仪器的批内不精密度(CVwithin%)和仪器间总不精密度(CVbetween instrument%)。
选取高、中、低三个水平的静脉肝素锂抗凝全血,充分混匀后,用移液枪吸取40 μl血液,使用一台美国CardioChek PA血脂检测系统(SN.3017711)并采用三个不同批号的试纸条(Lot.215/219/221)连续检测10次,记录结果并计算试剂批内不精度(CVwithin%)及批号间总不精密度(CVbetween lot%),并比较不同批号间的平均偏差(diffmean)及百分偏差(diff%mean)。判断以上不精密度是否小于各指标来源于生物变异的允许不精密度或2倍NCEP允许不精密度标准。
按SOP校准CardioChek PA血脂检测系统,三水平质控合格在控后开始检测受试者样本。受试者静脉血采集完成后5 min内完成末梢血的穿刺,用配套的无菌微量吸管吸取样本,每管40 μl,共3管,在10 s内将血均匀滴加到试纸条上,读取并打印CardioChek PA血脂检测结果,求取3次均值。所使用的全自动生化分析仪最近2次能力验证结果合格,室内质控稳定。检测受试者样本前完成Biorad两水平质控,结果在控方可检测受试者标本,每份标本检测2次,求均值。在54份样本中选取8份-80 ℃冻存血清,委托卫生部临床检验中心参考实验室采用参考方法测定TC和HDL-C。CardioChek PA血脂检测系统与生化分析仪及参考测量系统测定结果进行比对。
统计学处理
采用SPSS 19.0及MedCalc 9.6.2.0软件进行数据统计分析。计算美国CardioChek PA血脂检测系统检测结果与各生化系统及参考方法检测结果的偏差、百分偏差,绘制Bland-Altman图[7]以对两种方法的一致性进行评价。并以CardioChek PA血脂检测系统检测结果为y轴,各生化系统检测结果为x轴,进行线性回归,并计算回归方程、相关系数(r)、斜率(a)、截距(b),及相应的95%可信区间,参考EP-A2-IR方案,根据以上回归方程,计算医学决定水平上的平均偏倚,并判定其是否小于各指标来源于生物变异的允许偏倚或2倍NCEP允许偏差。
结 果
不同仪器间的总不精密度
3台CardioChek PA血脂检测系统使用相同批号(Lot.219)试纸,各台设备不同水平的批内不精密度及仪器间总不精密度见表2,其中 TC在2.71%~5.10%之间,均小于6%(2倍NCEP允许不精密度),TG在2.95%~6.99%之间,均小于10%(2倍NCEP允许不精密度),HDL-C在5.72%~7.89%之间,均小于10.5%(来源于生物变异的允许不精密度),精密度水平良好,能够满足临床检测对血脂精密度的要求。

表 1 受试者血脂分布情况
TC: 总胆固醇;TG:甘油三酯;HDL-C:高密度脂蛋白胆固醇
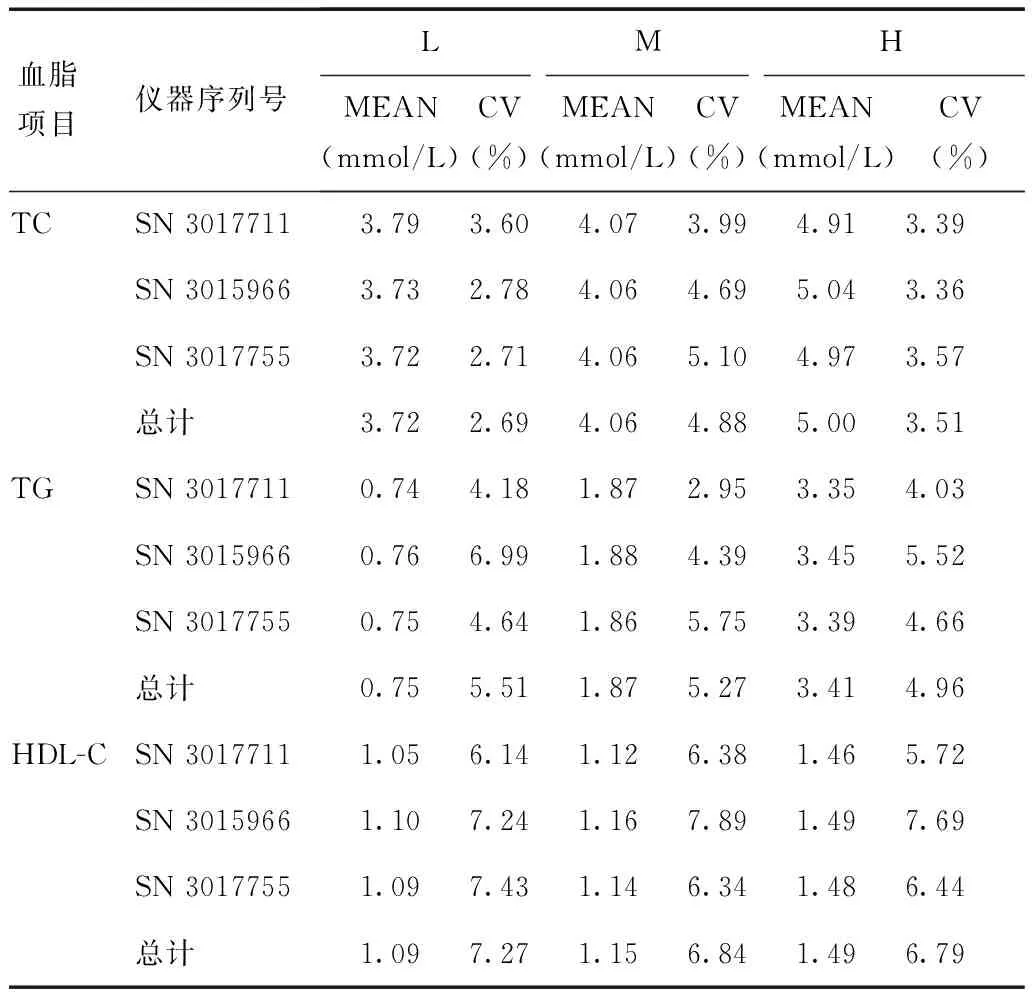
表 2 3台CardioChek PA的批内不精密度及不同仪器间总不精密度
TC、TG、HDL-C:同表1;L:血脂低水平;M:血脂中间水平;H:血脂高水平;MEAN:平均值;CV:不精密度
不同批号试纸批内不精密度和批间总不精密度
在同一台CardioChek PA设备(SN.3017711)上使用3个批号(Lot.215/219/221)试纸检测结果显示,不同批号试纸精密度存在一定的差异(表3),如Lot.215批号试剂,其TC批内不精密度在三个批号中最差,TG在三个批号中最好,仅3.95%,但各批号试剂的批内不精密度及批号间总不精密度均小于各自精密度控制目标。不同批号间的平均百分偏差均小于来源于生物变异的总允许误差。故不同批号间的变异对临床影响可接受。
CardioChek PA检测系统与4种常规生化检测系统比对回归曲线、Bland-Altman图结果显示,TC相关系数在0.918~0.934之间,TG在0.975~0.981之间,HDL-C在0.933~0.961之间,均具有统计学意义。其中TG相关系数均大于等于0.975,曲线相关性良好,TC、HDL-C相关系数大于0.90,具有较好的相关性(图1~3)。
CardioChek PA检测系统与4种常规生化检测系统的平均百分偏倚在不同系统上表现不尽一致。其中TC与各系统的偏差最小,在-2.21%~2.56%之间,此结果满足NCEP总允许误差标准(9%),HDL-C在-1.12%~5.57%之间,满足NCEP总允许误差标准(13%),TG除与BeckmanDxC 800偏差较大外(25.85%),与其他3个系统的平均百分偏差在-4.55%~13.34%之间,满足NCEP总允许误差标准(15%)。
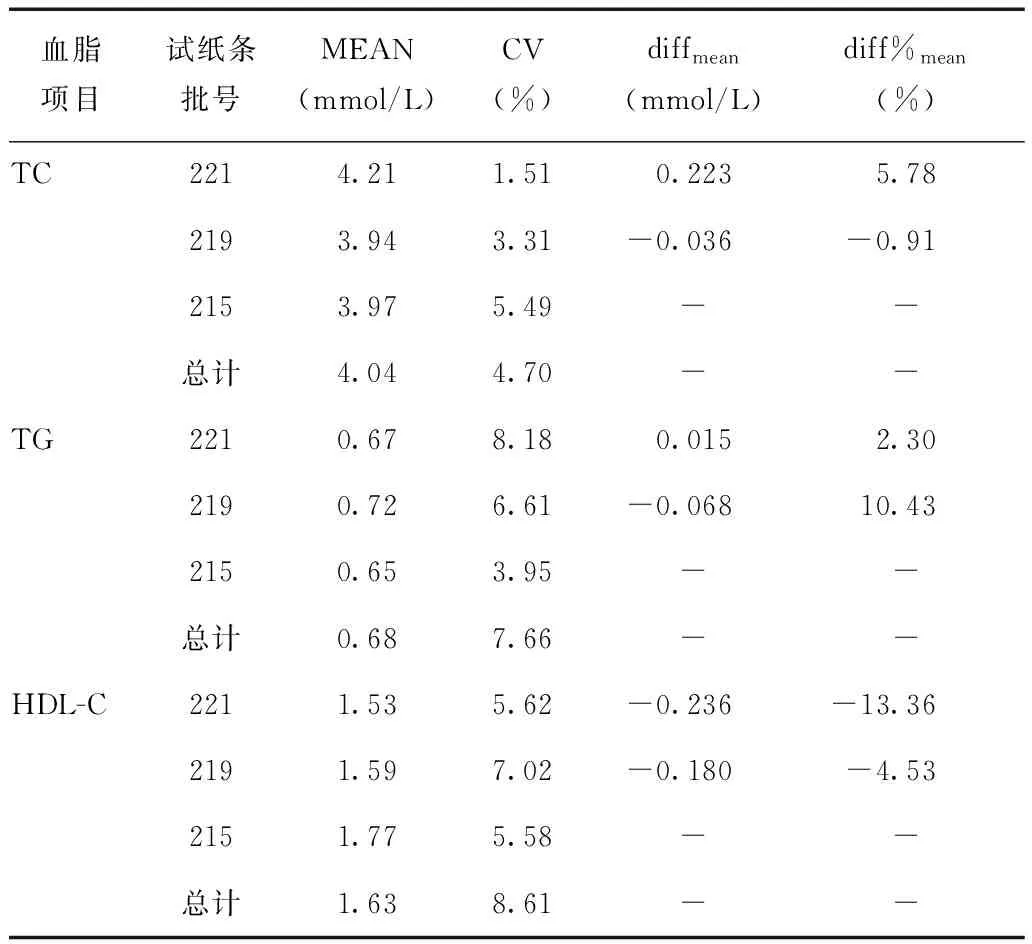
表 3 不同批号试纸条批内不精密度和批间总不精密度
TC、TG、HDL-C:同表1;MEAN、CV:同表2;diffmean:平均偏差;diff%mean:平均百分偏差
TC与4种分析系统相比,在两个医学决定水平处的偏差在-3.19%~1.96%之间,均远低于NCEP和来源于生物变异的总允许误差(8.5%和9%),表现了与生化分析仪非常接近的性能。TG与4个系统相比,在三个医学决定水平的偏差普遍较大,在-11.05%~13.06%之间,但仍满足NCEP总允许误差标准(15%);值得注意的是,与不同系统比对的结果不尽一致,在Beckman AU检测系统及Hitachi检测系统中高值偏差较大,而在Roche检测系统及BeckmanDxC检测系统中则低值偏差较大,故在实际应用中应充分考虑所在医疗机构所使用的检测系统。HDL-C与4个系统相比,在两个医学决定水平的偏差普遍较大,在-5.86%~11.56%之间(表4),满足NCEP总允许误差标准(13%),且在与BeckmanDxC系统比对中高值偏差较大,其他偏差水平接近生化分析仪。
正确度验证结果
TC与参考方法比对,其平均百分偏倚为1.68%,医学决定水平处偏倚分别为1.96%和0.77%,均小于NCEP允许偏差(3%),结果准确可靠。HDL-C与参考方法比对,其平均百分偏倚为3.69%,医学决定水平处偏倚分别为2.23%和4.87%(表4),其中低水平低于NCEP允许偏差(4%),高水平小于来源于生物变异的允许偏倚(10.7%),结果准确可靠。
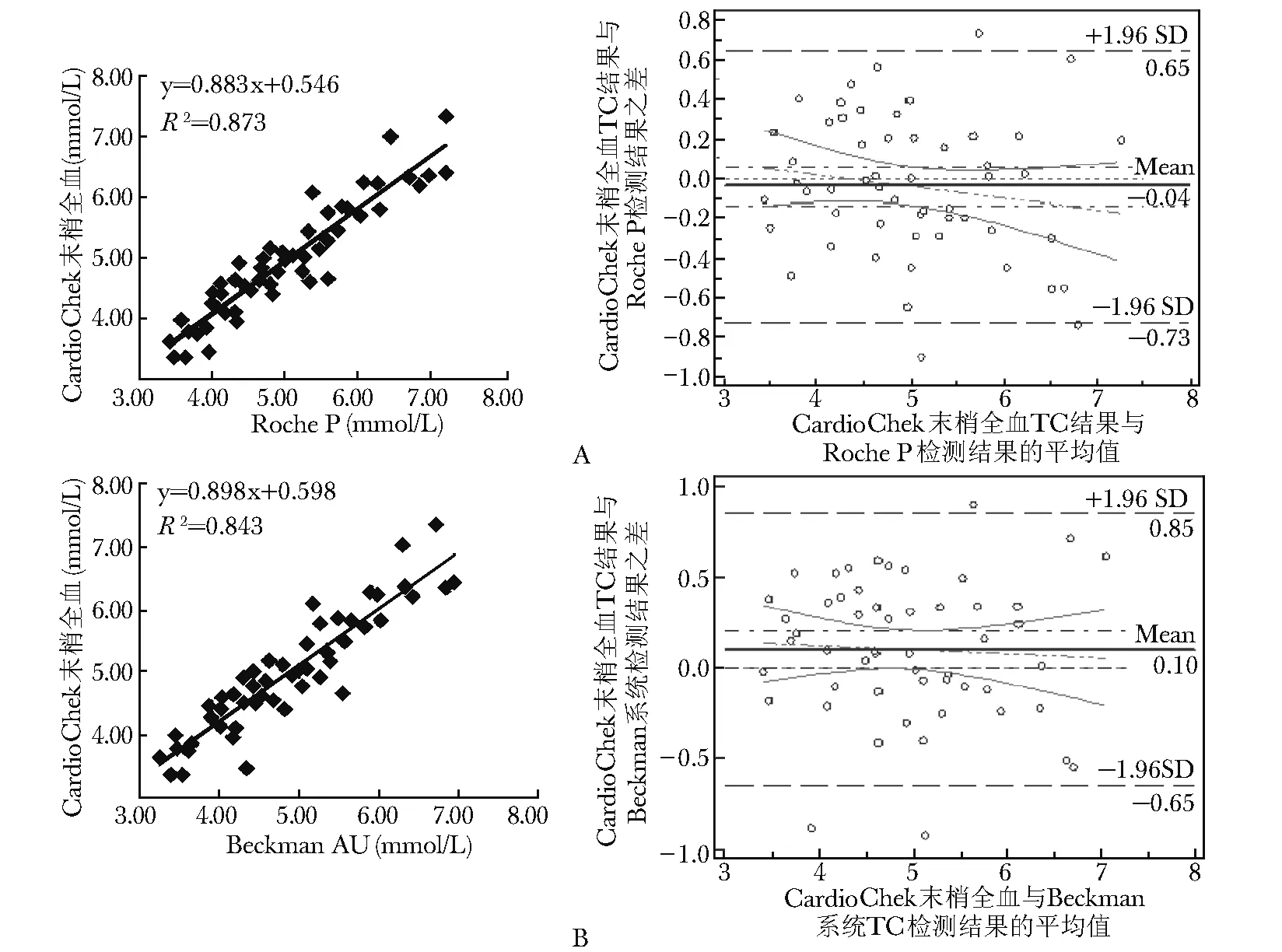
图 1 TC CardioChek PA检测系统与常规生化检测系统比对 A.CardioChek血脂仪末梢全血TC检测结果与Roche P TC检测结果的相关性;B.CardioChek血脂仪末梢全血TC检测结果与BeckmanAU TC检测结果的相关性
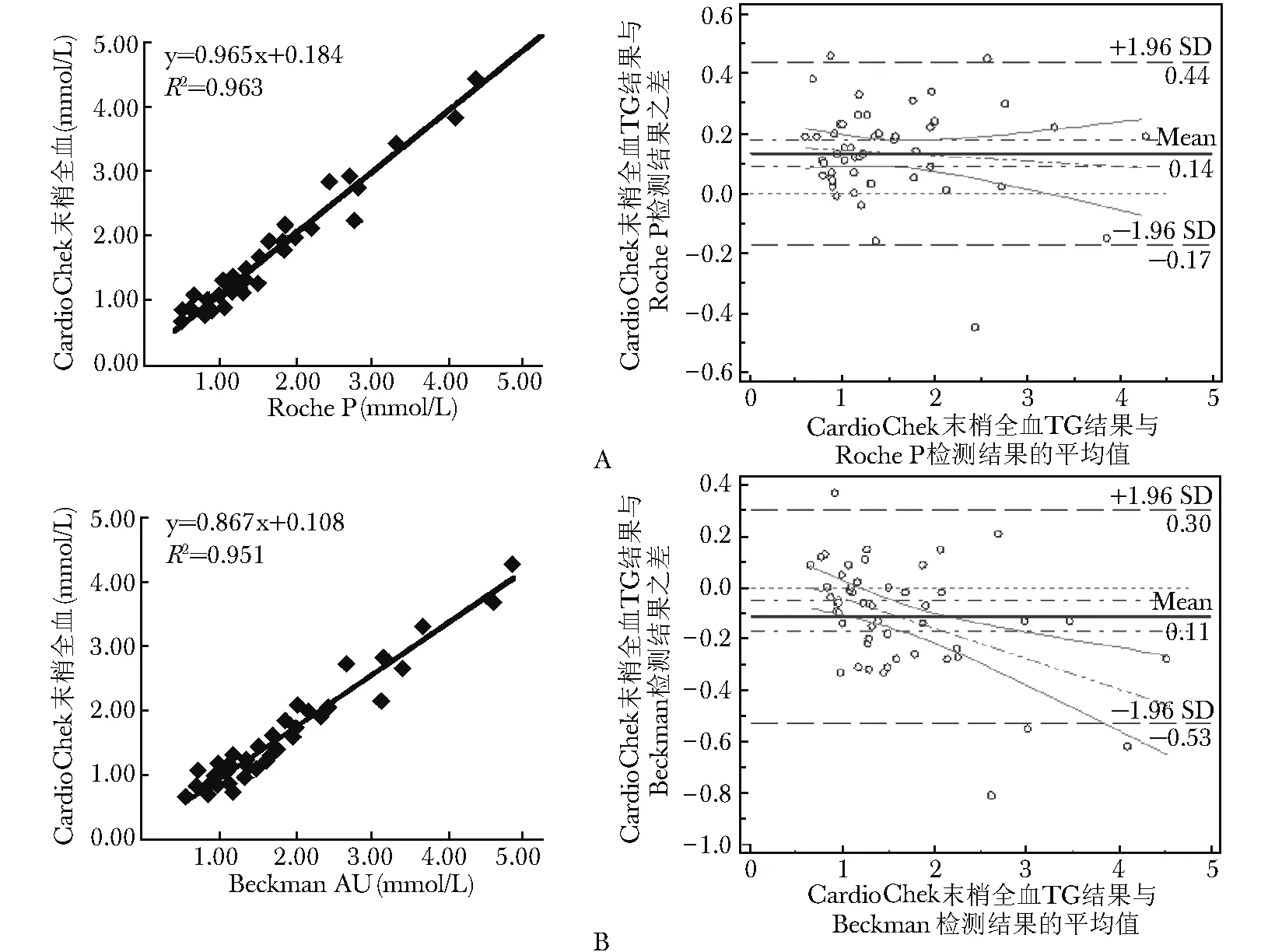
图 2 TG CardioChek PA检测系统与常规生化检测系统比对 A.CardioChek血脂仪末梢全血TG检测结果与Roche P TG检测结果的相关性;B.CardioChek血脂仪末梢全血TG检测结果与BeckmanAU TG检测结果的相关性
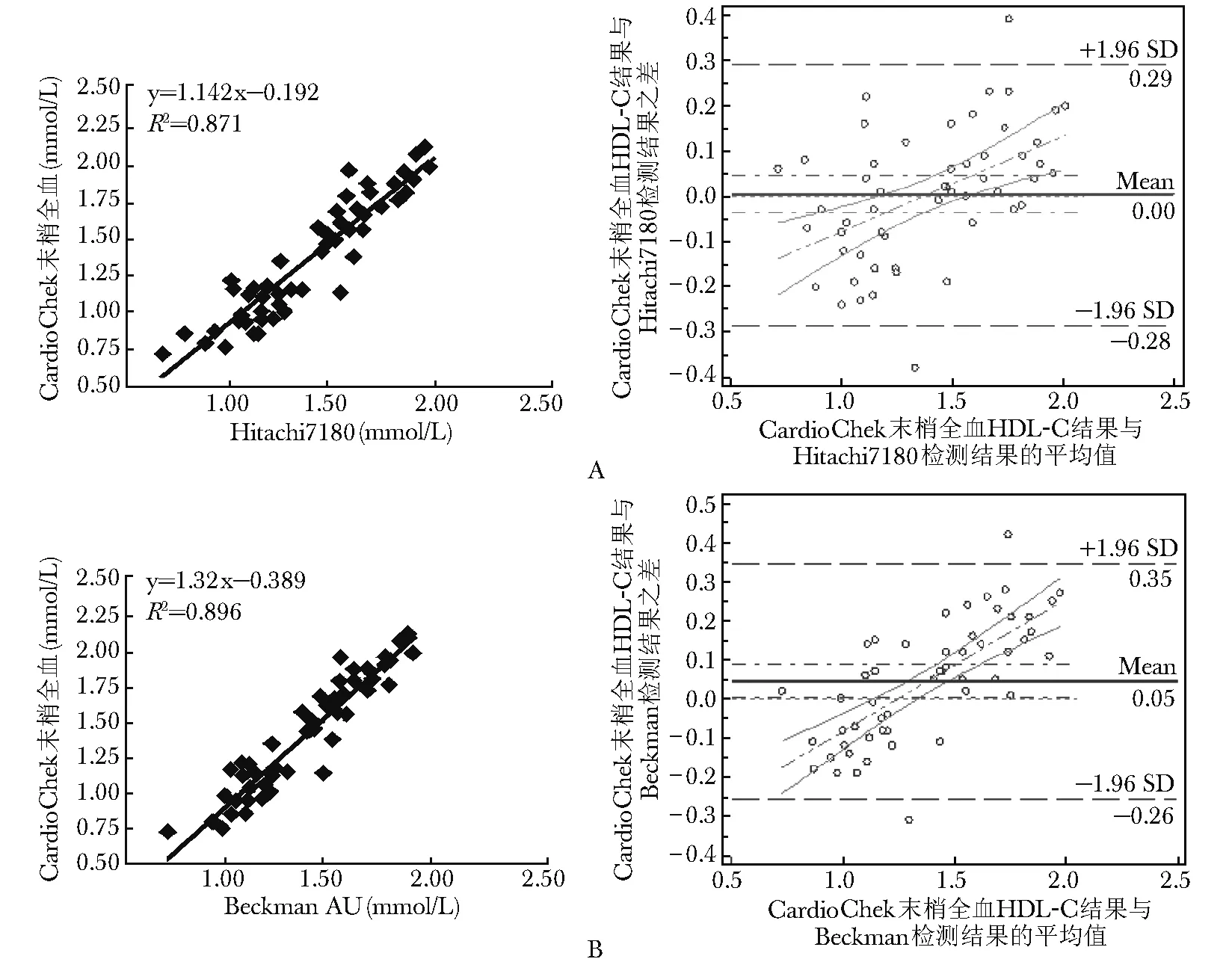
图 3 HDL-C CardioChek PA检测系统与常规生化检测系统比对 A.CardioChek血脂仪末梢全血HDL-C检测结果与Hitachi 7180 HDL-C检测结果的相关性; B.CardioChek血脂仪末梢全血HDL-C检测结果与BeckmanAU HDL-C检测结果的相关性
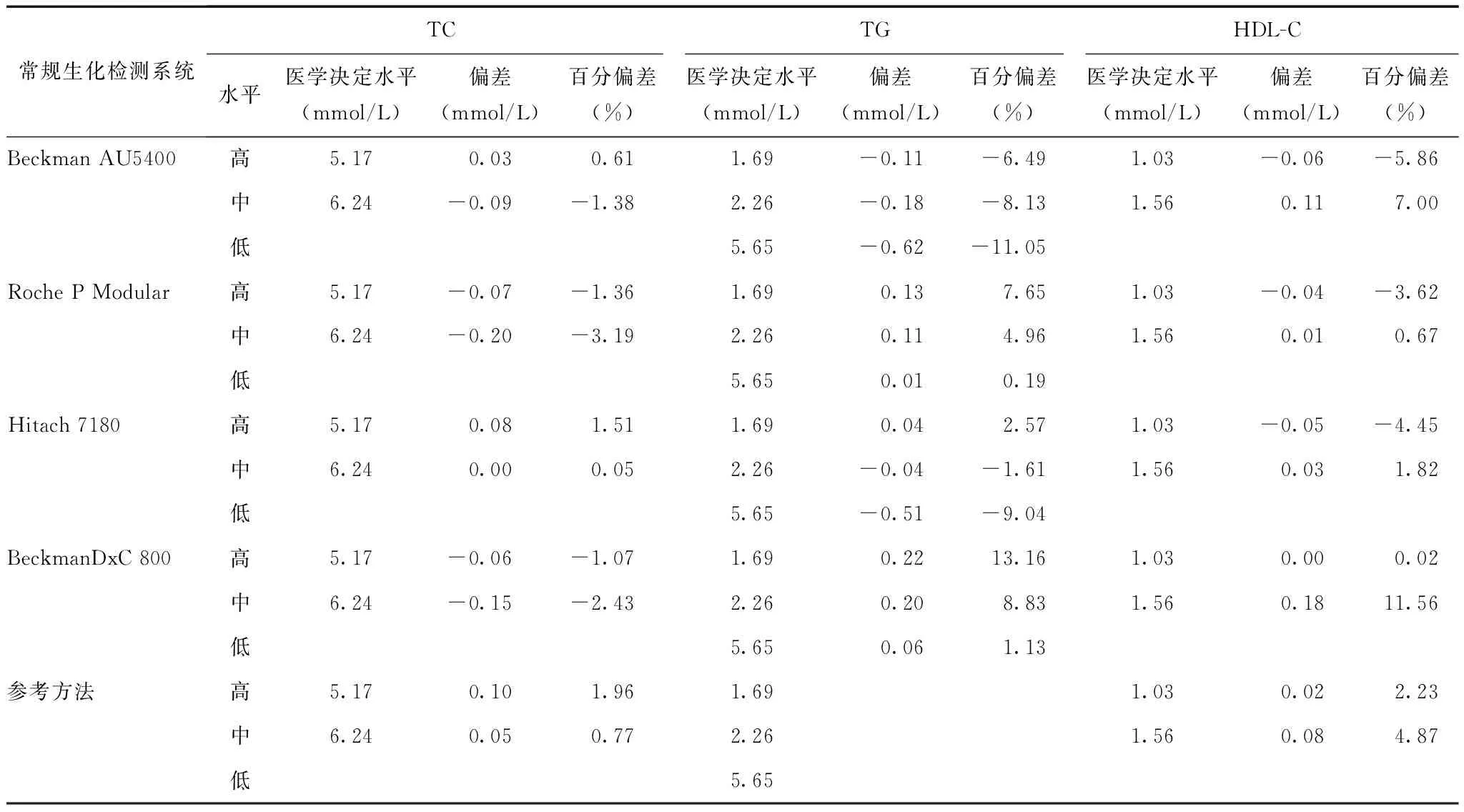
表 4 CardioChek PA检测系统与4种常规生化检测系统医学决定水平偏差判定
TC、TG、HDL-C:同表1
讨 论
POCT设备以其快捷、方便的特点被临床逐渐接受,但是由于方法学的限制,其在精密度、正确度、检测范围等方面较全自动生化检测系统略差[8]。美国NCEP对于血脂的性能指标有明确的规定,但其主要针对自动生化分析仪,目前国内、外均缺乏POCT血脂检测设备的精密度和偏差评价标准。本研究在确定评价标准时部分参考了POCT血糖评价的原则,同时结合POCT血脂检测仪的临床适用范围,用来源于生物变异的允许不精密度、允许偏倚或2倍NCEP允许不精密度和允许偏倚来判定实验结果。
评价自动生化分析仪精密度时通常选择评价重复性精密度及中间精密度,本研究在设计实验方案时,考虑到POCT设备的特点,及结果的稳定性更多受到多台不同设备或不同批号试纸条的影响,故设计用仪器间总不精密度及试剂批号间总不精密度来评价中间精密度。实验发现由不同台设备带来的不确定度非常小,但是不同批号试纸则引入了较大的变异,这可能与试纸的生产、保存、运输以及使用等多种因素有关。实验还发现试纸条筒盖打开时间过长可能带来结果的不稳定。本研究在评价POCT血脂检测系统与全自动生化分析仪检测结果的可比性时选取了4个主流生化检测系统,主要是考虑不同生化分析系统由于方法学的不同可能本身存在差异,选取多个不同的检测系统可以为使用不同型号生化分析仪的医疗机构提供参考。同时本研究中采用与参考测量系统比对的方式,也进一步验证了POCT血脂检测系统的正确度。
本研究主要关注了对检测系统的评价,但是POCT设备较自动生化分析仪更容易受到采样者、操作者的影响[9]。无论是指尖穿刺、采样还是检测都可能带来较分析系统本身更大的不确定度。由于不同操作者带来的结果变异有待进一步评价。
本研究验证了CardioChek POCT血脂检测系统具有较好的精密度、准确度,符合基本临床需求,与大部分主流生化检测设备结果具有临床等效性,适用于临床高血脂患者筛查及门诊患者的治疗检测,但不宜作为高脂血症的诊断及治疗方案确认的依据,当发现结果与临床不符或与既往结果相差较大时,应及时采集静脉血采用全自动生化分析仪检测进行确认。此外,也建议国家出台POCT血脂仪的使用规范,明确日常质控及定期比对的要求[10],以保证POCT血脂检测设备的日常性能,提高POCT血脂检测结果的准确度,使其在患者血脂监测与治疗中发挥更加积极的作用。
[1]陆再英, 钟南山. 内科学[M].7版.北京:人民卫生出版社,2010:267- 272.
[2]陈文祥,王抒. 血脂测定标准化及有关问题[J]. 浙江实验医学,2006,4:31- 33.
[3]中国成人血脂异常防治指南制订联合委员会.中国成人血脂异常防治指南(2007版)[J].中华心血管病杂志,2007,5:4.
[4]李智.POCT技术在临床应用的现状与问题[J].中华检验医学杂志,2012,35:1062- 1065.
[5]Stein JH, Carlsson CM, Papacke-Benson K, et al. Inaccuracy of lipid measurements with the portable Cholestech LDX analyzer in patients with hypercholesterolemia[J]. Clin Chem, 2002,48:284- 290.
[6]Clinical and Laboratory Standards Institute. Method comparison and bias estimation using patient samples. EP9-A2[S].Wayne, PA: CLSI,2002.
[7]夏寿扬. 改良Bland-Altman图评价血糖仪结果准确性[J].检验医学与临床,2009,6:1738- 1739.
[8]丛玉隆. POCT的临床应用与存在的问题[J]. 中华检验医学杂志, 2007, 30: 1325- 1328.
[9]陶志华.加强医院内部管理 保证POCT检验质量[J].中华检验医学杂志,2012,35:1077- 1080.
[10]华美媛.浅谈血糖POCT的质量管理[J].医学信息学,2013,26: 6.
Performance Verification of CardioChek PA Lipid Point-of-care Devices
HOU Li-an, QIU Ling, DI Qian, GUO Xiu-zhi, XIE Hong-jie, LI Peng-chang, WANG Kai,CHENG Xin-qi, LIU Li
Department of Clinical Laboratory,Peking Union Medical College Hospital,Chinese Academy of Medical Sciences &Peking Union Medical College, Beijing 100730,China
QIU Ling Tel: 010-69159717, E-mail:lingqiubj@aliyun.com
Objective To validate the accuracy of CardioChek PA lipid point-of-care devices in determining total cholesterol (TC), triglyceride (TG), and high-density lipoprotein cholesterol (HDL-C) in whole blood and the comparability with results determined by full-automatic biochemical analyzer. Methods We determined the low, medium, and high levels of TG, TC, and HDL-C in whole blood with single reagent lot number 20 times using 3 different CardioChek PA devices to evaluate inter-run and devices’ coefficient of variations(CVs), and used single CardioChek PA device with 3 reagent lot number to determine the whole blood 10 times for evaluating inter-run and total CVs. Fifty-four volunteers whose lipid profiles covered up high, medium, and low levels were recruited. Lipids in fasting periphery whole blood and venous serum were collected and determined using 3 different CardioChek PA devices and 4 kinds of full-automatic biochemical analyzers, respectively. Bland-Altman plot was made to analyze the comparability of results from CardioChek PA and the full-automatic biochemical analyzers. Linear regression was analyzed using results of CardioChek PA and full-automatic biochemical analyzers. Bias and percentage bias were determined between CardioChek PA and different automatic biochemical analyzers; meanwhile, whether they satisfied the requirements of medical decision levels was determined. Results The total CVs of TC in low, medium, and high levels in 3 different devices were 2.69%, 4.88%, and 3.51%, respectively; for TG, they were 5.51%, 5.27% and 4.96%; and for HDL-C, they were 7.27%,6.84% and 6.79%. The total CVs of TC, TG, and HDL-C determined with the same device but different reagent lot number were 4.70%, 7.66%, and 8.61%, respectively. Comparison of the results from CardioChek PA devices and the 4 kinds of full-automatic biochemical analyzers showed lowest deviation for TC with -2.21%-2.56%, and for HDL-C with -1.12%-5.57%; the deviation of TG results of BeckmanDxC800 was relatively high with 25.85%, but in other 3 systems were -4.55%-13.34%. Deviation of TC, TG, and HDL-C in different medical decision levels were -3.27%-1.96%, -11.05%-13.06%, and -5.86%-11.56%, respectively, all of which could satisfy the requirements of the National Cholesterol Education Program(NCEP). Compared with reference methods, the biases of TC in medical decision levels were 1.96% and 0.77%; for HDL-C, they were 2.34% and 4.87%. Conclusion The accuracy of CardioChek PA lipid point-of-care device can satisfy the clinical requirements, and the device can be used in the screening and monitoring of dyslipidemia.
point-of-care testing; imprecision; accuracy; comparison test
邱 玲 电话:010-69159717,E-mail:lingqiubj@aliyun.com
R446
A
1674-9081(2014)03-0283-07
10.3969/j.issn.1674-9081.2014.03.008
2014- 05- 04)

