Bcl- 2和血管内皮生长因子受体3在子宫静脉内平滑肌瘤病与普通型平滑肌瘤中的表达差异
王文泽,马国涛,肖 雨,梁智勇,楼伟珍,李 霁,赵大春,吴焕文,刘彤华
中国医学科学院 北京协和医学院 北京协和医院 1病理科 2心外科 3 妇产科, 北京 100730
·论 著·
Bcl- 2和血管内皮生长因子受体3在子宫静脉内平滑肌瘤病与普通型平滑肌瘤中的表达差异
王文泽1,马国涛2,肖 雨1,梁智勇1,楼伟珍3,李 霁1,赵大春1,吴焕文1,刘彤华1
中国医学科学院 北京协和医学院 北京协和医院1病理科2心外科3妇产科, 北京 100730
目的 探索bcl- 2和血管内皮生长因子受体3(vascular endothelial growth factor receptor- 3,VEGFR- 3)在子宫静脉内平滑肌瘤病(intravenous leiomyomatosis,IVL)及普通型平滑肌瘤(leiomyoma,LM)中表达的区别。方法 回顾性分析20例IVL,并匹配10例LM作为对照,挑选存档组织块进行bcl- 2和VEGFR- 3免疫组织化学染色,分析肿瘤细胞的表达情况并与LM进行对比分析。结果 20例IVL病例bcl- 2免疫组织化学染色全部呈中-强着色,阳性率100%;VEGFR- 3免疫组织化学染色19例呈中-强着色,1例阴性,阳性率95%。10例LM的bcl- 2免疫组织化学染色均呈弱-中等着色,阳性率100%;而VEGFR- 3免疫组织化学染色则均为阴性,阳性率为0。结论 Bcl- 2和VEGFR- 3在IVL中均呈高表达,尤其VEGFR- 3表达与LM有明显差异,提示IVL具有与LM不同的分子改变,而这些分子改变可能在IVL的发生、发展中起重要作用。
子宫静脉内平滑肌瘤病;bcl- 2;血管内皮生长因子受体3;免疫组织化学染色
MedJPUMCH,2014,5(3):297-301
子宫平滑肌瘤(普通型平滑肌瘤,leiomyoma,LM)是最常见的肿瘤,虽然绝大多数生物学行为良性,但其发生率非常高,在普通人群中可高达70%,影响范围非常广泛[1]。静脉内平滑肌瘤病(intravenous leiomyomatosis,IVL)属于平滑肌瘤的一个罕见亚型,多影响年轻育龄女性。IVL具有特殊的生长方式,呈侵袭性在静脉系统内生长,可突入子宫或盆腔的静脉内,经髂静脉或卵巢静脉延伸、扩展至下腔静脉,约10%累及心脏,造成严重的循环障碍,甚至出现晕厥或猝死。由于其危险程度常被低估,手术探查范围常相对较小,术后容易复发[2]。以往认为IVL发病率很低,但随着医学技术的进步和对其认识的普遍提高,其确诊病例数近年来迅速升高,相关报道也越来越多。本院数据及近期相关报道均提示IVL约占同期LM手术标本的1%,并有继续升高的趋势。不少学者认为由于之前认识不充分,存在较多漏诊,其发病率被严重低估,实际发生率要远高于报道数据。
目前IVL的相关文献大多是关于临床病理情况的描述性报道和总结,缺乏对其内在分子改变的研究,仅有少数进行免疫表型研究的报道,证实IVL肿瘤细胞均表达雌孕激素受体和平滑肌细胞标志物,不表达CD10和HMB- 45,并且增殖指数和核分裂数也未发现升高,与LM无明显差异[2- 4]。查阅LM的相关研究,其发病机制目前仍不明确,可能涉及雌孕激素、生长因子、细胞因子以及细胞外基质成分等多种因素[1,5],其中雌激素相关的凋亡蛋白bcl- 2受到较多关注,被证实在LM中普遍表达升高,且通过调低bcl- 2的表达水平可以抑制LM细胞的增殖[6- 7]。IVL同样多发生于育龄女性、表达雌激素受体、部分病例激素干预治疗有效,提示可能有相似的抑制肿瘤细胞凋亡的分子改变起作用。
另外IVL具有独特的、蜿蜒状在血管内穿行的生长方式,肿瘤表面被覆一层完整的血管内皮细胞,肿瘤内部微血管密度也较LM和子宫平滑肌组织明显升高,甚至有IVL完全占据下腔静脉,但由于其内部血管的新生、再通及扩张,并未见明显影响血液回流的报道。这种特殊的生长方式提示IVL具有较强的诱导血管内皮细胞增殖和形成新生血管的能力,提示可能存在血管内皮生长因子(vascular endothelial growth factor,VEGF)相关蛋白的高表达。而新近研究提示VEGF家族中的VEGF 受体3(VEGF receptor- 3,VEGFR- 3)在多种肿瘤的血管生成和血管浸润方面起着重要作用[8- 12]。
检索国内外文献,目前尚未见bcl- 2和VEGFR- 3在IVL中表达的研究报道,故本研究对此进行探索,以进一步了解IVL内在的分子遗传学改变,为揭示其发生发展机制、探索分子治疗靶点和寻找预后评估因素奠定基础。
资料和方法
资料
回顾性总结2010—2013年北京协和医院病理科诊断的20例子宫IVL病例,并选择相应年龄的10例子宫LM作为对照。全部病例均经3位病理科医师共同确定诊断。20例IVL患者年龄35~56岁,平均44.6岁。10例LM患者年龄32~55岁,平均43.5岁。
方法
标本制备:手术标本均及时切开,经4%中性甲醛固定、石蜡包埋后行4 μm厚切片,HE染色后进行形态学观察。
免疫组织化学染色: 挑选合适蜡块切4 μm厚白片,进行脱水、抗原微波热修复及蛋白封闭等预处理后,分别与相应小鼠抗人一抗(北京中杉金桥生物有限公司)孵育(bcl- 2 按照1∶200稀释,孵育2 h;VEGFR- 3按照1∶100稀释,孵育过夜),然后与兔抗小鼠二抗(北京中杉金桥生物有限公司)孵育30 min,最后进行DAB(Sigma公司)显色。
判读方法:肿瘤细胞的细胞浆和细胞膜出现可识别的着色判读为阳性,依着色程度可分为强、中、弱三组,肿瘤细胞无着色判读为阴性。
结 果
IVL临床特点
20例IVL患者多集中在生育年龄,临床症状主要包括腹痛、腹胀、月经异常,累及盆腔、下腔静脉及更远范围者可有下肢肿胀、心悸、胸闷等症状。累及子宫以外的患者均可在子宫内发现相应病变或有相关手术史。
IVL病理形态特点
20例IVL病例均可发现在脉管内呈条索状延伸的部分(横切面呈结节状)(图1A),切面多呈灰粉色,实性为主,实性区质地相对均一,质地稍韧,部分区域呈网状或多囊状结构,囊腔内壁多光滑。组织形态上肿瘤主要由相对一致的梭形细胞构成,细胞浆红染,细胞核从椭圆形到长梭形不等,染色质均匀细腻,核仁不明显,核分裂少见(<1个/10高倍视野)。全部病例内均可见由微小血管聚集构成的海绵状区域(图1B),面积大小不等,位于肿瘤中心或周边,其中的血管内皮细胞增生较明显。部分病例肿瘤富于细胞(图1G),部分肿瘤低倍镜下呈乳头状生长(图1C)。肿瘤内常可见玻璃样变、黏液样变及出血等退变区域,部分可见血栓形成,3例局部可见明确的脂肪组织(呈平滑肌脂肪瘤样改变)(图1D-H)(表1)。
IVL和LM免疫组织化学染色结果
全部20例IVL的bcl- 2免疫组织化学染色均呈弥漫性中-强程度的胞浆及胞核着色,而10例LM呈弱-中等程度的细胞浆及细胞核着色,阳性率均为100%。20例IVL中有19例的VEGFR- 3免疫组织化学染色呈中-强程度的胞浆和胞核着色,阳性率为95%,另外1例重复3次结果仍阴性;10例LM的VEGFR- 3免疫组织化学染色则均呈阴性,阳性率为0(图2)。
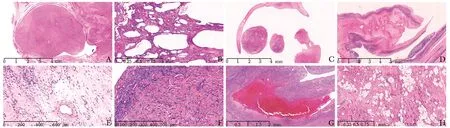
图 1 静脉内平滑肌瘤病的不同组织学图像 A.低倍显示肿瘤破坏局部静脉壁,进入静脉内呈结节状生长;B.中倍显示肿瘤内部由众多血管腔构成的“海绵状”区域;C.低倍显示呈乳头状生长的区域;D.低倍显示肿瘤中央部出血伴明显退变,仅周边部残留形态尚可的薄层肿瘤细胞;E.中倍显示肿瘤明显黏液变性;F.中倍显示肿瘤中央部明显玻璃样变;G.低倍显示富于细胞型静脉内平滑肌瘤病,其内可见血栓形成;H.中倍显示肿瘤局部呈平滑肌脂肪瘤形态
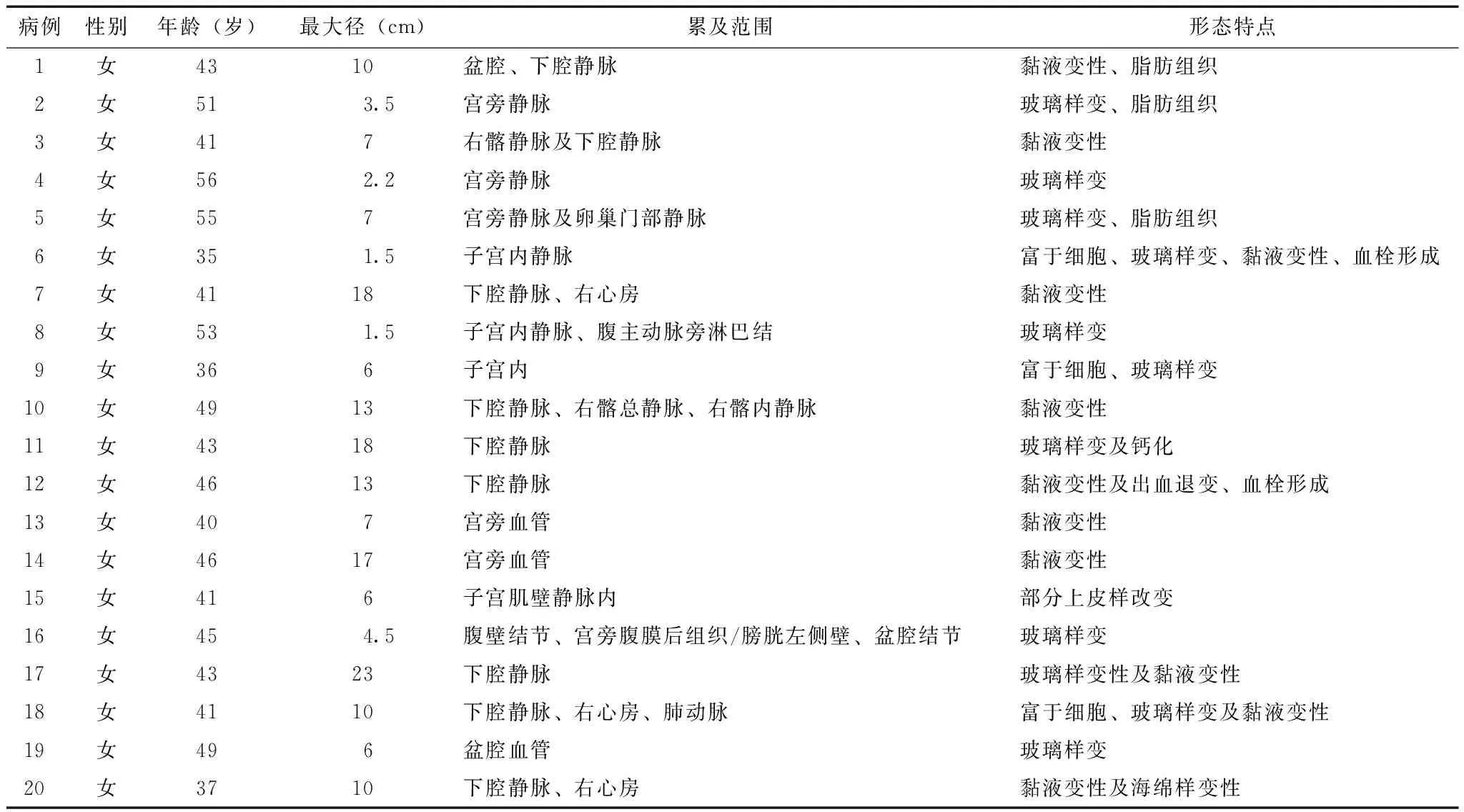
表 1 20例静脉内平滑肌瘤病患者的临床病理特征
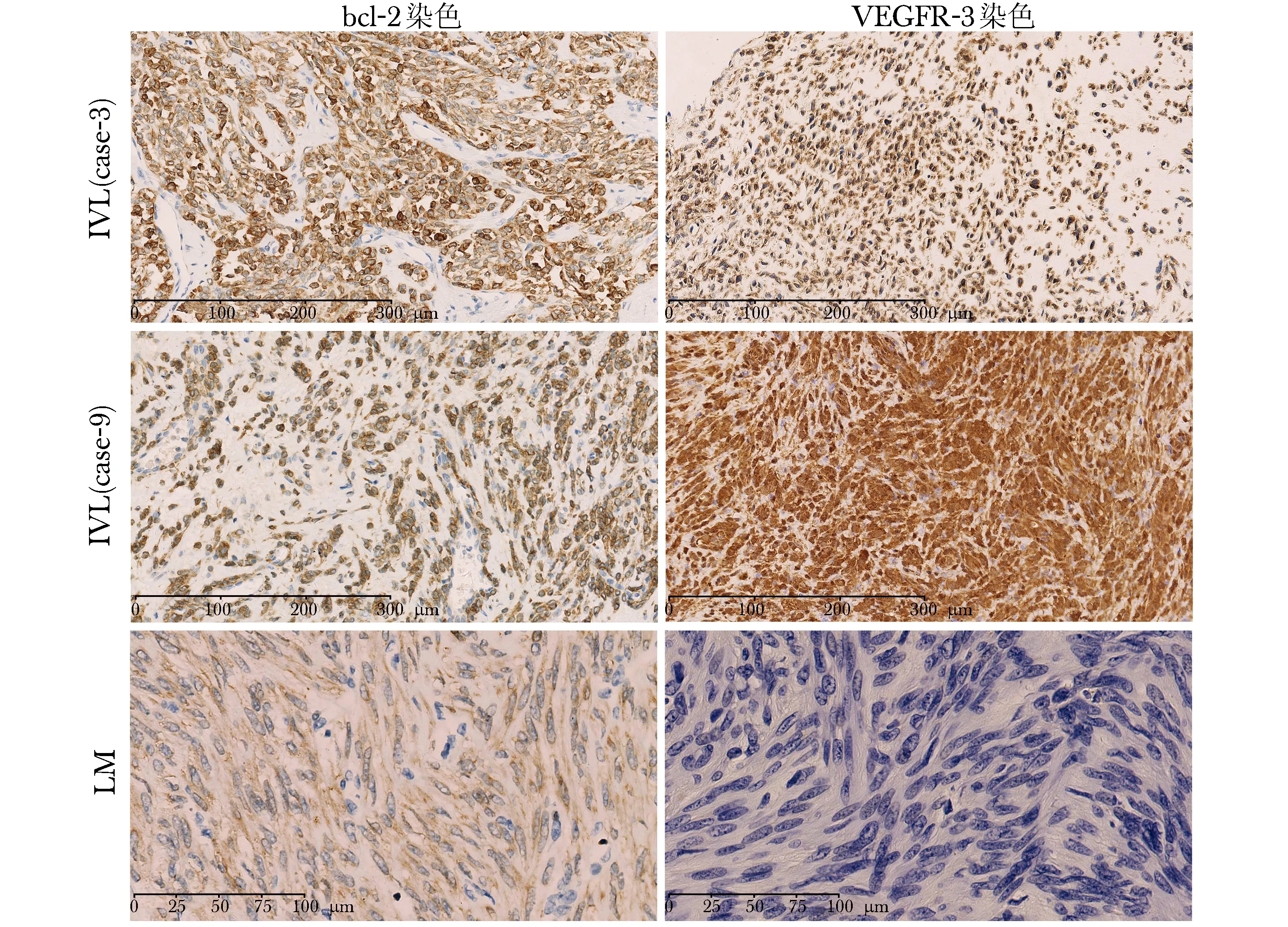
图 2 Bcl- 2和VEGFR- 3免疫组织化学染色结果 第一行为IVL病例3,显示强bcl- 2染色和中等VEGFR- 3染色;第二行为IVL病例9,显示中等bcl- 2染色和强VEGFR- 3染色;第三行为LM病例,显示弱bcl- 2染色和阴性VEGFR- 3染色 VEGFR- 3:血管内皮生长因子受体3;IVL:静脉内平滑肌瘤病;LM:平滑肌瘤
讨 论
近来对软组织肿瘤内在分子机制的研究取得了较明显的进展,发现了多种软组织肿瘤的特征性分子遗传学改变,并在同一组织来源的、形态学上表现为从良性、低度恶性到高度恶性连续进展的不同软组织肿瘤中,发现具有渐进式的遗传学改变谱系。如在脂肪源性肿瘤中,良性肿瘤通常具有单一简单的分子遗传学改变,低度恶性肿瘤具有少量较复杂的分子遗传学改变,而高度恶性肿瘤则具有数量较多、复杂多样的分子遗传学异常。在子宫平滑肌源性肿瘤中,LM表现为良性的生物学行为;IVL呈侵袭性生长并可以复发,表现为低度恶性的生物学行为;平滑肌肉瘤(leiomyosarcoma,LMS)常复发和转移,表现为高度恶性的生物学行为。目前已有较多关于LM和LMS遗传学方面的研究,在LM中只发现了少数简单的遗传学改变,而在LMS中则发现了复杂多样的遗传学异常。鉴于此,笔者推测IVL可能具有数量不多的、但对肿瘤侵袭性生长具有关键作用的遗传学改变。
IVL组织形态温和,由良性的梭形细胞构成,常伴有玻璃样变、黏液样变性等退行性改变,本研究全部病例中都可以找到局部退行性改变的区域,可能和缺血有关。之前的研究在组织形态学和免疫表型方面未发现其与LM的明显差别[4],提示两者间可能具有较多共同的内在分子基础。Bcl- 2是一种重要的抗凋亡蛋白,在包括LM在内的多种肿瘤的发生、进展乃至靶向治疗中起重要作用[13]。本研究结果证实bcl- 2在IVL和LM中均普遍表达,提示bcl- 2对IVL肿瘤细胞的增殖可能同样起重要作用。并且bcl- 2在IVL中的表达水平明显高于LM,可能使肿瘤细胞获得更强的抗凋亡能力,从而与IVL延血管内向远处生长以及复发有关。有研究证实,调低bcl- 2的表达水平可以抑制LM肿瘤细胞的增殖[14],提示bcl- 2可能成为对IVL进行靶向治疗的有效靶点。
IVL具有向血管内生长的能力,血管内部分均覆盖有完整的血管内皮细胞,之前的研究也证实IVL内部的微血管数量增多[2- 3,5,15]。本研究20例IVL组织切片中均发现了由微小血管聚集构成的海绵状区域(图1B),区域内部的血管内皮明显增生,该种形态学改变在LM中并不多见,可能是IVL具有特征性的形态学改变,在既往关于IVL的报道中未见明确提及。本研究首次明确提出IVL的该种形态特征,有待于在后续更大规模的病例研究中进行验证。IVL与血管关系如此密切,引起了笔者研究其与VEGF关系的兴趣。VEGF是调节脉管生成和功能的重要因子,而VEGFR- 3更是调节内皮细胞功能的关键分子,在新生血管时其表达明显上调[16]。VEGFR- 3对多种肿瘤的浸润和转移具有重要的作用,也是肿瘤治疗的重要靶点之一[17- 18]。本研究20例IVL中有19例高表达VEGFR- 3,而10例LM中均未发现VEGFR- 3的表达,说明IVL除具有与LM共同的分子机制外,还额外具有LM不具备的分子改变。VEGFR- 3的高表达可能使IVL肿瘤细胞具备了刺激血管内皮增生、诱导血管生成的能力,与其内血管密度升高、延血管向远处生长的生物学行为密切相关,可能成为IVL重要的潜在治疗靶点。
综上,本研究证实在IVL中与LM一样具有bcl- 2的高表达,可能使其具有了较强的增殖能力;IVL还具有LM不具备的VEGFR- 3高表达,可能与其内较多的增生血管以及在血管内向远处生长的能力有关。至于IVL中促使bcl- 2和VEGFR- 3表达升高的内在因素及其具体作用机制,则有待于进一步深入研究。
[1]Islam MS, Protic O, Giannubilo SR, et al. Uterine leiomyoma: available medical treatments and new possible therapeutic options[J]. J Clin Endocrinol Metab,2013,98:921- 934.
[2]Du J, Zhao X, Guo D, et al. Intravenous leiomyomatosis of the uterus: a clinicopathologic study of 18 cases, with emphasis on early diagnosis and appropriate treatment strategies[J]. Hum Pathol,2011,42:1240- 1246.
[3]赵大春,田庄,梁智勇,等. 静脉内平滑肌瘤病的临床病理[J]. 协和医学杂志,2012,3:51- 55.
[4]古聪敏,余美融,林汉良. 子宫静脉内平滑肌瘤病临床病理及免疫表型分析[J]. 诊断病理学杂志,2009,16:198- 200.
[5]Karmon AE, Cardozo ER, Rueda BR, et al. MicroRNAs in the development and pathobiology of uterine leiomyomata: does evidence support future strategies for clinical intervention?[J]. Hum Reprod Update,2014,doi:10.1093/humupd/dmu0171.
[6]Zhu Y, Xie SW, Zhang JF, et al. Involvement of Bcl- 2, Src, and ERalpha in gossypol-mediated growth inhibition and apoptosis in human uterine leiomyoma and myometrial cells[J]. Acta Pharmacol Sin,2010,31:1593- 1603.
[7]Bodner K, Bodner-Adler B, Kimberger O, et al. Bcl- 2 receptor expression in patients with uterine smooth muscle tumors: an immunohistochemical analysis comparing leiomyoma, uterine smooth muscle tumor of uncertain malignant potential, and leiomyosarcoma[J]. J Soc Gynecol Investig,2004,11:187- 191.
[8]Beierle EA, Ma X, Stewart JE, et al. Inhibition of the focal adhesion kinase and vascular endothelial growth factor receptor- 3 interaction leads to decreased survival in human neuroblastoma cell lines[J]. Mol Carcinog,2014,53:230- 242.
[9]Decio A, Taraboletti G, Patton V, et al. Vascular endothelial growth factor C promotes ovarian carcinoma progression through paracrine and autocrine mechanisms[J]. Am J Pathol,2014,184:1050- 1061.
[10]Martins SF, Garcia EA, Luz MA, et al. Clinicopathological correlation and prognostic significance of VEGF-A, VEGF-C, VEGFR- 2 and VEGFR- 3 expression in colorectal cancer[J]. Cancer Genomics Proteomics,2013,10:55- 67.
[11]Garouniatis A, Zizi-Sermpetzoglou A, Rizos S, et al. Vascular endothelial growth factor receptors 1,3 and caveolin- 1 are implicated in colorectal cancer aggressiveness and prognosis—correlations with epidermal growth factor receptor, CD44v6, focal adhesion kinase, and c-Met[J]. Tumour Biol,2013,34:2109- 2117.
[12]Eklund L, Bry M, Alitalo K. Mouse models for studying angiogenesis and lymphangiogenesis in cancer[J]. Mol Oncol,2013,7:259- 282.
[13]Akl H, Vervloessem T, Kiviluoto S, et al. A dual role for the anti-apoptotic Bcl- 2 protein in cancer: Mitochondria versus endoplasmic reticulum[J]. Biochim Biophys Acta, 2014,doi: 10.1016/j.bbamcr.2014.04.017.
[14]Greenberg EF, Lavik AR, Distelhorst CW. Bcl- 2 regulation of the inositol 1,4,5-trisphosphate receptor and calcium signaling in normal and malignant lymphocytes: Potential new target for cancer treatment[J]. Biochim Biophys Acta,2014,doi: 10.1016/j.bbamcr.2014.03.008.
[15]Chen MJ, Peng Y, Yang YS, et al. Increased hyaluronan and CD44 expressions in intravenous leiomyomatosis[J]. Acta Obstet Gynecol Scand,2005,84:322- 328.
[16]Koch S, Claesson-Welsh L. Signal transduction by vascular endothelial growth factor receptors[J]. Cold Spring Harb Perspect Med,2012,2:a6502.
[17]Welti J, Loges S, Dimmeler S, et al. Recent molecular discoveries in angiogenesis and antiangiogenic therapies in cancer[J]. J Clin Invest,2013,123:3190- 3200.
[18]Takahashi S. Vascular endothelial growth factor (VEGF), VEGF receptors and their inhibitors for antiangiogenic tumor therapy[J]. Biol Pharm Bull,2011,34:1785- 1788.
Different Expressions of Bcl- 2 and Vascular Endothelial Growth Factor Receptor- 3 in Intravenous Leiomyomatosis and Classical Leiomyoma
WANG Wen-ze1, MA Guo-tao2, XIAO Yu1, LIANG Zhi-yong1, LOU Wei-zhen3, LI Ji1, ZHAO Da-chun1,WU Huan-wen1, LIU Tong-hua1
1Department of Pathology,2Department of Cardiac Surgery,3Department of Gynecology and Obstetrics, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences & Peking Union Medical College, Beijing 100730, China
LIU Tong-hua Tel: 010-69159361, E-mail:liuth_pumch@yahoo.com
Objective To explore the different expressions of bcl- 2 and vascular endothelial growth factor receptor- 3 (VEGFR- 3) in intravenous leiomyomatosis (IVL) and classical leiomyoma (LM). Methods We retrospectively reviewed the pathology of 20 cases of IVL, matching with 10 cases of LM. The bcl- 2 and VEGFR- 3 immunohistochemical staining was performed in the slides from all cases, and the results were compared between the IVL group and LM group. Results In the IVL group, all the 20 cases showed moderate to strong bcl- 2 immunohistochemical staining. Meanwhile, 19 cases showed moderate to strong VEGFR- 3 immunohistochemical staining, while 1 case was negative. In the LM group, all 10 cases showed weak to moderate bcl- 2 immunohistochemical staining and negative VEGFR- 3 staining. Conclusions Both bcl- 2 and VEGFR- 3 are highly expressed in IVL; in particular, the expression of VEGFR- 3 is dramatically different between IVL and LM. This indicates IVL and LM have different molecular alterations, which may play important roles in the pathogenesis and development of IVL.
intravenous leiomyomatosis; bcl- 2; vascular endothelial growth factor receptor- 3; immunohistochemistry
刘彤华 电话:010-69159361,E-mail:liuth_pumch@yahoo.com
R732.2+2;R446.8
A
1674-9081(2014)03-0297-05
10.3969/j.issn.1674-9081.2014.03.010
2014- 05- 09)

