MicroRNA-132转染对脂多糖诱导的肺泡巨噬细胞炎症反应的作用*
蓝琳友, 洪溪屏, 蔡元晖
(温州医科大学附属第五医院急诊科,浙江 丽水 323000)
MicroRNA-132转染对脂多糖诱导的肺泡巨噬细胞炎症反应的作用*
蓝琳友△, 洪溪屏, 蔡元晖
(温州医科大学附属第五医院急诊科,浙江 丽水 323000)
目的: 探讨转染微小RNA-132(miR-132)对肺泡巨噬细胞炎症反应的作用。方法: 将体外去致热源培养的大鼠肺泡巨噬细胞株NR8383分为空白对照组、阴性对照组和转染组,分别采用miR-132增敏剂、错义链和PBS作用。转染24 h后,CCK-8法检测细胞増殖;实时荧光定量PCR检测细胞中miR-132的表达;用脂多糖(LPS)作用细胞后,凝胶电泳迁移率实验(EMSA)检测细胞中NF-κB活性;Western blotting法检测细胞中肿瘤坏死因子α(TNF-α)和白细胞介素6(IL-6)的表达。结果: 与空白对照组和阴性对照组相比较,转染组细胞中miR-132的表达明显升高;转染组细胞増殖被明显抑制,与空白对照组相比较,差异有统计学意义(P<0.05);LPS作用后,转染组NF-κB、TNF-α和IL-6表达量显著下降,与空白对照组和阴性对照组相比较,差异均有统计学意义(P<0.05)。结论: 转染miR-132可抑制NR8383细胞増殖,并抑制LPS诱导的NR8383细胞的炎症反应。
MicroRNA-132; 肺泡巨噬细胞; 炎症反应
近年来研究表明,微小RNA(microRNAs, miRNAs)作为内源性非编码小分子RNA,在组织炎症反应、细胞增殖与凋亡、组织分化和肿瘤形成等多种生理过程起重要调节作用[1]。其中miR-132是当前研究热点之一,miR-132不仅在病毒感染及免疫反应过程中发挥重要作用[2-3],另外在LPS诱导肺泡巨噬细胞产生炎症反应中,miR-132的表达与炎症因子表达呈负相关[4],表明miR-132可能作为抑制肺泡巨噬细胞炎症反应的新作用靶点。为进一步明确miR-132调控肺泡巨噬细胞炎症反应中的作用机制,本研究观察转染miR-132对肺泡巨噬细胞NR8383生长和炎症因子表达的影响。
材 料 和 方 法
1 实验材料及主要试剂
胎牛血清、Ham’s F-12K培养基和0.25% EDTA胰蛋白酶购自Gibco;细胞浆蛋白抽提试剂盒、CCK-8试剂盒和BCA蛋白浓度测定试剂盒购自上海碧云天生物技术研究所;脂多糖(lipopolysaccharide, LPS)购自R&D;EMSA试剂盒购自Pierce;TNF-α、IL-6和β-actin抗体购自Epitomics;Lipofectamine 2000购自Invitrogen;CyTM3标记miRNA-132 mimic和miRNA-132错义链购自锐博生物科技有限公司;Trizol和PCR引物购自Invitrogen;Prime Script逆转录试剂盒购自ABI。
2 细胞培养、实验模型制备及分组
大鼠肺泡巨噬细胞株NR8383购自中科院上海细胞库,培养在含15%胎牛血清、质量浓度1×105U/L青霉素和100 mg/L链霉素、2 mmol/L谷氨酰胺和1.5 g/L碳酸氢钠的Ham’s F-12K培养液中,置于37 ℃、5%的CO2的培养箱内培养,2~3 d换液1次,细胞单层贴壁生长至70%~80%融合时胰蛋白酶消化传代。
将处于对数生长期的NR8383细胞按4×106/well接种到6孔板,每孔2 mL,细胞贴壁后分3组:(1)空白对照组:在培养基中加入浓度为50 nmol/L的Lipofectamine 2000和PBS;(2)阴性对照组:每孔加入50 nmol/L的CyTM3标记miRNA-132错义链;(3)转染组:在培养基中加入浓度为50 nmol/L 的CyTM3标记miRNA-132 mimic。培养24 h后收集细胞,在荧光显微镜下观察转染效率,real-time PCR检测细胞中miRNA-132的表达,继续放置培养箱中培养24 h后再加入浓度为1 mg/L的LPS。细胞放入培养箱6 h后离心收集细胞,置于-80 ℃冰箱。
3 主要方法
3.1 Real-time PCR检测NR8383细胞中miR-132的表达 用Trizol试剂提取总RNA,按说明书操作。总RNA经紫外分光光度计测定260 nm与280 nm处吸光度比值(A260/A280)为1.9~2.1,琼脂糖凝胶电泳法检测总RNA纯度。采用PrimeScript逆转录试剂盒进行逆转录,采用SYBR实时荧光定量试剂盒进行实时定量PCR检测,反应在25 μL体系中进行,反应条件:94 ℃ 1 min,57 ℃ 1 min,72 ℃ 7 min。以U6 snRNA作为内参照,miR-132的相对表达量采用2-ΔΔCt方法计算。
3.2 CCK-8法检测细胞增殖 收集转染后的各组NR8383细胞,制成单细胞悬液,以每孔4×103个细胞接种到96孔板,每孔200 μL,细胞贴壁后放置培养箱分别培养12 h、24 h、36 h和48 h,每组设5个复孔,同时设置空白调零组(不加细胞,加入等量的PBS)。培养结束前1 h,各孔加入CCK-8溶液0.01 mL后继续培养1 h,酶标仪测A450值,实验重复3次。细胞存活率(%)=(实验组A450值-空白调零组A450值)/(对照组A450值-空白调零组A450值)×100%。
3.3 Western blotting检测NR8383细胞中TNF-α和IL-6的表达 裂解细胞并分离细胞蛋白质,用Bradford法测量蛋白浓度后取等量蛋白质样品(20 μg),常规8% SDS-PAGE分离蛋白,半干转膜仪转膜,5%脱脂奶粉封闭,加入特异性Ⅰ抗(1∶1 000)于4 ℃下孵育过夜,HRP标记的羊抗兔IgG为Ⅱ抗(1∶2 500)室温孵育1 h,ECL显色,条带曝光强度用Quantity One 4.6.2(Bio-Rad)软件分析,以β-actin为内参照,通过与内参照的灰度比得出目的条带的相对表达水平。
3.4 EMSA实验 裂解细胞后提取核蛋白。EMSA实验方法参照文献[5]进行,探针序列为: 5′-TACTAGCTAGTTCGTGTCAG-3′,将6.5%非变性聚丙烯酰胺凝胶在电压为120 V条件下恒压电泳60 min,取10 μg核蛋白加入超纯水中室温反应30 min后再加入生物素标记探针,在室温下反应30 min后电泳100 min再印迹转移,用带正电荷尼龙膜380 mA恒流电转40 min,转移完后将尼龙膜至于紫外灯下交联15 min,将膜再用30 mL封闭液在室温下反应20 min,最后将膜放入平衡液中反应15 min,化学发光显色,条带曝光强度用Quantity One 4.6.2(Bio-Rad)软件分析,计算灰度值。
4 统计学处理
采用SPSS 11.5软件包进行统计学处理,计量资料以均数±标准差(mean±SD)表示,正态分布变量多组间比较用单因素方差分析,两两比较用LSD-t检验,以P<0.05为差异具有统计学意义。
结 果
1 荧光显微镜下观察细胞转染
NR8383细胞经转染CyTM3标记miR-132后,绿色荧光激发转染成功的细胞中的CyTM3发射出红光,在倒置荧光显微镜下观察,在NR8383细胞内可见大量颗粒状荧光,表明转染细胞成功,见图1。

Figure 1.Morphology of the rat alveolar macrophages NR8383 were observed under the fluorescence microscopy after transfected with miR-132 mimic (×100).
图1 荧光显微镜下观察CyTM3标记miR-132转染NR8383细胞的结果
2 各组NR8383细胞中miR-132的表达
Real-time PCR结果表明,在空白对照组、阴性对照组和转染组中miR-132的相对表达量分别为5.84±2.03、6.92±1.83和23.34±5.17。与空白对照组和阴性对照组相比较,转染组中miR-132的表达显著上调,差异有统计学意义(P<0.05),见图2。
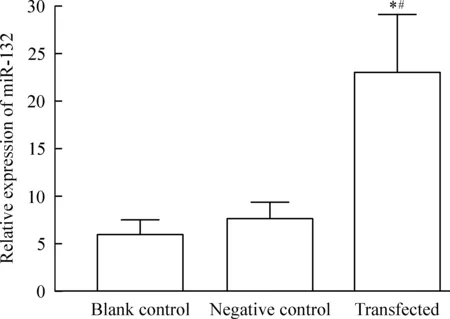
Figure 2.The relative expression of miR-132 in NR8383 cells.Mean±SD.n=3.*P<0.05vsblank control group;#P<0.05vsnegative control group.
图2 miR-132在各组NR8383细胞中的表达
3 CCK-8法检测各组NR8383细胞增殖
CCK-8实验的结果表明,在各个时点转染组的细胞增殖速度均明显低于空白对照组或阴性对照组,差异有统计学意义(P<0.05),见图3。
4 转染miR-132对NR8383细胞中NF-κB活性的影响
各组NR8383细胞中均有不同程度的NF-κB活性表达,LPS作用后可显著上调NR8383细胞中NF-κB的活性;与空白对照组或阴性对照组相比较,NF-κB活性在转染组中明显下降,差异有统计学意义(P< 0.05),见图4。

Figure 3.CCK-8 assay was used to determine the proliferation of NR8383 cells. Mean±SD.n=3.*P<0.05vsblack control group;#P<0.05vsnegative control group.
图3 CCK-8法检测转染miR-132对NR8383细胞增殖的影响

Figure 4.The NF-κB DNA-binding activity in NR8383 cells was measured by EMSA. Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsLPS.
图4 EMSA检测各组细胞中NF-κB活性
5 Western blotting检测TNF-α和IL-6在NR8383细胞中的表达
Western blotting检测结果表明,与空白对照组相比较,LPS作用后NR8383细胞中TNF-α和IL-6的水平明显增加,差异有统计学意义(P<0.05);而TNF-α和IL-6在转染组的水平较空白对照组或阴性对照组显著下降,有显著差异(P<0.05),见图5。
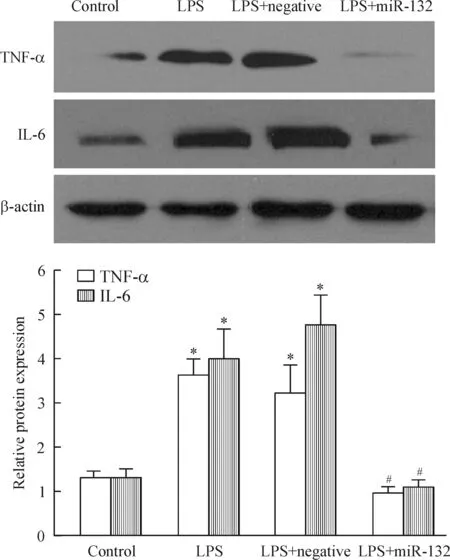
Figure 5.Western blotting analysis of TNF-α and IL-6 in NR8383 cells. β-actin protein served as loading control.Mean±SD.n=3.*P<0.05vscontrol;#P<0.05vsLPS.
图5 Western blotting检测TNF-α和IL-6在NR8383细胞中的表达
讨 论
肺泡巨噬细胞在肺损伤时被激活,肺泡巨噬细胞不但可吞噬侵入肺脏的炎症粒子,参与肺脏的防御和免疫,而且还能分泌大量的生物活性物质参与中性粒细胞在肺内的迁徙过程,因此在急性肺损伤过程中发挥了关键作用[6]。LPS是革兰氏阴性杆菌细胞壁的主要致病成分,也是脓毒症主要致病因素,在脓毒血症过程中,LPS可活化肺泡巨噬细胞Toll样受体/核转录因子(NF-κB)炎症通路,导致大量炎症因子如TNF-α、TGF-β、IL-6和IL-1释放,最终引起急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)的发生[7-8]。TNF-α作为炎症反应过程中出现最早和最重要的炎症介质,能激活中性粒细胞和淋巴细胞,使血管内皮细胞通透性增加,调节其它组织代谢活性并促使其它细胞因子的合成和释放,而IL-6能诱导B细胞分化和产生抗体,并诱导T细胞活化增殖、分化,参与机体的免疫应答,是炎症反应的促发剂[9]。在本研究采用LPS刺激肺泡巨噬细胞株NR8383来建立炎症反应模型,并检测NF-κB、TNF-α和IL-6在巨噬细胞中的表达来判断模型是否建立成功和炎症反应程度。本研究结果表明,LPS作用NR8383细胞后,活化NF-κB表达增加,同时TNF-α和IL-6蛋白表达显著上调,从而成功建立起炎症反应模型,与文献报道相符合[4]。
miRNAs是一类非编码小分子RNA,miRNAs可通过特异性识别靶基因mRNA的3′端非编码区位点而抑制蛋白翻译或诱导mRNA的降解,从而在转录后水平调控基因表达[1-3]。近年来研究表明miRNAs在机体炎症反应过程中发挥了一定作用。有研究表明,转染miR-146a后可下调巨噬细胞中多种炎症因子的表达[10];而miR-132作为当前微小RNA研究的热点之一,刘芬等[4]观察到肺泡巨噬细胞miR-132表达上调后可下调肺泡巨噬细胞中TNF-α的表达,同时miR-132的表达在炎症性肠病中的表达明显高出正常肠组织中的表达[3],从而表明miR-132与肺泡巨噬细胞介导的炎症反应关系密切,但尚未有转染miR-132对肺泡巨噬细胞介导的炎症反应的作用报道。在本研究中,NR8383细胞经转染CyTM3标记miRNA-132后,在倒置荧光显微镜下观察到绿色荧光激发转染成功的细胞中的CyTM3发射出红光,同时转染组NR8383细胞中miRNA-132表达明显上调,表明转染细胞miRNA-132成功;在分析转染miRNA-132后对NR8383细胞增殖影响的实验中,CCK-8结果表明,转染miRNA-132后对NR8383细胞增殖有明显抑制作用;另外本研究通过转染miR-132到巨噬细胞后观察到miR-132的表达明显增加,同时上调miR-132可显著下调NF-κB、TNF-α和IL-6在巨噬细胞中的表达,从而首次表明miR-132可通过Toll样受体/ NF-κB炎症通路抑制巨噬细胞的炎症反应。
综上所述,本研究成功建立起LPS诱导产生的肺泡巨噬细胞炎症反应模型,转染miR-132至巨噬细胞后可抑制细胞增殖,同时抑制炎症因子NF-κB、TNF-α和IL-6的表达,表明miR-132可通过Toll样受体/ NF-κB炎症通路抑制LPS诱导巨噬细胞产生的炎症反应。
[1] 廖紫薇, 邓红霞, 张国平,等. 致癌性微小RNA-106a对正常胃黏膜上皮细胞和胃癌细胞生长的影响[J]. 中国病理生理杂志, 2011, 27(10):1885-1889.
[2] Hanieh H, Alzahrani A. MicroRNA-132 suppresses autoimmune encephalomyelitis by inducing cholinergic anti-inflammation: a new Ahr-based exploration[J]. Eur J Immunol, 2013, 43(10):2771-2782.
[3] Maharshak N, Shenhar-Tsarfaty S, Aroyo N, et al. MicroRNA-132 modulates cholinergic signaling and inflammation in human inflammatory bowel disease[J]. Inflamm Bowel Dis, 2013, 19(7):1346-1353.
[4] 刘 芬, 江 榕, 李 勇, 等.微小RNA-132在脂多糖诱导大鼠肺泡巨噬细胞炎症反应中的表达变化[J]. 中华危重病急救医学, 2014, 26(2):80-83.
[5] Wang YX,Yan A, Ma ZH, et al. Nuclear factor-κB and apoptosis in patients with intracerebral hemorrhage[J]. J Clin Neurosci, 2011, 18(10):1392-1395.
[6] 杜 涛, 黄 海, 陈欣脂,等. 多糖通过PI3K/Akt/mTOR通路调控巨噬细胞自噬[J]. 中国病理生理杂志, 2014, 30(4):675-680.
[7] Zeng Z, Gong H,Li Y, et al. Upregulation of miR-132 contributes to the suppression of inflammatory responses in LPS-induced acute lung injury[J]. Exp Lung Res, 2013, 39(7):275-282.
[8] 许欣婷, 董明清, 胡 美,等. 骨髓来源间充质干细胞培养上清液减轻脂多糖诱导的小鼠急性肺损伤[J]. 中国病理生理杂志, 2014, 30(2):286-290.
[9] Ramakrishna K,Pugazhendhi S, Kabeerdoss J, et al. Association between heat shock protein 70 gene polymorphisms and clinical outcomes in intensive care unit patients with sepsis[J]. Indian J Crit Care Med, 2014, 18(4):205-211.
[10]刘 芬, 曾振国, 聂 成,等.转染微小RNA-146a对肺泡巨噬细胞肿瘤坏死因子-α表达的影响[J]. 中华危重病急救医学, 2013, 25(6):335-338.
蓝斑核的线粒体氧化应激受活性一氧化氮合成酶的调控
去甲肾上腺素能(noradrenergic, NA)蓝斑核(locus coeruleus, LC)神经元支配大脑的大多数部位,保持大脑的醒觉状态,并在兴奋和紧张时期调节神经元的活动和可塑性。LC的缺失是老龄化相关的神经退行性疾病如帕金森病(Parkinson’s disease, PD)和阿尔兹海默病(Alzheimer’s disease, AD)的主要特征。为了探讨引起这类疾病的可能的生理因素,作者采用电生理学的方法和光镜研究小鼠大脑切片,观察小鼠LC神经元的异常变化。作者发现由于L型Ca2+通道的开放,LC神经元的自主活动伴随着Ca2+浓度的摆动而变化。这种Ca2+浓度的摆动可以增强线粒体的氧化应激,但一氧化氮合酶(nitric oxide synthase, NOS)受到抑制时,Ca2+浓度的振幅相应衰减,氧化应激也相应减弱。觉醒和二氧化碳都可以增加LC神经元的放电率,但它区别于线粒体氧化应激的影响,可见活动和应激之间的关系具有延展性。在PD的动物模型中,同样可以观察到氧化应激有增加的趋势。因此,根据研究结果,作者指出活性依赖的Ca2+通道和所产生的线粒体氧化应激是加重LC神经元损伤的重要因素,并受NOS的调控。
Nat Neurosci, 2014, 17(6):832-840(刘紫萍)
Effect of microRNA-132 transfection on lipopolysaccharide-induced inflammation in rat alveolar macrophages
LAN Lin-you, HONG Xi-ping, CAI Yuan-hui
(EmergencyDepartment,TheFifthAffiliatedHospitalofWenzhouMedicalUniversity,Lishui323000,China.E-mail:lanlinyou2013@163.com)
AIM: To investigate the effect of microRNA-132 (miR-132) transfection on the lipopolysaccharide (LPS)-induced inflammation in rat alveolar macrophages. METHODS: The rat alveolar macrophage NR8383 cultured without pyrogeninvitrowere divided into blank control group, negative control group and transfected group. The cells in the 3 groups were transfected with phosphate buffer solution (PBS), Lipofectamine 2000 and synthesized miR-132 mimic respectively. The cell proliferation was detected by Cell Counting Kit-8 (CCK-8) assay. Real-time PCR was used to detect the expression of miR-132 in the cells. After NR8383 cells were stimulated with LPS for 6 h, the NF-κB DNA-binding activity was measured by electrophoretic mobility shift assay (EMSA). The expression of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) in NR8383 cells was assayed by Western blotting.RESULTS: After transfection, the expression of miR-132 was significantly higher than that in blank control group and negative control group. The growth of NR8383 cells in transfected group was significantly inhibited compared with blank control group and negative control group (P<0.05). After the cells were stimulated with LPS, the productions of NF-κB, TNF-α and IL-6 in transfected NR8383 cells were decreased compared with blank control group and negative control group (P<0.05).CONCLUSION: Transfection of alveolar macrophages with miR-132 significantly suppresses the cell growth, and inhibits inflammatory responses induced by LPS.
MicroRNA-132; Alveolar macrophages; Inflammatory response
1000- 4718(2014)12- 2190- 05
2014- 06- 16
2014- 09- 16
浙江省卫生厅资助项目(No. 2012A122)
R363.2
A
10.3969/j.issn.1000- 4718.2014.12.013
△通讯作者 Tel: 0578-2129120; E-mail: lanlinyou2013@163.com

