摇蚊基因组DNA的提取方法研究
方响亮,彭 琴,伊剑锋,万 玮,傅 悦*
(1.湖北民族学院生物科学与技术学院,湖北恩施 445000;2.生物资源保护与利用湖北省重点实验室(湖北民族学院),湖北恩施 445000)
作为现代生物系统学和生物进化学研究的热点方向之一,分子生物学的相关技术在鉴别动物物种、遗传多样性分析以及物种起源和进化等方面的研究中常被用到.目前,该技术已普遍应用到昆虫的相关研究上.基因组DNA的提取质量是开展后续分析检测工作的重要基础,为了成功从昆虫中提取到高质量的基因组DNA,前人就其提取方法进行过大量的研究.张大治等[1]运用CTAB法和蛋白酶K法(SDS法)提取蜻蜓基因组DNA,研究结果表明2种方法均较适宜.杨子祥[2]证明了利用平衡酚法提取蚜虫基因组DNA的可行性.张民照等[3]和葛风伟等[4]分别对直翅目昆虫的基因组DNA提取方法进行过研究,前者认为平衡酚法效果甚佳,后者则认为SDS法较好.代金霞等[5]、刘漩等[6]分别对拟步甲科昆虫的基因组DNA的提取方法进行探讨,前者的结果显示SDS法较可行,后者则得出CTAB法较有效.田英芳等[7]曾利用SDS法提取蟋蟀、螽斯、蝗虫、天牛和蜻蜓的基因组DNA,提取效果都较理想.印红等[8]采用改良的平衡酚法提取过果蝇、蝗虫、七星瓢虫和钝齿瑟虫的基因组DNA,其效果良好.通过前人的研究发现,用于昆虫基因组提取的方法主要包括基因组DNA提取试剂盒法SK8222、蛋白酶K法、SDS-苯酚法、平衡酚法、SDS法、CTAB法、NaCl法等.
摇蚊(Chirinomids)属于昆虫纲(Insecta)、双翅目(Diperta)、长角亚目(Nematocera)、蚊总科(Culicomorpha)、摇蚊科(Ceratopogonidae),是一种世界性分布的水生昆虫,几乎遍及所有的淡水生境.常利用摇蚊幼虫进行水质监测、生态毒理学以及遗传毒理学等方面的研究.摇蚊成虫分类学方向的研究更受国内外学者的重视,长期以来运用形态特征进行分类,并取得了显著成果,随着分子生物学的发展,近几年摇蚊分子水平的研究逐渐受到重视.本研究分别使用上海生工生物有限公司提供的动物基因组DNA快速提取试剂盒法以及SDS法、CTAB法、NaCl法提取摇蚊的基因组DNA,进行效果比较,以期筛选出最适宜摇蚊科昆虫基因组DNA的提取方法,为摇蚊科昆虫分子生物学研究做好基础工作.
1 材料与方法
1.1 材料
试验所选摇蚊为成虫,于2014年4月采自湖北省恩施市湖北民族学院校园内,用85%乙醇浸泡保存.
1.2 试验仪器、用品及试剂
1.2.1 试验仪器 立式高压蒸汽灭菌锅(上海博迅实业有限公司医疗设备厂),电动组织研磨器(EQ6002,生工生物工程(上海)有限公司),台式离心机(Centrifuge 5415R,Eppendof AG22331 Hamburg),漩涡混合器(XW-80A,上海青浦沪西仪器厂),恒温水浴锅(HHS型,上海博迅实业有限公司医疗设备厂),移液抢(Genex pipette),微量紫外分光光度计(Thermo Scientific NANODROP 2000C),掌上离心机(Scilogex D1008E,美国赛洛捷克),PCR仪(Applied Biosystems 2720 Thermal Cycle),电子天平(Sartorius BS2245,赛多利斯科学仪器(北京)有限公司),微波炉(格兰仕G70D20CSP-D2CS0),电泳仪(DYY-10C型)和电泳槽(DYCP-31DN 型,北京市六一仪器厂),凝胶成像仪(Universal HoodII,Bio-Rad Laboratories),pH 计等.
1.2.2 试剂及药品 CTAB、异戊醇、DNA Marker(1kb)、琼脂糖,Tris、EDTA、SDS、NaCl、异丙醇,RNase A、蛋白酶K,Taq DNA聚合酶、10×PCR buffer、MgCl2、dNTP mixture Solution、动物基因组DNA快速抽提试剂盒SK8222、6×Loading Buffer、dd Water(生工生物工程(上海)股份有限公司),无水乙醇(天津市恒兴化学试剂制造有限公司),苯酚、HCl(武汉市中天化工有限责任公司)、氯仿(武汉市江北化学试剂有限责任公司)、NaOH(武汉中南化工试剂有限公司),COI引物 LCO 1490、HCO 2198,EB(BIO-BASIC INC).
1.2.3 试剂配制 SDS 提取液(50 mmol/L EDTA,1%SDS,100mmol/L Tris-HCl,0.5 mol/L NaCl,PH8.0);1 mol/L Tris-HCl(PH8.0)500 mL,500 mmol/L EDTA(PH8.5)500 mL,TE 缓冲液(1 mmol/L EDTA,10 mmol/L Tris-HCl,PH8.0);蛋白酶 K(20 mg/mL,10 mg/mL);RNA 酶(10 mg/mL);20%SDS 溶液;5 mol/L NaCl溶液;STE 溶液(0.1 mol/L NaCl,1 mmol/L EDTA,10 mmol/L Tris-HCl(PH8.0);CTAB 提取液(2%CTAB,20 mmol/L EDTA,1.4mol/L NaCl,100mmol/L Tris-HCl(PH8.0)),50×TAE buffer(2mol/L Tris-醋酸,100mmol/L EDTA).
1.3 基因组DNA的提取方法
第一组选取大小、外形一致的完整摇蚊成虫数只,分别选取2只放入1.5 mL的离心管中,共装4管,分别编号为1、2、3、4.第二组再另取4个1.5mL的离心管,每管装入1只摇蚊,分别编号A、B、C、D,按照以下4种方法提取摇蚊基因组DNA.
1.3.1 动物基因组DNA快速抽提试剂盒法(改良) 采用生工生物工程(上海)有限公司最新研制的动物基因组DNA快速抽提试剂盒SK8222.取预处理过的摇蚊标本,放到1.5 mL的离心管中,加入180 μL Buffer Digestion,用电动研磨杵充分研磨,加入20 μL蛋白酶 K(10 mg/mL),20 μL RNA酶,震荡摇匀,56℃水浴过夜;加入200 μL Buffer PA,充分混合,置于-20℃冰箱放置5 min;将样品于室温下10000 r/min离心5 min,转移所得上清液(500~550μL)到已灭菌的新的1.5mL离心管中;加入等体积的异丙醇,充分混匀,室温放置5 min,室温10000r/min离心5min,弃上清;加入600μL 75%乙醇,颠倒漂洗1~3min,10000r/min离心2min,弃上清,重复此步骤一次;室温开盖倒置5~10 min,至没有明显的乙醇气味即可;得到的DNA用25 μL TE Buffer溶解.提取的DNA置于-20℃保存.
1.3.2 改良的SDS法 参考王茜[9]提取摇蚊基因组DNA的方法.取预处理过的摇蚊标本,加100 μL SDS提取液,用电动研磨杵研碎,后用500 μL提取液冲洗枪头;加20 μL蛋白酶K(10 mg/mL),20 μL RNA酶,混匀后置于56℃水浴过夜(时间充裕的话每隔20~30 min在漩涡混合器上混合30 s);加300 μL Tris饱和酚、300 μL氯仿:异戊醇(24∶1),抽提DNA,12000r/min离心10min,取上清;加入与上清等体积的氯仿:异戊醇(24∶1),12000 r/min离心10 min,取上清;加等体积的异丙醇于-20℃中沉淀DNA 2~3 h,12000 r/min离心15 min,弃上清;加600 μL 70%乙醇,洗涤DNA,12000 r/min离心15 min,弃上清,重复此步骤1次;浓缩干燥后加25 μL TE,溶解DNA,置于4℃保存备用.
1.3.3 改良CTAB法 参考王茜[9]提取摇蚊基因组DNA的方法.取预处理过的摇蚊,加100 μL CTAB提取液,用电动研磨杵研碎,后用500 μL提取液冲洗枪头;加20 μL蛋白酶K(10 mg/mL)、20 μL RNA酶,混匀后置于56℃水浴过夜(时间充裕的话每隔20~30min在漩涡混合器上混合30s);加300μL Tris饱和酚、300μL氯仿:异戊醇(24∶1),抽提DNA,12000 r/min离心10 min,取上清;加入与上清等体积的氯仿:异戊醇(24∶1),12000 r/min离心10 min,取上清;加等体积的异丙醇于-20℃中沉淀DNA 2~3 h,12 000 r/min离心15 min,弃上清;加600 μL 70%乙醇,洗涤DNA,12000 r/min离心15 min,弃上清,重复此步骤1次;浓缩干燥后加25 μL TE,溶解DNA,置于4℃保存备用.
1.3.4 改良NaCl法 参考王茜[9]提取摇蚊基因组DNA的方法.取预处理过的摇蚊,加200 μL STE,用电动研磨杵研碎;加45~50μL SDS,4~5μL RNA 酶,37℃消化1h;加蛋白酶K 4~5μL(20mg/mL),56℃消化过夜;加5mol/L NaCl 300μL,在漩涡混合器上高速混合30s,10000r/min离心30min,取上清;加等体积的异丙醇于-20℃中沉淀 DNA 2 h,10000 r/min 离心15 min,弃上清;加600 μL 70%乙醇,洗涤 DNA,12000 r/min 离心15 min,弃上清,重复此步骤1次;浓缩干燥后加25 μL TE,溶解DNA,置于4℃保存备用.
1.4 基因组DNA质量检测
观察每种处理的DNA沉淀的性状.在微量紫外分光光度计上做DNA的产量和质量分析;然后进行琼脂糖电泳检测.
1.4.1 微量紫外分光光度计检测DNA纯度和浓度 吸取2 μL样品DNA溶液,直接滴在微量紫外分光光度计的上样孔处,在蛋白核酸分析仪上测定其在260 nm和280 nm处的消光值(OD值).通过OD260/OD280的比值计算DNA样品的纯度.
1.4.2 PCR-COI 以LCO 1490、HCO 2198作为引物,摇蚊基因组DNA为模板对摇蚊COI基因进行扩增,PCR 扩增反应体系总体积为 25 μL.其中 10×PCR buffer 2.5 μL,LCO primer 0.5 μL ,HCO primer 0.5 μL,dNTP(10mmol/L)0.5μL,MgCl22.0μL,Taq DNA polymerase 0.15μL,摇蚊 DNA 1.0μL,dd water 17.85μL.PCR扩增反应条件为:95℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸1 min,共24 cycles;最后72℃延伸5 min,7℃保存.
1.4.3 PCR产物检测 配置浓度为l%的琼脂糖凝胶50 mL,加热直至完全溶解.待胶冷却至60℃左右时,将胶倒入胶槽中,常温下冷却10~20 min左右,使胶凝固后拔去梳子将其推入装有1×TAE的电泳槽中,胶孔朝向负极,液面约淹没胶面1mm左右.将6×Loading Buffer 1μL与5μL的PCR扩增样品用移液抢充分混匀,第一孔点入 2 μL DNA Marker,第二孔点入5μL混匀的DNA样品,而后在输出电压80V下电泳45min最后在凝胶成像分析系统中观察结果并照相.

表1 第1组编号1、2、3、4样品DNA的OD值及检测浓度Tab.1 OD values and detective density of No.1,2,3,4 DNA samples of group I
2 结果及分析
2.1 紫外分光光度计法检测
第1组中每个样品检测两次取平均值,检测结果见表 1.一般认为,OD260/OD280值在1.6~1.8时DNA较纯;大于1.8,说明样品中 RNA未除尽;小于1.6,说明样品中含有蛋自质.从检测结果可以看出,这4种方法均可获得一定量的DNA,但是不同方法提取的DNA质量有明显差异,见表1.前三种方法所提取的DNA比值都大于1.8,说明所获得的DNA中遗留有较多RNA.而NaCl法提取的DNA比值低于1.6,说明所测DNA样品中蛋白质未除尽.前三种方法中SDS法所得样品OD260/OD280比值最接近1.8,说明此法获得的DNA相对于其他方法纯度更高一些.在所测DNA样品浓度一栏中,可知浓度由高到低依次为试剂盒法、CTAB法、SDS法、NaCl法.
第2组每个样品检测三次取平均值.其结果见表2.由下表可知,只有SDS法所得DNA A260/A280值平均值在1.6~1.8,说明所得 DNA 纯度较高,试剂盒法、CTAB法中比值皆大于1.8,说明有大量 RNA存在,NaCl法所得明显小于1.6,说明其中含有蛋白质等杂质.但CTAB法所得DNA浓度最高,其后为试剂盒法,SDS法,NaCl法所得依然最少.
第1组每个离心管中DNA样品由2只摇蚊所提取得到,第2组每个离心管中DNA样品由1只摇蚊所提取得到,从表3可看出试剂盒法和SDS法所提DNA两组比例接近2∶1,符合所用样品的数量比,而CTAB法两组比例接近1∶1,NaCl法中第2组浓度甚至大于第1组.
2.2 电泳法检测结果
电泳结果见图1.第一组4个样品编号为 1、2、3、4,第二组 4 个样品编号为A、B、C、D,分别依次用试剂盒法、SDS法、CTAB法、NaCl法提取DNA;从图1可知,4种方法均可提取出DNA.DNA Marker与扩增片度都有一定的拖尾现象,这可能部分原因与电泳条件和琼脂糖凝胶有关,除此之外,基于不同DNA提取方法的拖尾现象有不同程度的差异,如第一组CTAB法和SDS法提取的DNA条带窄小但清楚、完整,推测这两种方法所提DNA完整且纯度较高,表1数据显示试剂盒法提取DNA纯度也较高,但显示拖尾,推测DNA有断裂现象;而NaCl法所提取的DNA条带相对拖尾明显,根据表1显示该方法提取DNA纯度不高,推测主要可能因含有较多杂质如蛋白质、多糖等导致其纯度不高.第2组中,试剂盒法、SDS法、CTAB法所得条带都较明亮但皆有拖尾现象,又因依据表2,这三种方法提取DNA纯度较高,推测拖尾现象可能因DNA断裂引起或由于第二组选取样品种类不同导致COI引物特异性不同;NaCl法条带模糊,无拖尾现象,推测COI引物在该种中特异性较高.
综合以上分析可知,提取摇蚊基因组DNA的方法中,依据紫外分光光度计法检测结果,得到产物纯度由高到低依次为SDS法、试剂盒法、CTAB法、NaCl法,浓度由高到低依次为试剂盒法、CTAB法、SDS法、NaCl法.综合考虑,提取摇蚊基因组DNA的最佳方法是试剂盒法,其次为CTAB法和SDS法.依据电泳法检测结果得出,4种方法提取的DNA的浓度都能扩增出特异的COI基因片段.
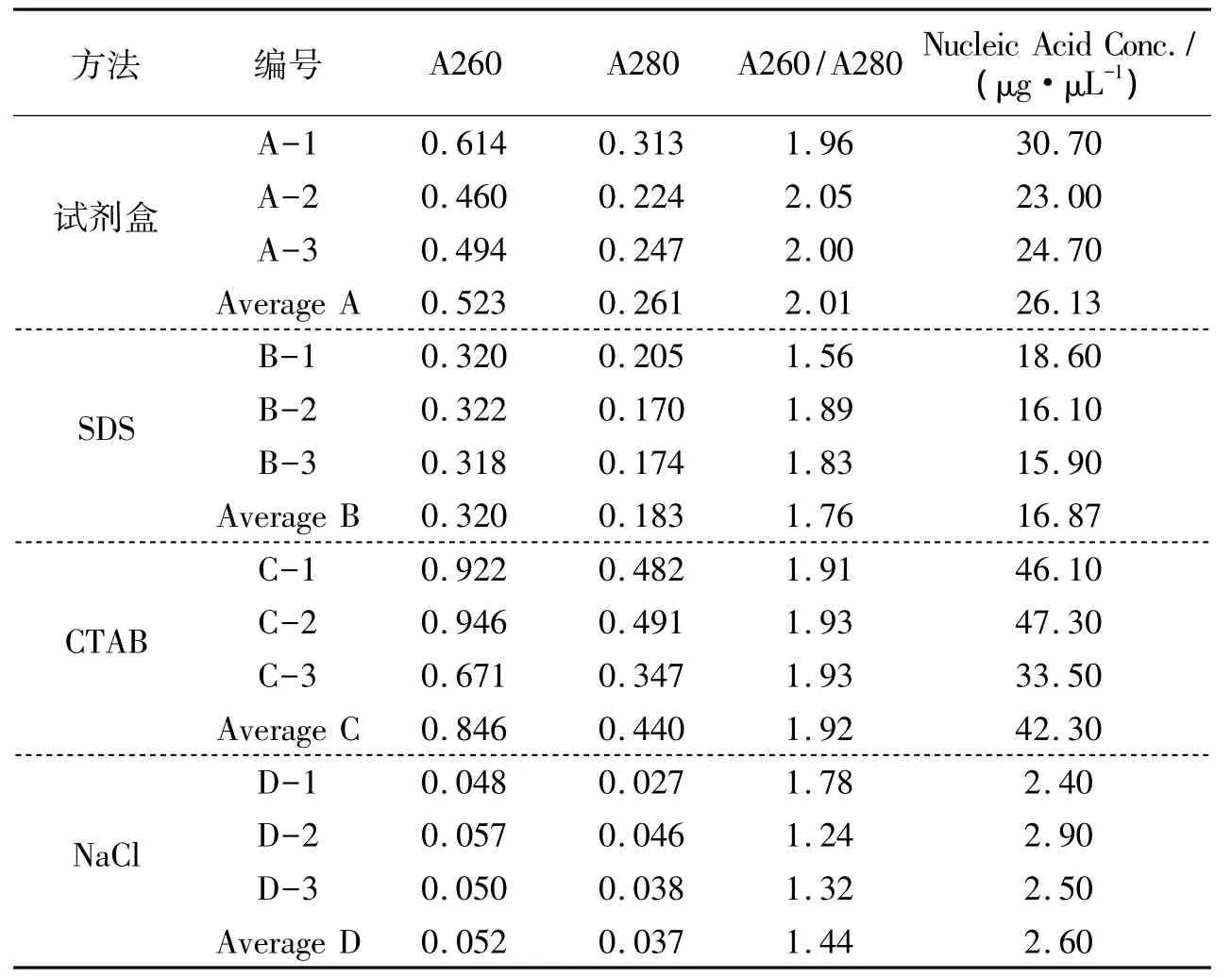
表2 第2组编号A、B、C、D样品DNA的OD值及检测浓度Tab.2 OD values and detective density of No.A,B,C,D DNA samples of group II

表3 第1组、第2组所得DNA样品浓度比较Tab.3 The comparison of DNA sample’s density of group I between group II
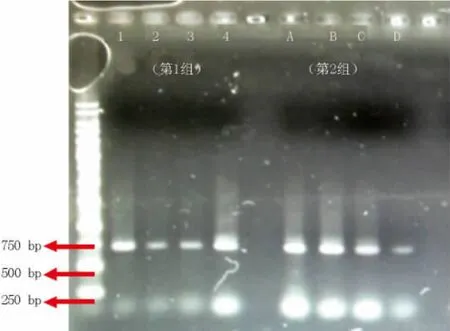
图1 PCR-COI琼脂糖凝胶电泳图Fig.1 The picture of agarose gel electrophoresis of PCR results
3 讨论
本研究用4种方法提取摇蚊基因组DNA浓度和纯度的比较主要依据第1组实验数据(表1),因为该组选取的4种样品来自同一采集地和采集时间的婚飞群体,即同一物种,具有较好的可比性;第2组选取的4个样品个体大小、形态特征明显不同,通过该组的数据(表2)进一步验证了4种方法提取的DNA的纯度高低与第1组结论一致,但该组数据得出的浓度无可比性.
本研究,第1组每个样品选取了2头摇蚊,第2组每个样品选取1头摇蚊,个体大小、数量与DNA浓度有一定的相关性,因此两组的DNA浓度进行了进一步比较,见表3,根据选取个体数量不同,第1组(2头标本)浓度应高于第2组(1头标本),甚至第1组浓度可能为第2组的2倍.但由表3可知,只有试剂盒法和SDS法符合这个比例,CTAB法和NaCl法都存在反常情况,分析原因可能是由于选材时由于存在种类差异的所造成的:第1组选材时特别注重了选取同一种类,以便减少误差,突出提取方法的差异;而第2组选材时,一方面是受到实验材料的限制,造成选取种类大小不一,另一方面是为了验证摇蚊个体大小差异对DNA提取浓度或纯度的影响.
本实验采用的方法皆在多次实验基础上做过改良,其中试剂盒采用生工生物工程(上海)有限公司最新研制的动物基因组DNA快速抽提试剂盒SK8222,本研究过程中利用该试剂盒做过多次尝试,都未能提取到理想的DNA条带.因此将原方法的65℃水浴1~3 h改为56℃水浴过夜,使组织彻底裂解释放出DNA,而对于是否额外添加蛋白酶K则可视具体实验要求添加而不会对提取DNA造成大的影响,第1组试剂盒方法中额外添加蛋白酶K,而第2组试剂盒方法中按照标配操作,未额外加蛋白酶K;同时为了保证提取DNA的浓度,在溶解时改为用25 μL TE Buffer溶解.其他几种方法参考王茜[9]的论文,同样经过笔者多次实验探究都未能获得理想结果,因此在原方法(水浴2~3 h)的基础上采用水浴过夜处理,过夜水浴加长了裂解时间,能够使样品充分裂解,有利于释放DNA,同时加大了蛋白酶K的用量,有利于消除蛋白质对于DNA提取的影响.
本实验采用摇蚊COI引物对摇蚊COI基因进行PCR扩增后再用琼脂糖电泳检测,一方面可以对所提DNA的质量进行检测,另一方面也为分子生物学所用到的基因片段后续工作打好基础.
[1]张大治,戴沛捷.蜻蜓目昆虫DNA的提取方法研究[J].宁夏农学院学报,2004,25(3):10-12,27.
[2]杨子祥,冯颖,陈晓鸣.一种有效的蚜虫基因组DNA提取方法[J].林业科学研究,2005,18(5):641-643.
[3]张民照,康乐.飞蝗总DNA的提取和RAPD分析条件的摸索[J].动物学研究,2001,22(1):20-26.
[4]葛风伟,季荣,曾献春,等.西伯利亚蝗基因组DNA提取及RAPD分析条件的优化[J].昆虫知识,2007,44(4):505-507.
[5]代金霞,于有志,郑哲民.拟步甲昆虫基因组DNA提取的比较研究[J].宁夏大学学报:自然科学版,2004,25(1):66-68.
[6]刘漩,张富春,马纪.一种提取荒漠拟步甲昆虫基因组DNA的新方法[J].干旱区研究,2009,26(4):582-583.
[7]田英芳,黄刚,郑哲民,等.一种简易的昆虫基因组DNA提取方法[J].陕西师范大学学报:自然科学版,1999,27(4):82-84.
[8]印红,刘晓丽,王彦芳,等.一种改进的昆虫基因组DNA的提取方法[J].河北大学学报:自然科学版,2002,22(1):80-82.
[9]王茜.直突摇蚊亚科高级阶元的分子系统学研究(双翅目:摇蚊科)[D].天津:南开大学,2011.

