早期糖尿病肾病患者血糖、肾小球率过滤、NAG酶与尿UBA52的关系研究
张 艳, 任 荣, 张 蕾
(新疆医科大学第五附属医院肾病科, 乌鲁木齐 830011)
最新流行病学调查报告显示,我国20岁以上人群糖尿病患病率已达9.7%,而糖尿病前期的患病率高达15.5%,估计目前我国约有92 00万人糖尿病患者、148 00万人糖尿病前期患者。糖尿病已成为威胁我国公众健康的重大疾病[1]。糖尿病肾脏疾病(diabetic kidney disease,DKD)的患病率也逐年增加。据报道,亚洲人群中2型糖尿病患者并发微量白蛋白尿的比例高达55%[2]。在美国糖尿病导致的终末期肾脏疾病(ESRD)患者占透析总人数的54%[3]。研究发现,相对于肾小球病变,肾小管病变与肾功能恶化有更密切相关关系[4],肾小管间质改变并非继发于肾小球病变,而是DKD早期病变和原始特征之一[5-8]。糖尿病肾病起病隐匿,早期缺乏明显的临床表现,一旦进展至临床糖尿病肾病期,肾功能常进行性恶化。目前就糖尿病肾病(DN)的诊断而言,传统的肾活检由于具有一定的创伤性,限制了其临床应用,而尿白蛋白的检测又存在特异性不高的缺陷[9]。因此,医学界对DN生物标志物进行了大量的研究,不仅有助于更好地阐明DN的发生机制,且对DN的早期诊断、治疗效果的检测及预后的判断均具有重大意义。近期研究发现泛素核糖体结合蛋白52(UBA52)在早期糖尿病肾病患者中有其特异性。本研究以新疆医科大学第五附属医院101例住院患者为研究对象,检测比较健康对照者、糖尿病及糖尿病肾病者血与尿UBA52、N-乙酰-β-D氨基葡萄糖甘酶(NAG酶)、α1微球蛋白、血糖、糖化血红蛋白及肾小球滤过率(glomerular filtration rate,GFR)指标的差异,并探讨其与尿UBA52的关系。
1 资料与方法
1.1一般资料选择新疆医科大学第五附属医院住院患者101例,随机分为3组:正常对照组22例,糖尿病组(DM组)20例,糖尿病肾病组(DN组)59例。纳入标准:(1)年龄≥18岁,血肌酐<265 μmol/L,自愿加入本研究的健康人群及患者;(2)糖尿病组所有患者必须符合2010《中国2型糖尿病防治指南》糖尿病诊断标准。排除标准:(1)有发热、肿瘤、妊娠、充血性心衰之一者;(2)糖尿病肾病组排除内生肌酐清除率≥265 μmol/L者;(3)正常对照组排除糖尿病、高血压、肾脏疾病患者;(4)糖尿病肾病组排除其他原因导致的肾脏损害如高血压肾损害、原发性肾炎、肾病综合征、IgA肾病等患者。金标准:同时符合下列条件者为阳性,否则为阴性:(1)符合2010年《中国2型糖尿病防治指南》糖尿病诊断标准;(2)白蛋白/肌酐(albumin-to-creatinine ratio,ACR)≥30 μg/mg。3组年龄、性别分布及体质指数(BMI)差异无统计学意义(P>0.05),见表1。
1.2方法
1.2.1 血标本采集 血标本采集前3 d无肌酐饮食,并限蛋白入量,避免剧烈运动,使血中内生肌酐浓度达到稳定;第4天清晨采血标本3 mL,分别装入免疫管和生化管。
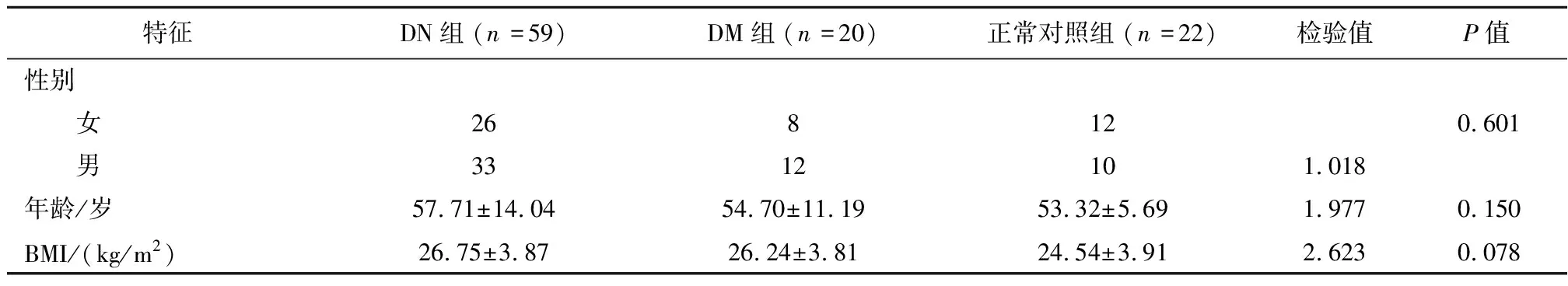
表1 一般特征表
1.2.2 尿标本采集 (1)ACR尿标本为空腹8 h晨起第1次清洁中段尿5 mL。(2)使用校正的简化“肾脏病膳食改良试验(MDRD)”公式计算GFR。尿标本采集方法:为排除来自动物骨骼肌和大量蛋白质食物中外源性肌酐的干扰,试验前3 d给受试者无肌酐饮食,并限蛋白入量,避免剧烈运动,使血中内生肌酐浓度达到稳定。试验前24 h禁服利尿剂,留取24 h尿,其间保持适当的水分入量,禁服咖啡、茶等利尿性物质,准确计量全部尿量(mL)。
1.2.3 尿微量白蛋白及UBA52的检测 采用免疫透射比浊法检测尿微量白蛋白,早晨抽取空腹静脉血3 mL分离血清。检测仪器为BECKMAN 8000,由同一经验丰富的检验医师检验。采用酶联免疫法检测UBA52,UBA52 ELISA KIT从 “抗体在线”购买;由3名培训合格的实验研究人员进行检验操作。
2 结果
2.13组相关指标的比较DN组NAG酶、α1微球蛋白、GFR、血糖、糖化血红蛋白、血及尿UBA52水平均高于正常对照组,差异均有统计学意义(P<0.05);DM组NAG酶、α1微球蛋白、血糖及糖化血红蛋白与正常对照组相比差异均有统计学意义(P<0.05);DM和DN组比较,GFR在DN组中升高更为明显,差异有统计学意义(P<0.05),血、尿UBA52水平在DM和DN组中均有升高,且尿UBA52在DN组中升高更明显,差异有统计学意义(P<0.05),见表2。
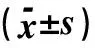
表2 3组相关指标的比较
注:与正常对照组比较,*P<0.05; 与DM组比较,●P<0.05。
2.2尿UBA52的影响因素分析以尿UBA52为因变量,分别以血UBA52、NAG酶、α1微球蛋白、GFR、血糖、糖化血红蛋白为自变量行逐步多元线性回归。回归方程式:尿UBA52(ng/mL)=-0.697+0.001 ACR+血UBA52(ng/mL)+0.028 NAG酶+0.003 GFR-0.71糖化血红蛋白-1.99尿UBA52(ng/mL);方程检验:F=21.392,P=0.000,回归方程决定系数为0.678,标准决定系数为0.646,P=0.014。比较标准偏回归系数,结果显示血UBA52、NAG酶、糖化血红蛋白及肾小球滤过率对尿UBA52的升高均有影响,见表3。
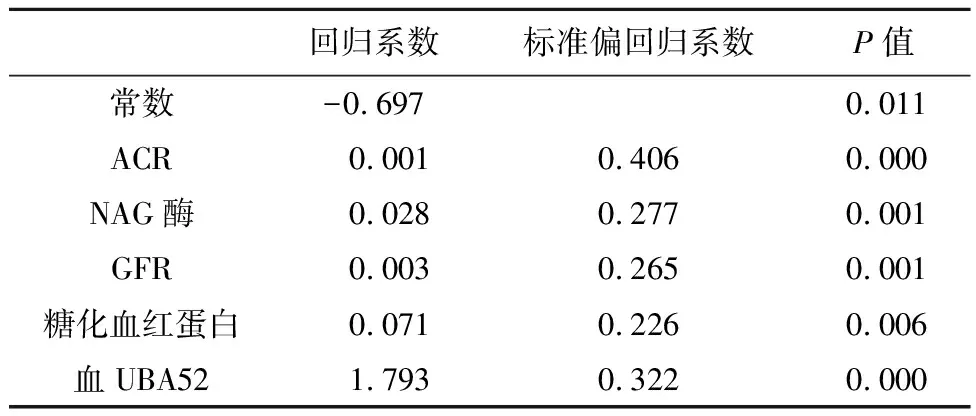
表3 逐步回归参数方程的参数估计
3 讨论
糖尿病肾病是引起终末期肾脏疾病(ESRD)最常见的原因,约占ESRD患者的40%~50%[6,10]。近年来随着蛋白质组学技术在生物医学领域的广泛应用,研究者已经开始利用蛋白质组学技术筛选能更早、更准确地预测或诊断DN病情进展与监测预后的生物标志物,其中泛素核糖体结合蛋白52(UBA52)是一种泛素核糖体结合蛋白。Dihazi等[11]研究糖尿病肾病及糖尿病合并其他肾病患者尿液蛋白质谱发现,糖尿病肾病患者尿液特异性表达质核比为14 766的蛋白质,并提出该蛋白可作为糖尿病肾病诊断性尿蛋白,后证实该蛋白为泛素-核糖体融合蛋白52(UBA52),是游离泛素分子的前体[12]。糖尿病肾病可以通过高糖和各种应激反应激活相应增强子,加强转录,表达UBA52[13-14]。在泛素水解酶的作用下可水解释放大量游离泛素分子维系泛素-蛋白酶体途径(ubiquitin-ptoteasome path,UPP)的活性[15]。
早在1999年,首次克隆出了鼠UBA52基因(GenBank AF118402)[16],并通过削减杂交方法发现DN肾组织中UBA52表达增高;2002年用原位杂交技术和免疫组化技术进一步确定UBA52表达在肾小管,且证实与DN进展密切相关[14]。近年来许多研究证明肾小管损伤在DKD发生、发展中起着重要作用。DKD肾小管损伤的主要病理表现是小管细胞增生、肥大、萎缩、凋亡、转分化等改变,同时小管周围有炎性细胞浸润及不同程度小管间质纤维化,国内外新近的大量研究提示,UPP参与了糖尿病肾病肾脏纤维化多条信号通路中重要的蛋白分子,引起信号通路的过度持久活化,对肾小球系膜细胞凋亡、抗原提呈、炎症演进和基因转录等多方面进行上调或下调,并促进肾脏纤维化,在糖尿病肾病的进展中起到重要作用。本研究的检测结果也证实了血、尿UBA52在早期糖尿病肾病诊断中的优势所在,糖尿病组和糖尿病肾病组NAG酶、α1微球蛋白较正常对照组升高,但糖尿病组与糖尿病肾脏病组无明显差异,说明无论在糖尿病或糖尿病肾病组中,早期均有肾小管的受损,且以上指标尚受炎症、创伤的影响,虽敏感,但不特异。而检测的血、尿UBA52。仅在糖尿病肾病组中有显著升高,而糖尿病组和正常对照组血、尿UBA52无明显差异。本研究还发现,糖尿病肾病组尿UBA52较糖尿病组和正常对照组上升更加明显,提示尿UBA52可能是DN早期尿蛋白出现之前判断肾损害的有效生物标志,及时检测尿UBA52水平,可协助判定DN小管细胞损伤,且该项检查无创、简便。为进一步了解尿UBA52受何因素影响,本研究进一步以尿UBA52为因变量,其余指标为自变量行逐步多元线性回归,比较标准偏回归系数发现血UBA52、NAG酶、糖化血红蛋白及肾小球滤过率对尿UBA52的升高有影响。
综上所述,UBA52检测不仅可以反映早期肾脏损害及程度,同时有助于判断损害部位,且受NAG酶、糖化血红蛋白及肾小球滤过率的影响。因其在糖尿病肾病患者中特异性表达,可以提高诊断早期糖尿病肾病的特异度,重视并深入研究DKD小管细胞损伤的机制对防治DKD进展意义深远。
参考文献:
[1] Yang WY, Lu JM, Weng JP, et al. Prevalence of diabetes among men and women in China[J]. N Engl J Med, 2010, 362(12):1090-1101.
[2] Parving HH, Lewis JB, Ravid M, et al. Prevalence and risk factors for microalbuminuria in a referred cohort of type II diabetic patients:a global perspective[J]. Kidney Int, 2006, 69(11):2057-2063.
[3] Weiner DE. Watnick SG. The 2009 pmpesed rule for prospective ESRD payment:historical perspectives andpublic polices-bundle Up[J].Am J Kidney Dis, 2010, 55:217-222.
[4] Phillips AO, Steadman R. Diabetic nephropathy:the central role of renal proximal tubular cells in tubulointerstitial injury[J]. Histol Histopathol, 2002, 17(1):247-252.
[5] Tang SC, Leung JC, Lai KN. Diabetic tubulopathy:an emerging entity[J]. Contrib Nephrol, 2011, 170(170):124-134.
[6] Kanwar YS, Sun L, Xie P, et al. A glimpse of various pathogenetic mechanisms of diabetic nephropathy[J]. Annu Rev Pathol, 2011, 6(6):395-423.
[7] Najafian B, Kim Y, Crosson JT, et al. Atubular glomeruli and glomerulotubular junction abnormalities in diabetic nephropathy[J]. J Am Soc Nephrol, 2003, 14(4):908-917.
[8] Dalla VM, Saller A, Bortoloso E, et al. Structural involvement in type 1 and type 2 diabetic nephropathy[J].Diabetes Metab,2000,26:8-14.
[9] Caramori ML, Fioretto P, Mauer M. Enhancing the predictive value of urinary albumin for diabetic nephropathy[J]. J Am Soc Nephrol, 2006, 17(2):339-352.
[10] Lin S, Sabai A, Chugh SS, et al. High glucose stimulates synthesis of fibronectin via flnovel protein kinase C,Raplb,and B-Raf signaling pathway[J].J Biol Chem,2002,277:41725-41735.
[11] Dihazi H, Müller GA, Lindner S, et al. Characterization of diabetic nephropathy by urinary proteomic analysis:identification of a processed ubiquitin form as a differentially excreted protein in diabetic nephropathy patients[J]. Clin Chem, 2007, 53(9):1636-1645.
[12] Usami S, Takumi Y, Suzuki N, et al. The localization of proteins encoded by CRYM, KIAA1199, UBA52, COL9A3, and COL9A1, genes highly expressed in the cochlea[J]. Neuroscience, 2008, 154(1):22-28.
[13] Sun L, Pan X, Wada J, et al. Isolation and functional analysis of mouse UbA52 gene and its relevance to diabetic nephropathy[J]. J Biol Chem, 2002, 277(33):29953-29962.
[14] Wada J, Sun L, Kanwar YS. Discovery of genes related to diabetic nephropathy in various animal models by current techniques[J]. Contrib Nephrol, 2011, 169:161-174.
[15] Yin ST, Huang H, Zhang YH, et al. A fluorescence assay for elucidating the substrate specificities of deubiquitinating enzymes[J]. Biochem Biophys Res Commun,2011,416(1-2):76-79.
[16] Sun L, Wüthrich RP. Molecular identification of a murine ubiquitin/60S ribosomal fusion protein and expression study in mouse kidney[J]. Biochem Genet, 1999, 37(3/4):139-147.

