子宫内膜微腺体癌临床与病理组织学特征
李晓红, 卿 松,王玻玮, 刘 霞
(新疆医科大学第一附属医院1妇科, 2病理科, 乌鲁木齐 830054)
微腺体癌(microglandular adenocarcinoma,MGA)是子宫内膜黏液腺癌的一种变异类型。子宫内膜黏液腺癌在全部子宫内膜癌类型中所占比例不足10%[1],为一种少见肿瘤,而微腺体癌则是一种更加少见的肿瘤,其组织学形态同宫颈黏膜的微腺体增生(microglandular hyperplasia,MGH)具有较高的相似性,易造成混淆,尤其是对于内膜活检标本,更易造成误诊。虽然该肿瘤在国外早有文献报道[2],但国内未见相关报道。本研究通过观察子宫内膜微腺体癌的临床特点、免疫表型、诊治及预后,并复习相关文献,以提高对微腺体癌的诊断及鉴别诊断,帮助临床医师进行早期干预,提高患者生存期。
1 材料与方法
1.1材料收集2例子宫内膜微腺体癌患者的存档病理切片、蜡块。2例年龄分别为58岁及69岁,分别绝经20 a及16 a,临床均以阴道不规律流血就诊。超声检查2例均示内膜厚薄不一,最厚处为0.9 cm及1.0 cm,后者以宫腔偏左侧为主,余未见明显异常。2例均行宫腔镜内膜活检,均诊断为宫内膜微腺体癌,其中1例行全子宫加双侧附件切除术,术后2个月,未见明确转移或复发。采用10%中性福尔马林固定,石蜡包埋,每例选取有代表性蜡块1个,每块3 μm厚重新切片,分别行HE和免疫组化染色检测。
1.2免疫组织化学采用EnVision两步法,用CK、CEA、Vim、ER、PR、P16、CD10、Ki-67、CD34等抗体(购自北京中杉金桥生物技术有限公司)进行标记,操作中缓冲液用PBS,防脱片处理,抗原修复采用微波修复。细胞质或细胞核呈黄棕色为阳性染色。
1.3病理学诊断标准组织学诊断标准参照文献[3-4],免疫组化指标:上皮细胞P16核(+)[5],Vim弥漫(+)[4,6-7],间质细胞CD10(+)及CD34(-)[5]。
2 结果
2.1大体所见1例患者先行宫腔及宫角内膜活检,大小分别为0.2 cm×0.1 cm×0.1 cm及0.3 cm×0.2 cm×0.2 cm,均灰红,质软。后行全子宫及双侧附件切除术,全子宫大小10.0 cm×6.2 cm×3.5 cm,宫颈管长4.0 cm,宫颈表面光滑,切开,宫腔深4.5 cm,大部分内膜厚0.1~0.3 cm,近左宫角宫底处见一内膜增厚粗糙区,大小1.5 cm×1.5 cm×0.5 cm,灰红,质软。宫颈黏膜厚0.1 cm,灰红。另1例仅为宫内膜活检标本,大小为1.5 cm×1.0 cm×0.1 cm,灰红,质软。
2.2显微镜检查结果2例活检标本示大量形态不规则、紧密排列的小腺体呈外生乳头状生长,筛孔状或网格状,腺细胞呈立方状或柱状,胞浆中等,嗜酸性(图1)。细胞核形态较一致,圆形或椭圆形,染色质细,分布均匀,部分细胞核内可见多个嗜酸性小核仁,核呈轻度不典型。少量细胞浆内可见黏液(图2)。腺体间间质较少,以纤维性间质为主,仅见少许内膜样间质,并可见灶区分布的泡沫细胞,腺腔、上皮及间质内可见大量中性粒细胞,并见少量浆细胞及淋巴细胞(图3)。2例活检标本微腺体癌病变中均未见明确核分裂像,但其中1例除微腺体癌病灶外,可见小灶复杂性增生伴不典型增生的内膜病变(手术切除标本证实为高分化子宫内膜样腺癌),该病灶内共6个高倍视野,见4个核分裂像。其全子宫加双附件切除标本的内膜组织经充分取材后,镜下见微腺体癌病变,组织学形态同活检,但中性粒细胞浸润较轻。在微腺体癌病变周边见高分化子宫内膜样腺癌(1级)(图4、5),癌侵犯肌壁浅层,最深处约0.5 cm,余宫内膜呈萎缩改变。宫颈黏膜组织未见明显异常。2例免疫组化染色均显示CK(+)、CEA(-)(图6)、Vim(+)(图7)、ER(+)、PR少量(+)、P16核(+)(图8)、CD10间质细胞(+)(图9)、CD34间质细胞(-)、微腺体癌Ki-67 (10%+)(图10)。
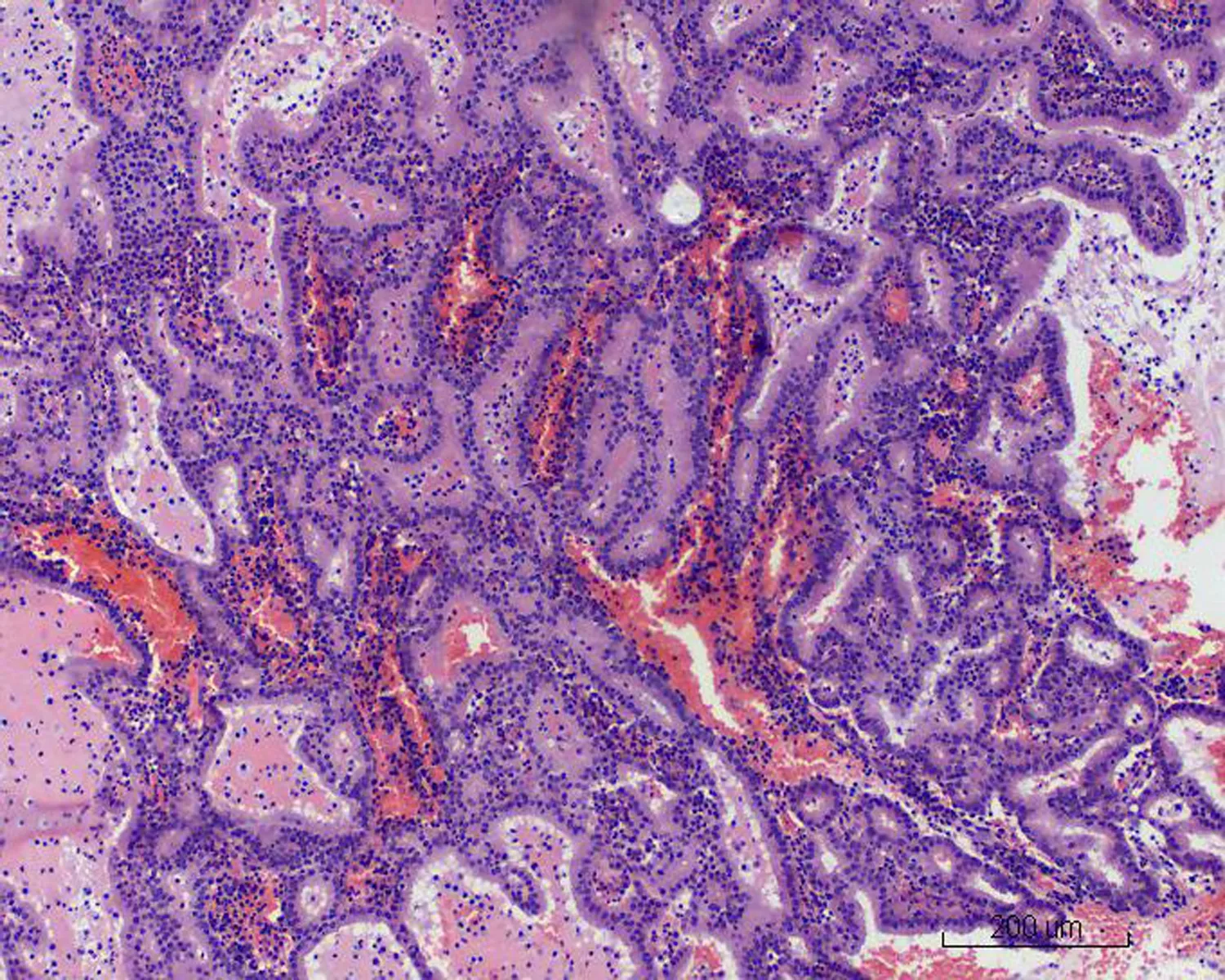
图1 MGA呈乳头状生长,由大量不规则小腺体构成 (HE ×10)
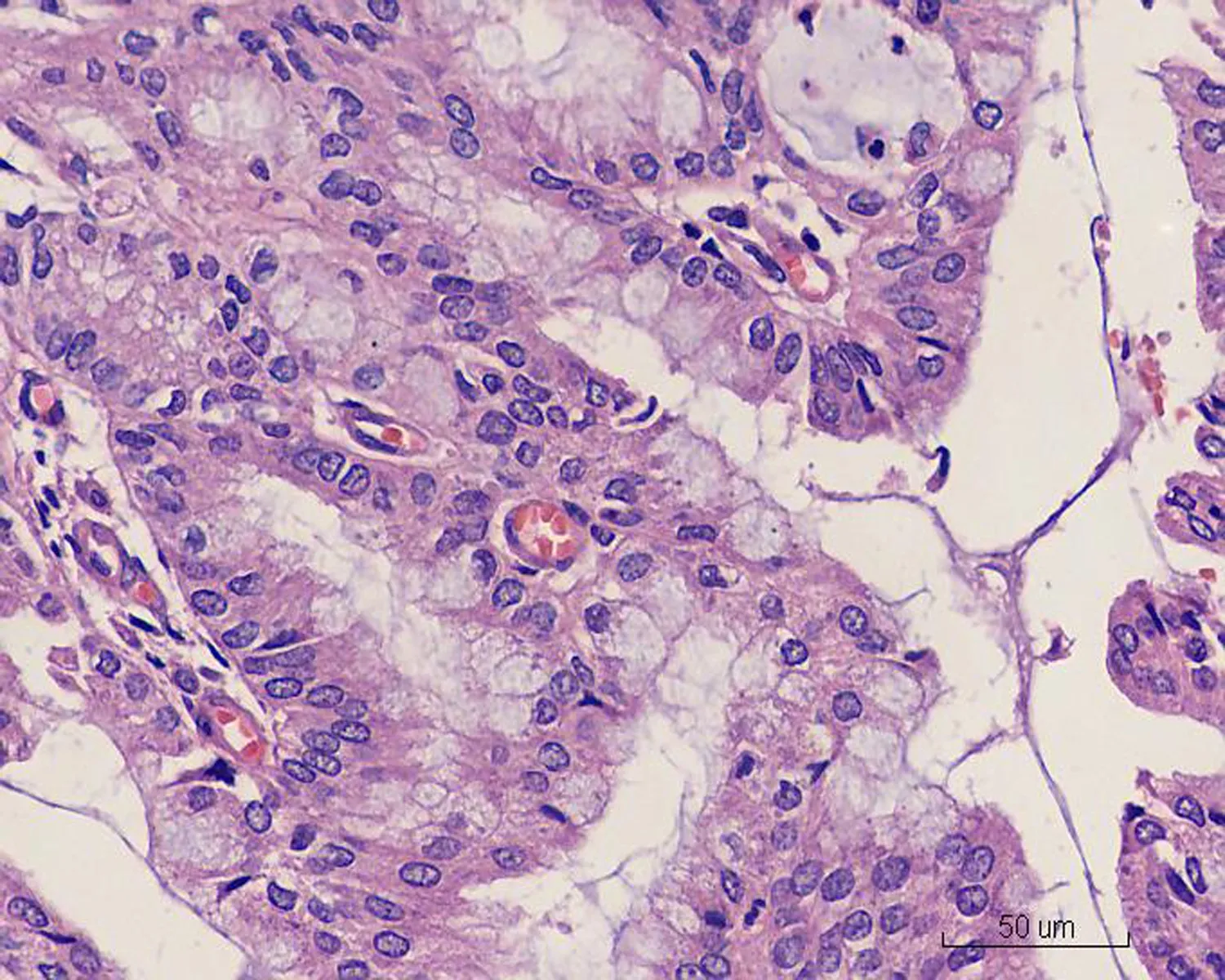
图2 MGA中细胞核呈轻度不典型,胞浆内可见黏液空泡(HE×40)

图3 间质内见灶状分布的泡沫细胞,并见大量中性粒细胞浸润(HE×40)
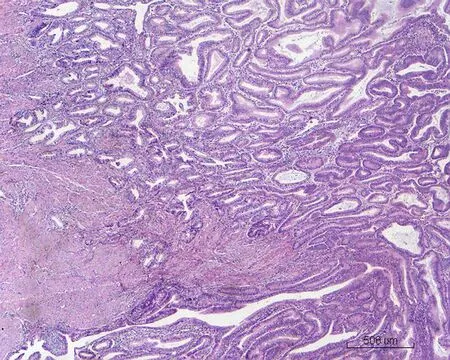
图4 高分化子宫内膜样腺癌(HE×4)

图5 MGA(右上部分)与高分化内膜样(HE×20)
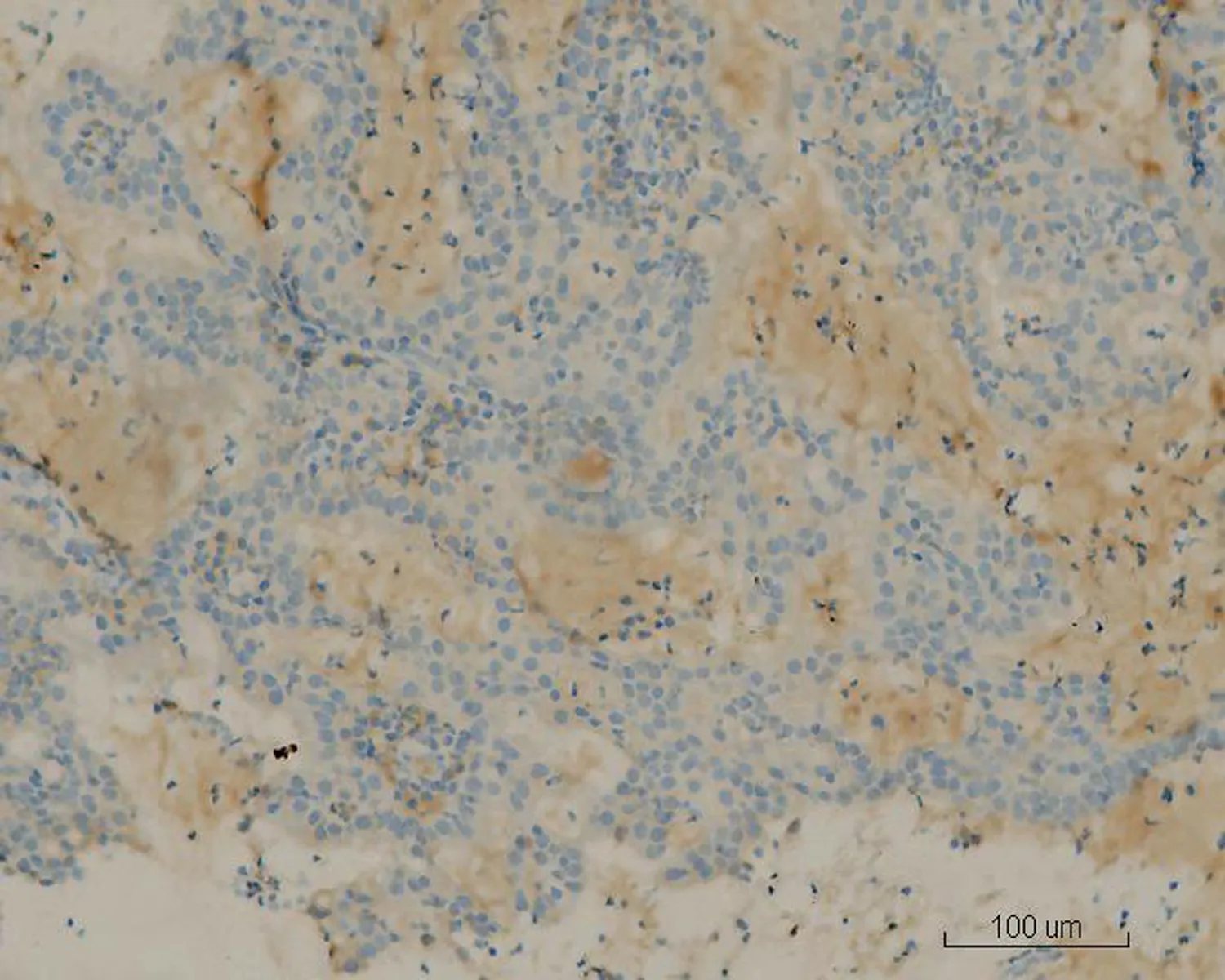
图6 MGA中细胞浆CEA(-)与腺癌(左下部分)并存 (HE×4)
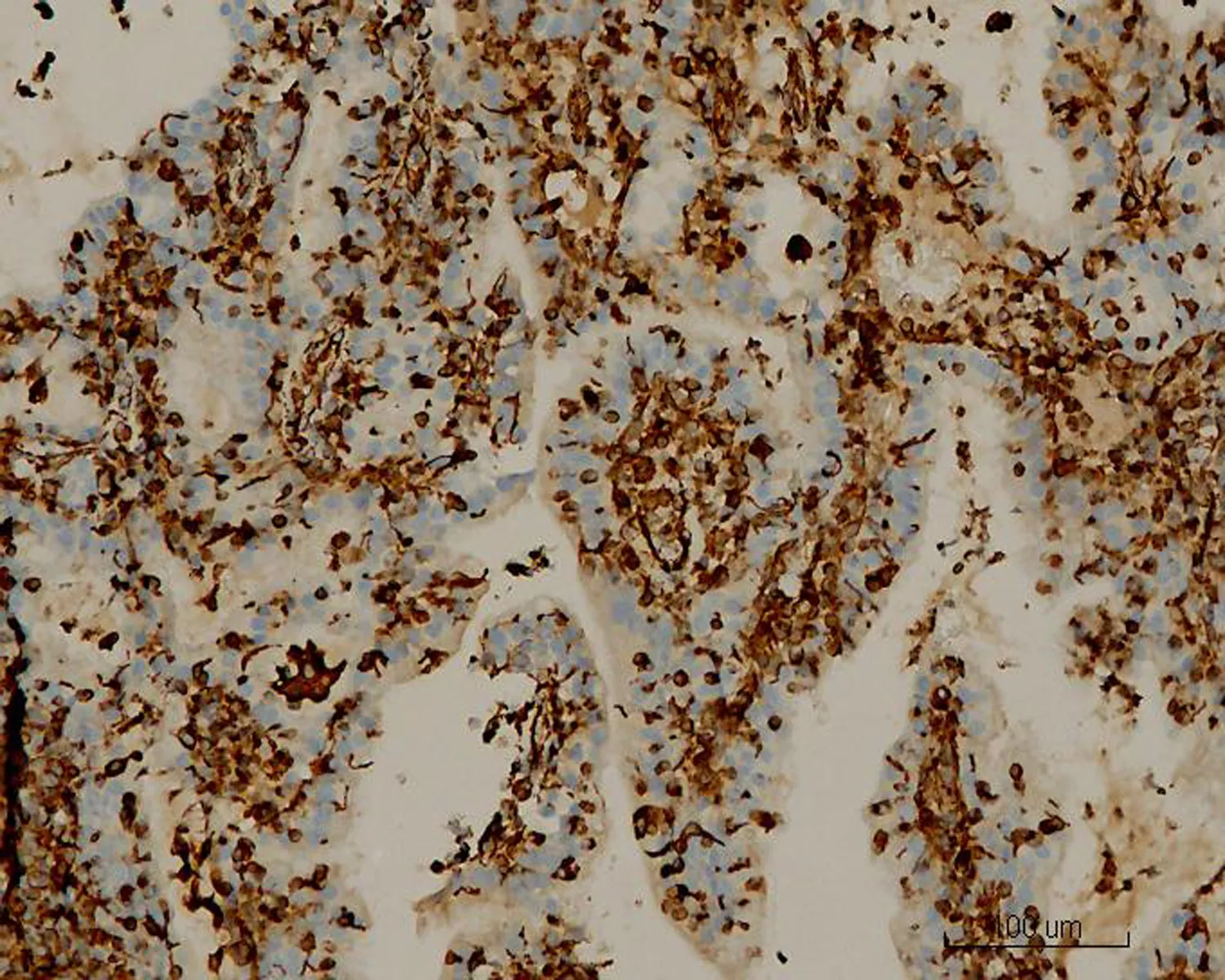
图7 MGA中细胞浆Vim弥漫强表达(HE×20)
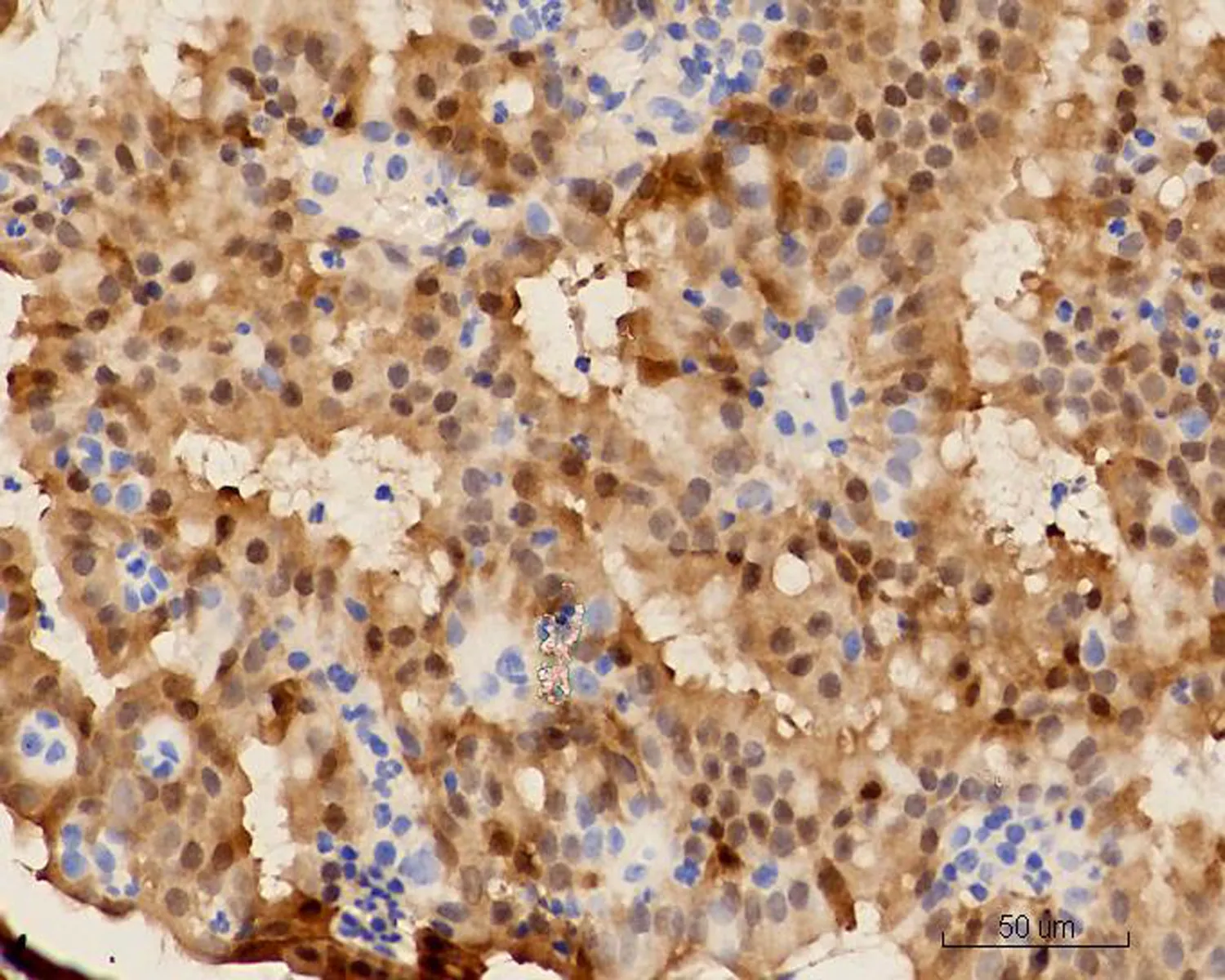
图8 MGA中P16核强阳性表达 (HE×20)
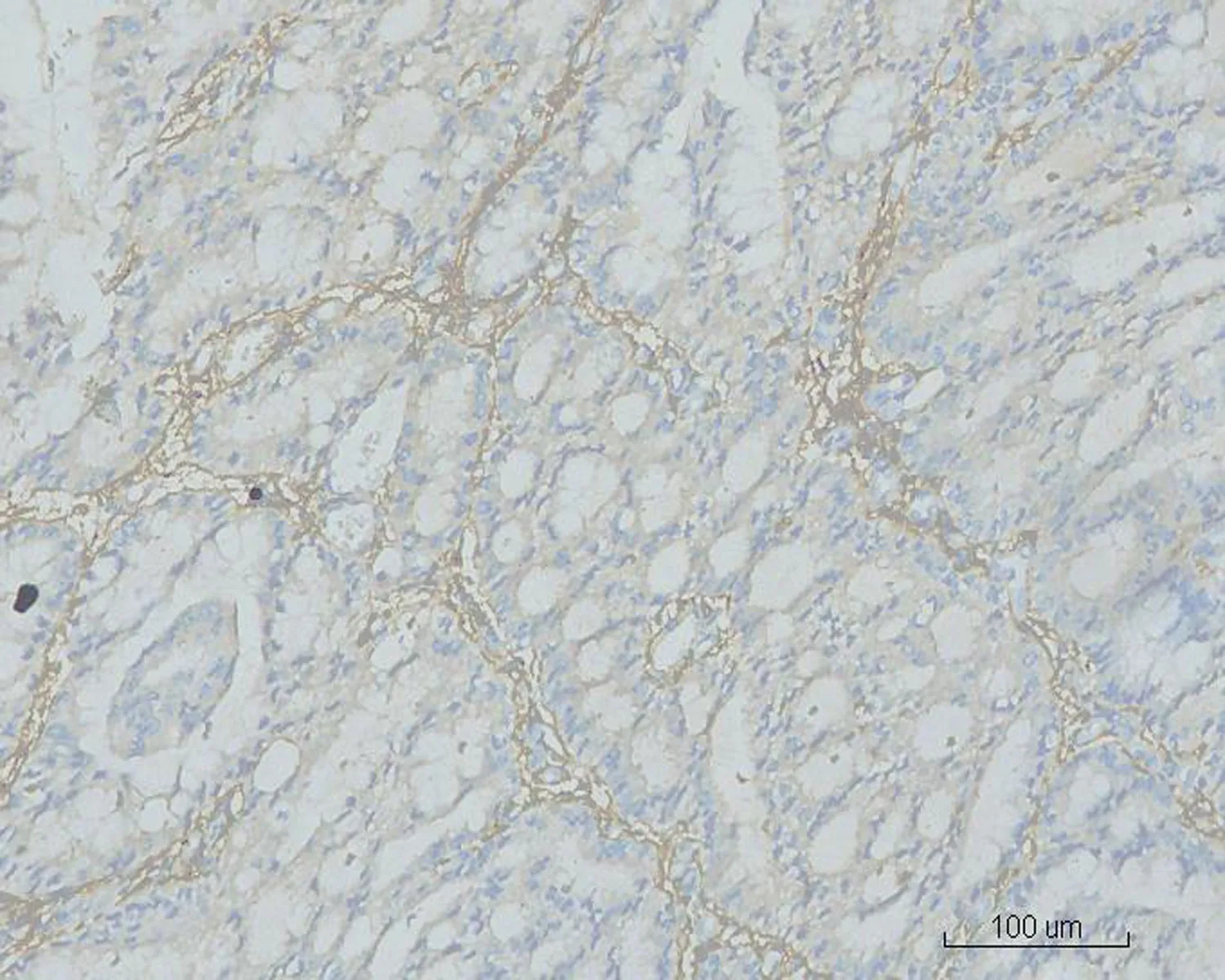
图9 MGA中间质细胞细胞浆CD10强阳性达 (HE×10)
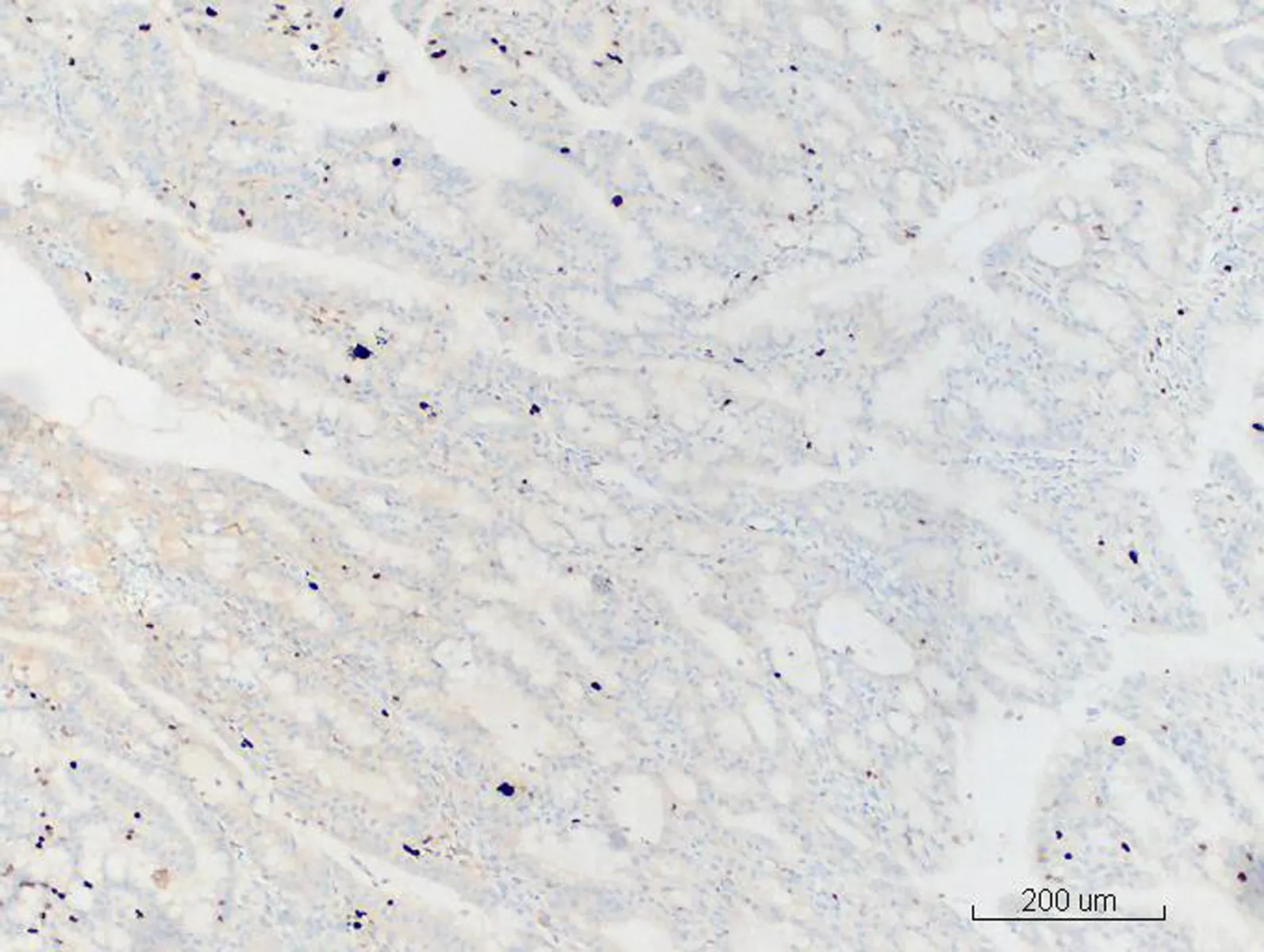
图10 MGA中核Ki-67强阳性表(HE×20)
3 讨论
MGA是一种少见的宫内膜黏膜腺癌,在诊断中易与宫颈的良性及恶性病变混淆。1992年Young等[2]报道了5例子宫内膜黏液腺癌和1例宫颈腺癌, 6例形态上均与MGH相似,故首次提出了MGA的概念。随后亦有相关文献报道提及子宫内膜的黏液腺癌及宫颈腺癌与MGH具有相似性。Zaloudek等[3]报道了2例MGA,最开始被误诊为MGH。Zamecnik等[4]、Karateke等[6]、McCluggage等[8]及Fukunaga等[9]、均报道了1例和MGH相似的MGA。由于该肿瘤少见,形态学较特殊,特别是对于内膜活检标本易误诊,延误患者及时治疗。
MGA多发生于已绝经的老年女性,临床表现为阴道异常分泌物或不规则流血,本组2例表现为阴道不规则流血,1例有激素治疗史。超声检查示内膜厚薄不一,局灶增厚,内回声不均。
组织学方面,MGA并非单一的癌,往往和子宫内膜样腺癌并存,而子宫内膜样腺癌通常都为高分化[1,3,6],两者在病变中所占比例不定。本组1例手术切除标本镜检显示为MGA和高分化子宫内膜样腺癌并存,浸润浅肌层,存在浸润的部分为高分化子宫内膜样腺癌,而MGA区域未见浸润,和Zaloudek等[3]、Zamecnic等[4]报道的镜下观察相同。本例MGA主要位于肿瘤的表面,这种现象也被Young等[2]、Zaloudek等[3]、Zamecnic等[4]、Karateke等[6]提到。在Zaloudek等[3]报道中,MGA占肿瘤的60%左右,而本例MGA占全部肿瘤的20%左右,表明MGA在不同病例中所占比例变化较大。对于MGA和子宫内膜样腺癌共存这种现象,与常规的子宫内膜样腺癌相比,MGA代表了一种分化更高、侵袭性更低的肿瘤[4]。MGA与周围子宫内膜样腺癌相比,核分裂像少见,本例MGA的核分裂像为1/10 HPF,而周围高分化子宫内膜样腺癌的核分裂像为5/10 HPF,与Zamecnic等[4]所述相似。在诊断和鉴别诊断中,免疫组化具有非常重要的作用。Chekmareva等[5]认为在MGA同宫颈良性上皮的鉴别中P16(+)可以作为重要的鉴别指标,而对于Vim的表达,Zamecnic等[4]与Chekmareva等[5]、Karateke等[6]、Qiu等[7]的观点有所不同,Chekmareva等[5]认为Vim具有较高的敏感性但特异性较差,不能作为鉴别指标,但也提到Vim在MGA中的表达要强于宫颈良性上皮的表达,Ki-67在癌中的表达要高于良性上皮的表达,可作为辅助指标。而CEA、ER、PR等在同宫颈良性上皮的鉴别中没有意义,同时间质细胞CD10及CD34的表达情况对鉴别也具有重要的作用。本组2例细胞核均表达P16,与Chekmareva等[5]所述一致,Vim在胞浆中呈弥漫阳性表达, Ki-67 (10%+)、CEA(-)、ER(+)、PR少量(+)、间质细胞CD10(+)、CD34(-)与相关文献表达相似[1,4-5,7]。
鉴别诊断:(1)宫颈微腺体增生(MGH)是一种良性病变,通常发生在宫颈管黏膜,一般认为同激素治疗或口服避孕药有关,但这种说法遭到质疑[10]。MGH是最需与MGA鉴别诊断的疾病。首先,从临床资料方面:MGH通常发生于年轻女性,很少发生于绝经老年女性,而MGA反之。超声检查示MGH位于宫颈,而MGA定位于宫腔。其次,从组织学形态上:MGH和MGA镜下很相似,但也有不同之处:①MGH细胞核的不典型性比MGA核的不典型性轻。②MGH的核分裂像通常<3个/10 HPF,而MGA的核分裂像通常>3个/10 HPF[7]。③MGH易见大量核下黏液空泡,而MGA更易见腺体鳞状化生及间质内泡沫细胞。免疫组织化学方面:①P16:MGH不表达,MGA弥漫或灶状表达。②Ki-67:MGH通常<5%,而MGA往往>5%[7]。③CD10:MGH间质细胞不表达而MGA间质细胞表达。④CD34:MGH间质细胞表达而MGA间质细胞不表达。(2)宫颈黏液腺癌:也可从临床、组织学形态及免疫组化与MGA鉴别。临床方面超声检查示肿瘤定位不同,MGA主要定位于宫内膜,而宫颈黏液腺癌主要定位于宫颈。组织学上,宫颈黏液腺癌的异型性比MGA明显并且核分裂像易见。免疫组化上,大多数宫颈黏液腺癌CEA(+)、Vim(-)、ER(-)、PR(-),而大多数宫内膜腺癌CEA(-)、Vim(+)、ER(+)、PR(+)。虽然MGA是一种低侵袭性肿瘤,但单纯的MGA少见,往往是和不同分化程度的子宫内膜腺癌合并存在,故其预后取决于后者,但从目前的相关研究来看,合并的子宫内膜腺癌以高分化为主,故行全子宫加双侧附件切除术,术后辅助放化疗,预后均较好。本组1例术后随访3个月未见复发。
MGA是一种少见的宫内膜黏液腺癌,特别是对送检量较少的内膜活检标本来说,诊断MGA更具有挑战性,故在诊断MGA时,必须结合临床资料、组织学形态及免疫组织化学结果,才能作出正确的诊断。
参考文献:
[1] Ross JC, Eifel PJ, Cox RS,et al. Primary mucinous adenocarcinoma of the endometrium. A clinicopathologic and histochemical study[J] .Am J Surg Pathol, 1983,7(8):715-729.
[2] Zaloudek C, Hayashi GM, Ryan IP, et al. Microglandularaden ocarcinoma of the endometrium: a form of mucinous adenocarcinoma that may be confused with microglandular hyperplasia of thecervix[J].Int J Gynecol Pathol, 1997,16(1):52-59.
[3] Zamecnic M, Skalova A, Opatrny V. Microglandular adenocarcinoma ofthe uterus mimicking microglandular cervical hyperplasia[J].Ann Diagn Pathol ,2003,7(3):180-186.
[4] Karateke A, Haliloglu B, Atay V, et al. A case of microglandular adenocarcinoma of the endometrium[J].Gynecol Oncol.2005,99(3):778-781.
[5] Chekmareva M, Lora H, Ellenson LH, et al. Immunohistochemical differnces between mucinous and microglandular adenocarcinomas of the endometrium and benign endocervical epithelium[J]. Int J Gynecol Pathol, 2008,27(4):547-554.
[6] Young RH, Scully RE. Uterine carcinomas simulating microglandular hyperplasia A report of six cases[J]. Am J Surg Pathol,1992,16(11):1092-1097.
[7] Fukunaga M. Mucinous endometrial adenocarcinoma simulating microglandular hyperplasia of the cervix. Case report[J]. Pathol Int ,2000,50(7):541-545.
[8] McCluggage WG, Perenyei M. Microglandular adenocarcinoma of the Endometrium[J]. Histopathology, 2000,37(3):285-287.
[9] Greeley C, Schroeder S, Silverberg SG.Microglandular hyperplasia of the cervix: a true “pill” lesion?[J]. Int J Gynecol Pathol,1995,14(1):50-54.
[10] Qiu W, Mittal K.Comparison of morphologic and immunohistochemical features of cervical microglandular hyperplasia with low-grade mucinous adenocarcinoma of the endometrium[J].Int J Gynecol Pathol,2003,22(3):261-265.

