17-Demethoxy-reblastatin联合顺铂对三阴性乳腺癌细胞增殖和凋亡的影响
赵 晴,刘 浩,赵素容,张 配,董清清,蒋琛琛,吴成柱
(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽 蚌埠 233030)
17-Demethoxy-reblastatin联合顺铂对三阴性乳腺癌细胞增殖和凋亡的影响
赵 晴,刘 浩,赵素容,张 配,董清清,蒋琛琛,吴成柱
(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽 蚌埠 233030)
目的 观察17-Demethoxy-reblastatin(17-DR)联合顺铂(cisplatin,DDP)对三阴性乳腺癌 (triple-negative breast cancer,TNBC)细胞株MDA-MB-231增殖和凋亡的影响及其相关的分子机制。方法 用MTT法、集落克隆形成法检测药物对细胞增殖抑制的影响,流式细胞术检测药物作用后细胞的凋亡情况。结果 不同浓度17-DR或DDP对细胞增殖具有抑制作用,且二者联用时抑制作用增强。50 μmol·L-117-DR、8 μmol·L-1DDP及二者联用刺激24 h诱导细胞的凋亡率依次为14.7%、20.1%、45.2%。联合用药组Caspase-3的激活增强以及下调RIP1蛋白的表达。结论 17-DR作为热休克蛋白90(heat shock protein 90,Hsp90)抑制剂能够增强DDP对MDA-MB-231细胞增殖抑制和诱导凋亡的作用,其机制可能与下调Hsp90的顾客蛋白RIP1的表达相关。
Hsp90抑制剂;17-Demethoxy-reblastatin;顺铂;三阴性乳腺癌;凋亡
2006年 Bryan等首次明确提出雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体-2 (HER-2)均为阴性的乳腺癌为三阴性乳腺癌(triple-negative breast cancer,TNBC),这一定义已被广泛接受[1-2],已成为 乳腺癌 研究 的 新热 点 之 一。TNBC类患者约占全部乳腺癌的15%,发病年龄早,多见于绝经前女性,且早期易发生局部复发和远处转移,增殖指数高,无病生存时间和总生存时间均较短,目前国内外仍缺乏针对该特殊类型乳腺癌的规范化治疗指南[3]。TNBC的ER、PR和 HER-2表达缺失,所以无法针对这些靶点进行治疗。而且TNBC具有典型的分子遗传学特征,如BRCA1、EGFR、Eaveolin-1等基因分子突变或过度表达,这些异常有望成为今后 TNBC靶向治疗的靶点。Synta制药公司研发的一种热休克蛋白 90(heat shock protein 90,Hsp90)抑制剂Ganetespib(STA-9090)正处于治疗 TNBC的Ⅱ期临床研究[4]。
17-Demethoxy-reblastatin(17-DR)是在首个确证的Hsp90天然抑制剂格尔德霉素(geldanamycin,GA)的基础上,通过产 GA菌株的突变菌株采用微生物发酵技术提取分离得到,研究已经明确其为Hsp90 N末端抑制剂[5](图1)。Hsp90是分子伴侣中重要的一类,在癌基因蛋白的折叠、稳定及成熟等过程中发挥着重要的作用。Hsp90在细胞内以同型二聚体形式存在,每个亚单位都由3个结构域构成:N-端的 ATP酶域,与顾客蛋白结合的中间域及包含蛋白与蛋白间相互作用和二聚化修饰的 C-端域[6]。由于 Hsp90 N末端有一个高度保守的 ATP结合位点,Hsp90发挥作用的机制包括 ATP结合到其N端结构域及随后的 ATP水解,Hsp90的伴侣活性需要ATP在这一位点的结合和水解。在 ATP结合的状态下,Hsp90经过了构型的改变而变成成熟的复合体,这对发挥它对顾客蛋白的正确折叠及稳定作用必不可少。ATP水解产生 ADP使这些顾客蛋白的释放变得容易随后它们通过泛素蛋白酶体途径而降解[7]。
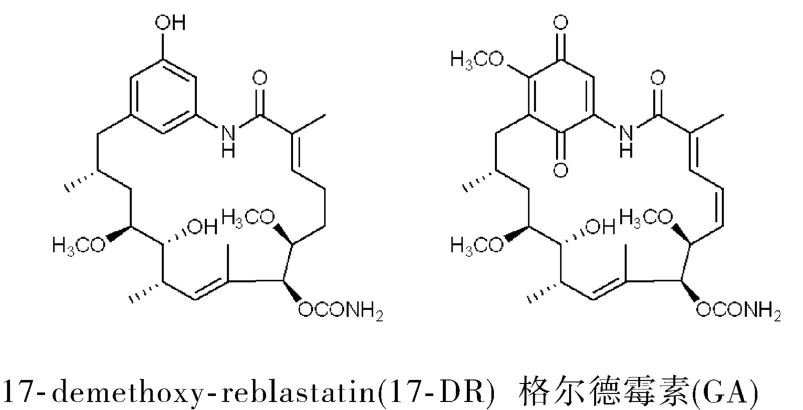
图1 17-DR和格尔德霉素的结构
Hsp90抑制剂通过抑制 Hsp90,可间接的调节癌基因蛋白从而发挥抗肿瘤作用,且 Hsp90抑制剂对癌细胞的作用相比正常细胞有显著的选择性[8]。临床前研究显示恶性乳腺癌组织相对于正常乳腺组织其细胞质、细胞核 Hsp90染色呈显著的高水平,同时 Hsp90 mRNA也呈高水平,另外高水平的Hsp90与乳腺癌患者的差预后也密切相关。
虽然TNBC对包括顺铂(cisplatin,DDP)在内的铂类等化疗药物较敏感但容易产生耐药[9],此外,研究显示 DDP对 Hsp90有很高的亲和力,DDP能结合到Hsp90的 C末端结构域并且抑制 Hsp90在C末端形成同源二聚体,导致 Hsp90蛋白的构象改变,并能特异性抑制 Hsp90介导的分子伴侣活性[10-11]。而17-DR以及 GA类化合物是结合到Hsp90的N末端结构域发挥其抑制作用,17-DR与DDP通过不同的机制抑制Hsp90介导的分子伴侣活性,理论上二者的联合应用将能够更大程度的抑制Hsp90。因此本研究以TNBC细胞株 MDA-MB-231细胞为研究对象,观察了 Hsp90抑制剂 17-DR联合DDP对乳腺癌细胞增殖及凋亡的影响,探究17-DR能否增强MDA-MB-231细胞对顺铂的敏感性,并初步探讨其机制。
1 材料与方法
1.1 细胞株 人乳腺癌 MDA-MB-231细胞,购于中科院上海细胞库。
1.2 主要试剂 DMEM培养基、胰蛋白酶:Gibco公司;胎牛血清:浙江四季青公司;MTT:Sigma公司;碘化丙啶(propidium iodide,PI):沃宏公司;兔抗人 Caspase-3抗体:abcam公司;兔抗人 BCL-2、BAX抗体:中杉金桥公司;兔抗人RIP1抗体及鼠抗人 β-actin抗体:Santa Cruz公司;17-DR:韩国生命工学研究院(KRIBB)的Dr.Hong,Young-Soo惠赠;DDP:山东齐鲁制药厂。
1.3 细胞培养 乳腺癌细胞 MDA-MB-231采用DMEM培养液,含 10%胎牛血清,3.7 g·L-1碳酸氢钠,1×105IU·L-1青霉素,100 mg·L-1链霉素,37℃、饱和湿度、5%CO2培养箱中培养。
1.4 MTT法检测细胞存活率 取处于对数生长期细胞,用0.25%胰蛋白酶消化制成单细胞悬液,调整细胞密度为 5×107·L-1,接种于 96孔细胞培养板,实验设调零组(培养液、MTT、DMSO)、空白对照组(细胞、培养液、MTT、DMSO)和药物处理组(细胞、培养液、药物、MTT、DMSO),每个组设5个复孔。每孔中加100 μL含5 000个细胞的培养液,在37℃、饱和湿度、5%CO2培养箱中培养使细胞贴壁。培养24 h之后,弃去每孔培养液,换新鲜含 10%胎
牛血清培养液,加药后 24、48、72 h(药物作用终点时间)终止培养,终止培养4 h,每孔加MTT 15 μL,4 h后弃去上清液,每孔加入 DMSO 100 μL,37℃孵育10 min,酶标仪上振荡5 min,用酶标仪检测波长570 nm处吸光度(A)值,计算细胞存活率/%:细胞存活率(%)=(实验组A值-调零组A值)/(对照组A 值-调零组 A值)×100%。以上实验重复3次。
1.5 集落克隆实验 用含 10%胎牛血清的 DMEM高糖培养基调整细胞浓度后,分别以每孔 1×104个细胞接种于6孔板中,24 h后吸弃培养液,5 μmol· L-117-DR、0.8 μmol·L-1DDP及两者合用处理细胞,并设对照组,置CO2孵箱中培养 8 d,观察到细胞集落形成后,去除培养基,预冷 PBS洗涤两遍,20%甲醇于-20℃固定10 min,结晶紫染色,ddH2O缓慢洗去染色液,室温下干燥,拍照观察集落的形成情况。
1.6 流式细胞仪检测细胞凋亡 将对数生长期的细胞制成单细胞悬液接种于 6孔细胞培养板,每孔1×105个细胞,培养24 h细胞贴壁后按照实验设计加入药物处理,继续培养24 h后收集细胞至 10 mL离心管,2 000 r·min-1,离心 10 min,去上清。用PBS洗涤一次并转移到 5 mL离心管,2 000 r· min-1,离心5~10 min,去上清,各管分别加入冰上预冷的75%乙醇1 mL固定,置于4℃冰箱过夜。第二天取出各管,2 000 r·min-1,离心5 min,去上清。各管分别加3 mL PBS重悬,2 000 r·min-1,离心5 min,去上清。各管分别加入 600 μL的 PI染液染色,室温,避光反应30 min,上流式细胞仪(Becton Dicknson C6)进行检测,以上实验重复 3次。检测具有亚G1期DNA含量的细胞比例,代表凋亡细胞数。
1.7 Western blot检测蛋白表达 收集稳定表达细胞用细胞裂解液(总体积200 mL:100 mmol·L-1Tris-HCl(pH 7.4)20 mL、1mol·L-1NaCl 28 mL、100 mmol·L-1CaCl21 mL、100 mmol·L-1MgCl221 mL、15 mmol·L-1NaN340 mL、Triton X-100 2 mL、用前加入蛋白酶抑制剂 12 mmol·L-1Leupeptin、1 mmol·L-1PMSF各2 mL·L-1)冰上裂解 30 min,提取细胞总蛋白,BCA蛋白定量法(参照试剂盒说明书操作)测各组蛋白浓度,用细胞裂解液将各组蛋白稀释至等浓度,与 2×上样缓冲液 1∶1混合,100℃煮沸5 min变性。取蛋白40 μg每组,10%或15%SDS-PAGE凝胶电泳(70 V,30 min,90 V,90 min);转膜以恒流50 mA,转移 2.5 h至 PVDF膜;5%脱脂牛奶室温封闭2 h(或4℃过夜);PBS洗净,孵一抗(1∶1 000),室温孵育2 h(或4℃过夜);TPBS洗涤3次,PBS洗涤1次;孵二抗(1∶2 000),室温孵育2 h;TPBS洗涤3次,PBS洗涤1次;ECL发光试剂盒暗室发光、显影、定影,Bio-Rad凝胶成像系统获取图像。
1.8 统计学方法 采用SPSS16.0软件。实验数据主要为计量数据,均行正态性检验,以均数 ±标准差(±s)表示。多组间比较为单因素方差分析,各组间比较用双侧Dunnett t检验。当 P<0.05时,差异有统计学意义。
2 结果
2.1 17-DR增强 DDP对乳腺癌细胞 MDA-MB-231增殖的抑制作用 实验中使用不同浓度的 17-DR、DDP单用及 DDP联合 17-DR刺激细胞,使用MTT法检测细胞存活率。结果表明(图2),不同浓度17-DR和 DDP单独处理对细胞均有一定的增殖抑制作用,17-DR和DDP作用细胞 72h的IC50分别为74.9、7.0 μmol·L-1。50 μmol·L-117-DR单用作用于细胞24、48、72 h的存活率分别为86.8%、76.2%、49.9%,8 μmol·L-1DDP单用作用于细胞24、48、72 h的存活率分别为79.7%、54.5%、37.3%,50 μmol·L-117-DR与不同浓度的 DDP联用对MDA-MB-231细胞的增殖抑制较 DDP单用时作用增强。在DDP浓度为8 μmol·L-1和17-DR浓度为50 μmol·L-1两者合用时,细胞24、48、72 h的存活率分别为46.3%、28.4%、25.4%,与单用组在相对应浓度及时间点数据比较均有显著性差异(P <0.05)。

图2 17-DR、DDP及17-DR与 DDP联用组对细胞的增殖抑制作用
2.2 17-DR增强 DDP对乳腺癌细胞 MDA-MB-231集落克隆形成的抑制作用 为进一步观察 17-DR对MDA-MB-231细胞增殖抑制作用及其对DDP抑制细胞增殖作用的影响,实验中根据 MTT实验结果使用低于IC50的 5 μmol·L-117-DR和/或 0.8 μmol·L-1DDP刺激细胞,用集落克隆形成实验检测药物对细胞增殖抑制作用的影响。结果表明,与对照组相比17-DR和 DDP单独处理组均能抑制细胞的集落克隆形成,并且二者联用时抑制作用增强(图3)。
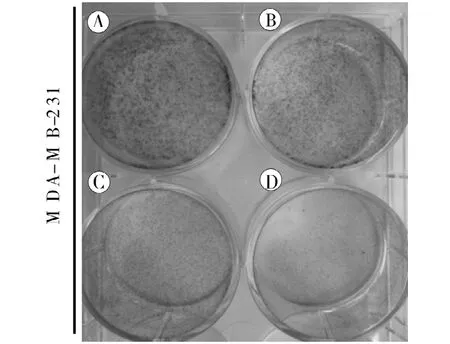
图3 17-DR和/或DDP对乳腺癌MDA-MB-231细胞集落克隆形成的抑制
2.3 17-DR增强DDP诱导乳腺癌细胞MDA-MB-231凋亡的作用 实验中使用 50 μmol·L-117-DR、8 μmol·L-1DDP及 50 μmol·L-117-DR与8 μmol·L-1DDP联用刺激诱导细胞24 h,随后对实验中不同因素处理的细胞按照操作进行 PI染色,通过流式细胞仪分析,观察两药单用或合用诱导细胞凋亡的作用,各组的凋亡率用对应Sub-G1期细胞所占的比例表示(图 4)。50 μmol·L-117-DR、8 μmol·L-1DDP处理组诱导细胞的凋亡率分别为14.7%、20.1%与阴性对照组 1.1%比较有显著性差异(P<0.05)。用50 μmol·L-117-DR和8 μmol ·L-1DDP联用组相同条件处理,诱导 MDA-MB-231细胞的凋亡率增加到45.2%与对照组比较有显著性差异(P<0.05)。
2.4 17-DR增强 DDP诱导 MDA-MB-231细胞Caspase-3蛋白的激活 实验结果表明:17-DR刺激细胞后,并未出现明显的 Caspase-3的激活,但 17-DR对 DDP诱导 MDA-MB-231细胞 Caspase-3的激活具有增强作用,Caspase-3蛋白裂解片段愈加明显(图5A)。
2.5 17-DR和/或 DDP处理对细胞 BAX、BCL-2及 RIP1蛋白表达的影响 细胞经各处理组作用24 h后,Western blot结果显示,促凋亡蛋白 BAX的表达为联合用药组高于单独用药组,抑凋亡蛋白 BCL-2的表达为联合用药组低于单独用药组。同时 17-DR可下调细胞RIP1的表达,DDP也能使 RIP1表达下调且二者合用组RIP1下调更明显(图5B)。细胞依次经control组,17-DR组(50 μmol·L-1),DDP组(8 μmol·L-1),DDP(8 μmol·L-1)与17-DR(50 μmol·L-1)联用组处理。图5C中 a、b、c依次为BAX、BCL-2和 RIP1蛋白的表达灰度值统计结果。*P<0.05 vs control组。

图4 17-DR增强DDP诱导MDA-MB-231细胞凋亡的敏感性注:A.control组;B、C、D:17-DR组(50 μmol·L-1),DDP组(8 μmol·L-1),DDP(8 μmol·L-1)与 17-DR(50 μmol· L-1)联用组。
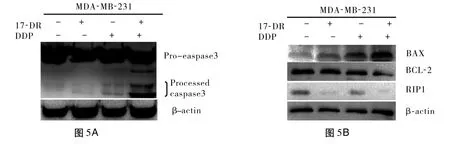

图5 MDA-MB-231细胞Caspase-3、BAX、BCL-2和RIP1蛋白的表达情况及BAX、BCL-2和RIP1蛋白的表达灰度值统计
3 讨论
目前已有多种 Hsp90抑制剂进入治疗乳腺癌临床试验阶段[12],另有多个 Hsp90抑制剂在临床前乳腺癌研究中也显示出较好的作用,通过高通量筛选发现的一种新型的口服 Hsp90抑制剂 PF-4942847,在多个TNBC细胞株及异种移植模型的体外和体内试验中,显示了显著的抗肿瘤活性[13]。Hsp90抑制剂用于治疗包括TNBC在内的乳腺癌具有良好的应用前景。GA能够与ATP竞争结合Hsp90 N末端而使 Hsp90的顾客蛋白不能受到处于关闭状态的 Hsp90二聚体的保护,继而通过泛素蛋白酶体途径降解。虽然,GA具有较好的抗癌活性,但由于GA水溶性差,肝毒性强,使其在临床应用上受到了很大限制。因此,开发水溶性更好、毒副作用更低的GA衍生物成了 GA开发研究的主要方向。微生物因代谢产物丰富而成为了目前研究Hsp90抑制剂的主要来源,17-DR通过组合生物合成技术针对引发肝毒性结构,即苯醌结构进行结构改造,制备得到的具有非苯醌结构的GA衍生物[5]。肿瘤细胞中大多数与逃避细胞凋亡及对生长抑制信号失去敏感性有关的蛋白的稳定性依赖于Hsp90,Hsp90可以调控多种信号通路网络上的蛋白的折叠,在肿瘤的发展和恶化中扮演着重要的角色。以 Hsp90为靶点的大多数药物比选择性的致癌基因通路抑制剂具有更大的优势,因此以整个信号通路网络而不是单一的信号通路为靶向的药物设计,可能会解决这一问题。
DDP是具有细胞毒性的细胞周期非特异性药物,是目前最常用的抗肿瘤药物之一,它物美价廉,治疗效果良好,临床中主要以静脉注射和腹腔用药的治疗效果最为明显,其主要作用部位在DNA的嘌呤和嘧啶碱基,可抑制癌细胞的DNA复制过程,并损伤其细胞膜上结构,有较强的广谱抗癌作用,骨髓抑制作用较轻,在多种实体瘤的治疗中 DDP是有效的抗肿瘤药,但是能够导致肾毒性。研究表明Hsp90抑制剂 PU-H71和 DDP二者联用下,能够极大增强对 PU-H71抵抗癌细胞株对诱导的凋亡的敏感性[14]。但是DDP又是一种由浓度决定其治疗效果的抗肿瘤药物,在短时间内,每次给药的浓度越高,效果也越好,但随着用药量的增加,出现的不良反应亦相应的增加。因此,本实验使用低浓度 DDP单用或与17-DR合用诱导细胞24 h为主,亦是基于以上原因,从而使实验研究与临床的治疗联系更加密切。
RIP1为丝氨酸/苏氨酸蛋白激酶,是一种重要的细胞信号转导分子。它不仅参与了细胞的凋亡,还参与了细胞存活、细胞程序性坏死等多种信号的转导并在其中起关键作用,其功能受泛素化、锌指蛋白及Hsp等的调节。
本课题组Huang等[15]的研究已经表明在乳腺癌中己糖激酶抑制剂2-脱氧-D-葡萄糖(2-DG)可以通过下调RIP1增加TRAIL诱导的凋亡,从而达到抑制 TNBC细胞的作用,显示RIP1在乳腺癌中起重要的作用。
RIP1蛋白已经明确为 Hsp90的顾客蛋白,RIP1在多个组织内表达,是各种膜整合细胞内外应力信号必需的传感蛋白,它除了能激活 NF-κB对抗凋亡外,还可以诱导细胞死亡,包括凋亡和非Caspase依赖的坏死[16]。Hsp90可以与 RIP1结合,是 RIP1发挥作用的辅助分子。Hsp90的功能抑制剂 GA会导致RIP1的降解,随后抑制了 TNF诱导的 NF-κB激活,使细胞对TNF诱导的凋亡更加敏感。用 GA的类似物17-DMAG处理乳腺癌细胞,细胞内 RIP1的表达下降,细胞对 TRAIL诱导的细胞凋亡更加敏感,表明Hsp90在维持 RIP1的稳定性和可溶性方面发挥着重要作用[17-18]。实验结果显示在 MDAMB-231细胞中RIP1蛋白高表达,17-DR能下调细胞RIP1蛋白的表达,可能通过减少NF-κB激活的途径来促进细胞凋亡。
本研究结果显示 17-DR能增强 DDP对 MDAMB-231细胞的增殖抑制作用,同时17-DR增强DDP对 MDA-MB-231细胞集落克隆形成的抑制作用,17-DR也增强DDP诱导MDA-MB-231细胞凋亡的作用。其机制可能是通过下调Hsp90的顾客蛋白RIP1,以及17-DR增强DDP诱导MDA-MB-231细胞Caspase-3蛋白的激活,导致抑凋亡蛋白BCL-2的表达下调,同时使促凋亡蛋白BAX的表达增加相关。Caspase-3是细胞凋亡的主要执行者,其激活的增强也表明17-DR和 DDP在相应作用浓度下二者联用是有效的。另外 BAX过度表达时细胞凋亡增多,而BCL-2过度表达时,其产物可与 BAX结合,从而抑制了凋亡[19]。RIP1作为细胞死亡受体介导的凋亡途径中重要的上游信号蛋白,对其表达水平的改变在一定程度上参与了细胞凋亡的调控。17-DR增强 DDP抗肿瘤作用机制比较复杂,是否还有其它作用机制参与,有待进一步研究。且本实验中仅选用了体外培养的细胞株进行观察,进一步的体内外药效及机制研究有待深入。
[1] Hyslop T,Michael Y,Avery T,et al.Population and target considerations for triple-negative breast cancer clinical trials[J].Biomark Med,2013,7(1):11-21.
[2] Den Hollander P,Savage MI,Brown PH.Targeted Therapy for Breast Cancer Prevention[J].Front Oncol,2013,3:250.
[3] Loi S,Pommey S,Haibe-Kains B,et al.CD73 promotes anthracycline resistance and poor prognosis in triple negative breast cancer[J].Proc Natl Acad Sci USA,2013,110(27):11091-11096.
[4] Shastry M,Yardley DA.Updates in the treatment of basal/triplenegative breast cancer[J].Curr Opin Obstet Gynecol,2013,25 (1):40-48.
[5] Wu CZ,Jang JH,Ahn JS,et al.New geldanamycin analogs from Streptomyces hygroscopicus[J].J Microbiol Biotechnol,2012,22(11):1478-1481.
[6] Jackson SE.Hsp90:Structure and Function[J].Top Curr Chem,2013,328:155-240.
[7] Li J,Buchner J.Structure,Function and Regulation of the Hsp90 Machinery[J].Biomed J,2013,36(3):106-117.
[8] Kim LS,Kim JH.Heat Shock Protein as Molecular Targets for Breast Cancer Therapeutics[J].J Breast Cancer,2011,14(3):167-174.
[9] Eckstein N,Haas B.Platinum-based chemotherapy in triple negative breast cancer[J].Dtsch Med Wochenschr,2012,137(7):333 -336.
[10]孟 帅,山广志,李卓荣.Hsp90抑制剂的研究进展[J].中国抗生素杂志,2011,36(4):241-248.
[11]Wang G,Ye Y,Yang X,et al.Expression-based in silico screening of candidate therapeutic compounds for lung adenocarcinoma [J].PLoS One,2011,6(1):e14573.
[12]Travers J,Sharp S,Workman P.HSP90 inhibition:two-pronged exploitation of cancer dependencies[J].Drug Discov Today,2012,17(5/6):242-252.
[13]Mehta PP,Whalen P,Baxi SM,et al.Effective targeting of triplenegative breast cancer cells by PF-4942847,a novel oral inhibitor of Hsp 90[J].Clin Cancer Res,2011,17(16):5432-5442.
[14]Gallerne C,Prola A,Lemaire C,et al.Hsp90 inhibition by PU-H71 induces apoptosis through endoplasmic reticulum stress and mitochondrial pathway in cancer cells and overcomes the resistance conferred by Bcl-2[J].Biochim Biophys Acta,2013,1833(6):1356-1366.
[15]Huang YY,Liu H,Li Y,et al.Down-regulation of RIP1 by 2-deoxy-D-glucose sensitizes breast cancer cells to TRAIL-induced apoptosis[J].Eur J Pharmacol,2013,705(1/3):26-34.
[16]Bai L,Xu S,Chen W,et al.Blocking NF-κB and Akt by Hsp90 inhibition sensitizes Smac mimetic compound 3-induced extrinsic apoptosis pathway and results in synergistic cancer cell death[J].Apoptosis,2011,16(1):45-54.
[17]Carmen P,Ana IP,Abelardo LR.Down-regulation of RIP expression by 17-dimethylaminoethylamino-17-demethoxygeldanamycin promotes TRAIL-induced apoptosis in breast tumor cells[J].Cancer Lett,2010,287(2):207-215.
[18]李 莉,闫 言.受体相互作用蛋白激酶RIP1在细胞信号传导途径中作用的研究进展[J].基础医学与临床,2011,31 (10):1165-1167.
[19]王上伟,刘 宁,韩坤元.斑蝥酸钠对胃癌 SGC-7901细胞增殖的影响及其机制的研究[J].安徽医药,2013,17(4):558-560.
《安徽医药》2012年影响因子为1.045,在全国117家医药综合类期刊中名列第5位,创历史新高(数据由2013年版中国科技期刊引证报告扩刊版提供)。
《安徽医药》编辑部
Effects of 17-Demethoxy-reblastatin combined with cisplatin on proliferation and apoptosis of triple-negative breast cancer cell line
ZHAO Qing,LIU Hao,ZHAO Su-rong,et al
(Faculty of Pharmacy,Bengbu Medical College;Anhui Engineering Technology Research Center of Biochemical Pharmaceuticals,Bengbu,Anhui 233030,China)
Objective To investigate the effects of 17-Demethoxy-reblastatin(17-DR)combined with cisplatin(DDP)on the proliferation and apoptosis of triple negative breast cancer MDA-MB-231 cell line,and to explore the molecular mechanisms underlying.Methods The inhibition of cell proliferation was examined using MTT assay and colony formation assay,and the apoptosis analyzed using flow cytometry.Results Treatment with 17-DR or DDP inhibited the proliferation of the cell,and the cell viability in the combined treatment group was lower than 17-DR or DDP group alone.The apoptosis rates were 14.7%,20.1%,and 45.2%following treatment with 50 μmol·L-117-DR,8μmol·L-1DDP and combined treatment for 24 h,respectively.The combined treatment enhanced the activition of Caspase-3,and down-regulated the expression of RIP1.Conclusions As a heat shock protein 90(Hsp90)inhibitor,17-DR,could enhance DDP-induced cell death.The underlying mechanism may relate to down-regulating the expression of Hsp90 client protein RIP1.
heat shock protein 90 inhibitor;17-Demethoxy-reblastatin;cisplatin;triple-negative breast cancer;apoptosis
10.3969/j.issn.1009-6469.2014.03.007
国家自然科学基金面上项目(No 81372899);国家自然科学基金青年科学基金项目(No 81302671);安徽省青年科学基金项目(No 1408085QH162);蚌埠医学院科技发展基金重点项目(No BYKF12A03)
赵 晴,男,硕士研究生
刘 浩,男,教授,硕士生导师,研究方向:生化药理,E-mail:liuhao6886@foxmail.com
2013-09-20,
2013-11-19)

