红球菌CCZU10-1选择性氧化拆分外消旋苯甲亚砜的性能
杨振兴,陶志成,何玉财,王利群,张跃,邢震,龚磊,潘雪鹤
(常州大学制药与生命科学学院生物工程研究室,江苏 常州 213164)
红球菌CCZU10-1选择性氧化拆分外消旋苯甲亚砜的性能
杨振兴,陶志成,何玉财,王利群,张跃,邢震,龚磊,潘雪鹤
(常州大学制药与生命科学学院生物工程研究室,江苏 常州 213164)
为了高效地合成高光学纯手性亚砜,在单水相体系中利用Rhodococcussp. CCZU10-1选择性氧化拆分外消旋苯甲亚砜(rac-PMSO)合成了(S)-PMSO(ee>99.9%)。通过考察反应pH值、反应温度、摇床转速、辅助底物、生物催化剂添加量对催化反应的影响,确定了最适反应条件。结果表明最适反应条件为:反应pH值8.0、反应温度30℃、摇床转速180r/min、辅助底物为半乳糖(50mmol/L)、细胞浓度为0.08g(湿重)/mL。在最适反应条件下生物转化20mmol/L rac-PMSO时,(R)-PMSO完全转化,(S)-PMSO(ee>99.9%)产率为47.1%。因此,研究结果为工业化生产(S)-PMSO奠定了基础。
红球菌属;(S)-苯甲亚砜;拆分;生物转化;优化
光学纯手性亚砜是一种重要的药物中间体和手性助剂[1],可通过不对称氧化前手性硫化物或者不对称氧化拆分外消旋亚砜获得[2]。不对称氧化硫化物可通过金属催化剂或纯化酶催化进行[3],也可用整细胞催化进行[4]。相比之下,用整细胞系统催化不对称氧化硫化物具有更多的优点,可避免手性金属配合物和纯化酶的使用,因此更有发展前途和应用前景。虽然利用整细胞氧化拆分外消旋亚砜合成光学纯亚砜的最大理论产率仅为50%,但是其砜类产物也是非常有用的药物(例如多菲莱德、舒多昔康、烟嘧磺隆等)中间体[5-6]。到目前为止,少有报道利用整细胞氧化拆分外消旋亚砜高效制备高光学纯亚砜的研究。利用黑曲霉[7]不对称氧化拆分外消旋亚砜时,ee较低(<50%);利用Rhodococcussp.ECU0066[8]不对称氧化拆分外消旋亚砜时,(S)-PMSO产率较低 (<45%)。因此,利用整细胞氧化拆分外消旋亚砜制备光学纯亚砜仍有上升发展空间。
最近,作者利用Rhodococcussp. CCZU10-1进行氧化拆分rac-PMSO,通过对反应pH值、反应温度、摇床转速、辅助底物等参数进行了优化,实现了高光学纯(S)-PMSO (ee>99%,产率47.1%)的高效合成。
1 实验材料与方法
1.1 试剂和药品
外消旋苯甲亚砜和苯甲砜购自上海隆盛化工有限公司,分析纯;蛋白胨和酵母膏购自国药集团化学试剂有限公司,生化级;其他试剂均为国产分析级。
1.2 主要仪器
Agilent 1260高效液相色谱仪;R2ID旋转蒸发仪,巩义市予化仪器制造有限公司;THZ-072 HT恒温摇床,上海博彩生物科技有限公司。立式压力蒸汽灭菌器LDZX-50KBS上海申安医疗器械厂;离心机TGL-16G上海安亭科学仪器厂。
1.3 菌株
Rhodococcussp. CCZU10-1[9],作者实验室筛选获得。
1.4 培养
首先在250mL摇瓶装液50mL培养基培养红球菌24h。培养温度为30℃,培养的转速为180r/min,培养基的成分为:葡萄糖10g/L,酵母膏5g/L,蛋白胨10g/L,NaCl 1.5g/L,KH2PO42g/L,无水MgSO40.3g/L,pH值7.0。培养24h,加入诱导剂rac-PMSO(终浓度为0.1mmol/L),继续培养24h后离心(10000g,5min)收获细胞,然后重悬浮于K2HPO4-KH2PO4(100mmol/L,pH值8.0)缓冲溶液待用。
1.5 rac-苯甲亚砜的氧化反应
在单水相体系,氧化拆分外消旋苯甲亚砜是在10mL带塞的摇瓶中进行的。收获的静息细胞Rhodococcussp. CCZU10-1(0.16g湿菌)重悬于2mL K2HPO4-KH2PO4缓冲溶液(100mmol/L,pH值8.0)。20mmol/L外消旋苯甲亚砜在红球菌作用下,进行选择性氧化拆分反应(30℃和180r/min)。反应结束后,利用等体积乙酸乙酯萃取反应体系3次,萃取液进一步利用无水硫酸钠干燥过夜,减压浓缩至干,2mL乙醇重新溶解后,分析(S)-PMSO的产率和(S)-PMSO的对映体过量值(ee)。
1.6 分析方法
液相色谱(HPLC)检测法:(S)-PMSO的产率和ee值的测定是通过Daicel的OD-H柱测定。
检测条件:Chiracel OD-H柱(4.6mm×250mm,5 μm),正己烷∶异丙醇=93∶7(体积比),流速为1mL/min,检测波长254nm。(R)-PMSO、苯甲砜和(S)-PMSO的出峰时间分别为20min、24min和26min。
产物的产率(Yield)和对映体过量值(ee)计算方法如式(1)和式(2)。
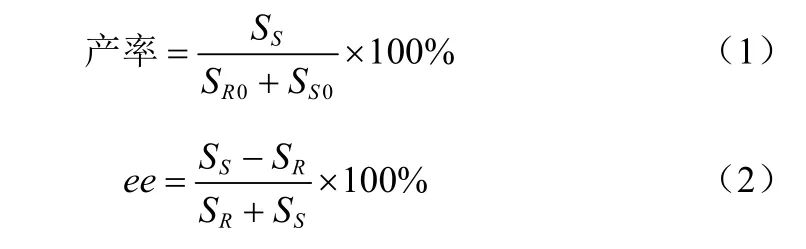
式中,SR0和SS0分别表示反应前(R)-PMSO和(S)-PMSO的初始浓度;SR和SS分别表示(R)-PMSO和(S)-PMSO的浓度。
2 实验结果与分析
2.1 反应pH值对氧化PMSO的影响
反应pH值对生物催化反应有着明显的影响,不同反应pH值使底物和生物催化剂的反应所处环境和状态不同,导致pH值影响生物催化剂的活性[10-11]。如图1所示,反应pH值(5.0~10.0)对Rhodococcussp. CCZU10-1氧化PMSO活性有着明显的影响。在pH值8.0时,催化活性达到最大值。因此,最适反应pH值为8.0。
2.2 反应温度对氧化PMSO的影响
反应温度也对催化活性[12-13]有明显的影响。如图2所示,不同反应温度(25~45℃)对Rhodococcussp. CCZU10-1氧化PMSO的影响比较显著。当温度为30℃时,催化活性达到最大值。继续提高反应温度,催化活性明显下降。因此,30℃为Rhodococcussp. CCZU10-1最适反应温度。
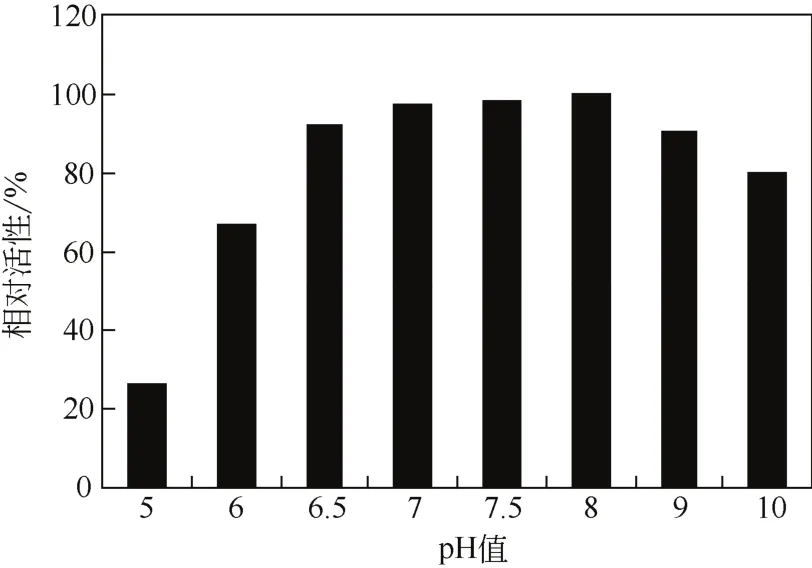
图1 反应pH值对氧化PMSO活性的影响
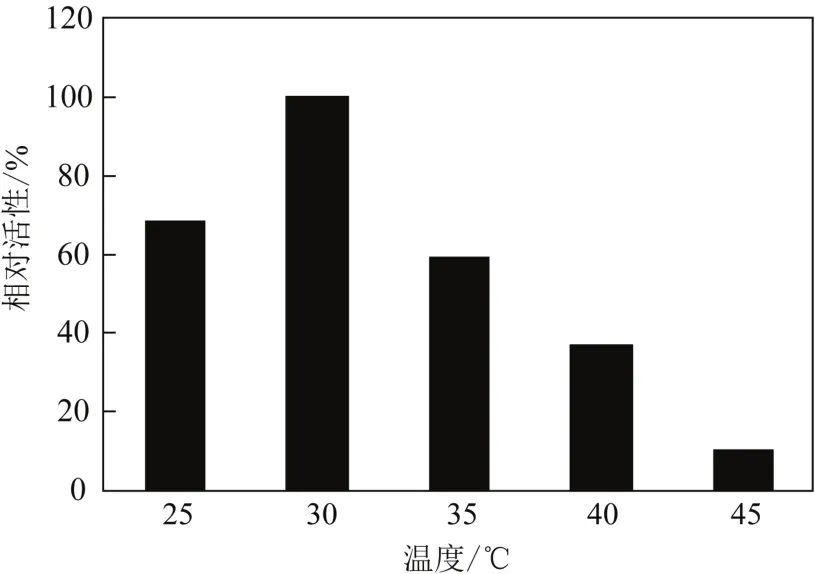
图2 反应温度对氧化PMSO活性的影响
2.3 摇床转速对氧化PMSO的影响
摇床转速对体系溶氧有着显著地影响[14],从而影响Rhodococcussp. CCZU10-1对rac-PMSO氧化活性。如图3所示,在低转速(120r/min)下,溶氧较低,导致氧化活性较低;转速提高到180r/min,氧化活性明显地提高;继续提高转速,氧化活性提高不明显。因此,180r/min为最适摇床转速。
2.4 辅助底物对氧化PMSO的影响
在生物催化氧化还原反应过程中添加辅助底物可以促进辅酶再生,从而提高催化效率[15]。10种潜在的辅助底物(半乳糖、甘露糖、果糖、葡萄糖、蔗糖、乙醇、丙三醇、异丙醇、正丁醇、异丁醇)(50mmol/L)对Rhodococcussp. CCZU10-1氧化PMSO的影响进行了考察。如图4所示,不同的辅助底物对Rhodococcussp. CCZU10-1氧化PMSO有着显著地影响。当辅助底物为半乳糖时,催化活性达到最大。因此,最适辅助底物为半乳糖(50mmol/L)。
2.5 生物催化剂添加量的影响
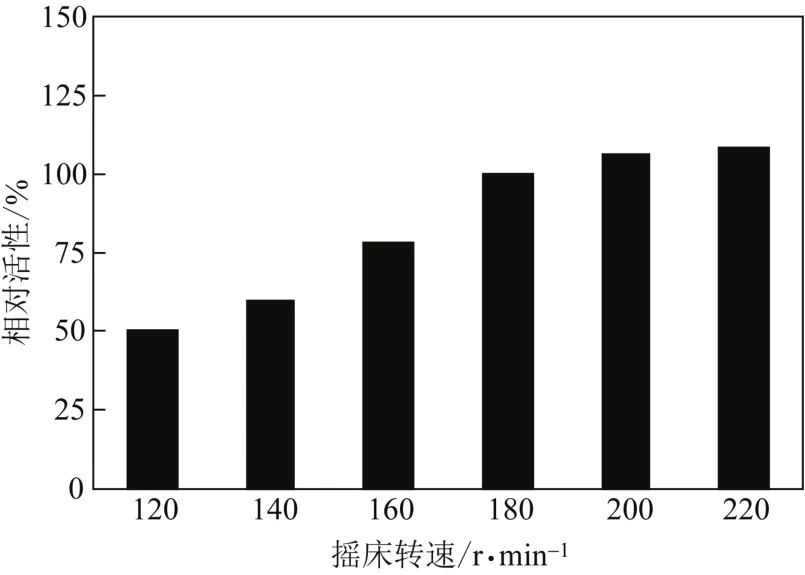
图3 摇床转速对氧化PMSO活性的影响
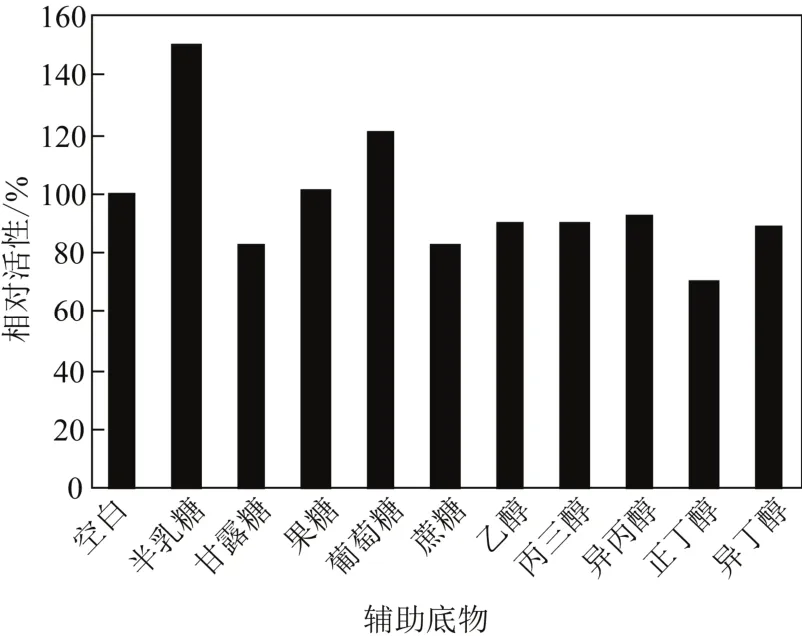
图4 辅助底物对氧化PMSO活性的影响
反应过程中,生物催化剂添加量是影响生物催化活性的重要因素之一[16]。因此,进一步考察不同Rhodococcussp. CCZU10-1静息细胞添加量(0.01~0.2g/mL,湿重)对催化反应的影响。如图5所示,细胞浓度对催化活性具有显著的影响。当细胞浓度为0.08g (湿重)/mL时,催化活性达到最大。当细胞浓度大于0.08g/mL时,反应体系的黏度明显增加,导致溶氧的降低,最终催化活性显著下降。因此,0.08g (湿重)/mL为最适Rhodococcussp. CCZU10-1细胞添加量。
2.6 20mmol/L底物反应进程
在最适的反应条件下,对催化rac-PMSO(20mmol/L)进程进行了考察。如图6所示,随着反应时间的延长,(R)-PMSO浓度显著地下降,苯甲砜浓度显著地上升,而(S)-PMSO大部分保留在反应体系中。反应6h,(R)-PMSO完全转化,而(S)-PMSO(ee> 99.9%,图7)的产率为47.1%。可能的催化反应rac-PMSO途径如图8所示:Rhodococcussp. CCZU10-1对 (R)-PMSO有较高的催化活性,首先将其完全氧化为苯甲砜;而对(S)-PMSO催化活性较低,将其氧化为少量的苯甲砜;催化过程中苯甲砜未发现进一步反应。值得注意的是,(S)-PMSO和苯甲砜分别是治疗胃溃疡药物(如奥美拉唑)和抗生素(如甲砜霉素)的关键中间体。
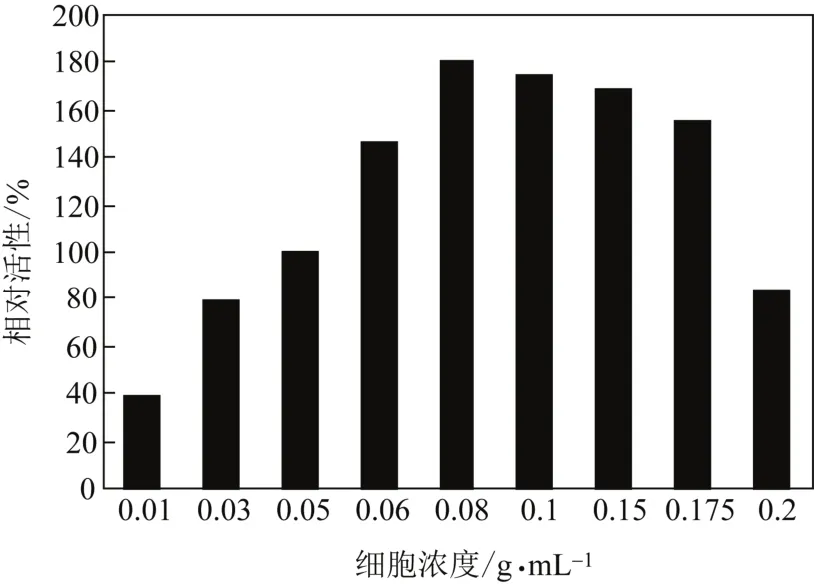
图5 生物催化剂添加量对氧化PMSO活性的影响
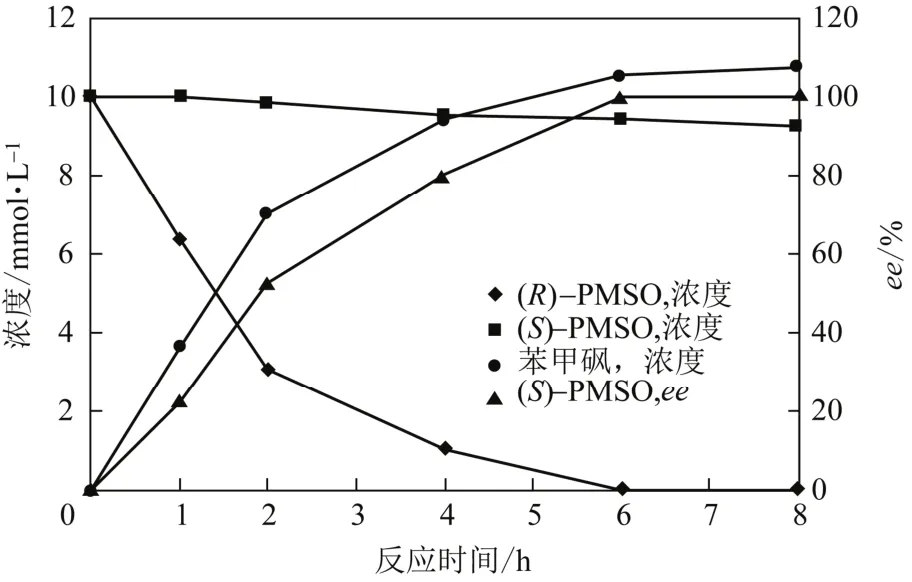
图6 催化rac-PMSO的反应进程
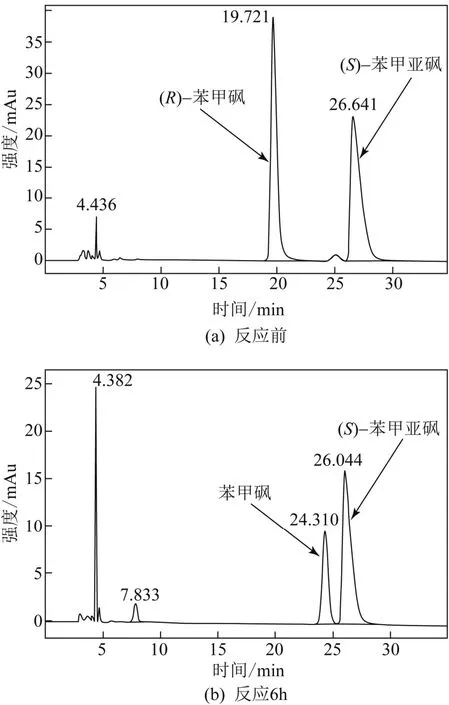
图7 催化rac-PMSO反应前后手性HPLC谱图
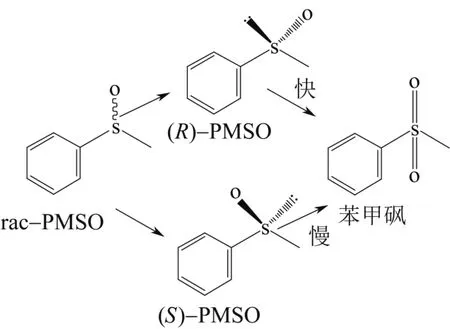
图8 生物催化氧化rac-PMSO途径
3 结 论
通过反应pH值、反应温度、摇床转速、辅助底物、细胞浓度等因素考察Rhodococcussp. CCZU10-1氧化拆分催化rac-PMSO活性的影响,确定了最适反应条件:反应pH值8.0,反应温度为30℃,摇床转速180r/min,辅助底物为半乳糖(50mmol/L),细胞添加量为0.08g (湿重)/mL。在20mmol/L体系中反应6h,(S)-PMSO (ee> 99.9%)的产率为47.1%。
[1] Nakamura S,Watanabe Y,Toru T. Extremely efficient chiral induction in conjugate additions ofp-tolyl α-lithio-β-(trimethylsilyl)ethyl sulfoxide and subsequent electrophilic trapping reactions[J].Journal of Organic Chemistry,2000,65:1758-1766.
[2] Huang Q Y,Zhu J,Deng J G.. Recent development in asymmetric catalytic oxidation of prochiral sulfides by metal-based catalysts[J].Chinese Journal of Organic Chemistry,2005,25:496-506.
[3] Kamerbeek N M,Olsthoorn A J J,Fraaije M W,et al. Substrate specificity and enantioselectivity of 4-hydroxyacetophenone monooxygenase[J].Applied Microbiology and Biotechnology,2003,69:419-426.
[4] Pinedo-Rivilla C,Aleu J,Collado I G.. Enantiomeric oxidation of organic sulfides by the filamentous fungiBotrytis cinerea,Eutypa lataandTrichoderma viride[J].Journal of Molecular Catalysis B:Enzymatic,2007,49:18-23.
[5] Tomás P R,Carmen M L,Sanz A,et al. Determination of omeprazole,hydroxyomeprazole and omeprazole sulfone using automated solid phase extraction and micellar electrokinetic capillary chromatography[J].Journal of Pharmaceutical and Biomedical Analysis,2006,42:100-106.
[6] Ricci L C,Comasseto J V,Andrade L H,et al. Biotransformations of aryl alkyl sulfides by whole cells of white-rotBasidiomycetes[J].Enzyme and microbial technology,2005,36:937-946.
[7] Auret B J,Boyd D R,Henbest H B. Stereoselectivity in the oxidation of sulphoxides to sulphones in the presence ofAspergillus niger[J].Journal of the Chemical Society C,1968:2374-2376. DOI:10.1039/J39680002374.
[8] Li A T,Yu H L,Pan J,et al. Resolution of racemic sulfoxides with high productivity and enantioselectivity by aRhodococcussp. strain as an alternative to biooxidation of prochiral sulfides for efficient production of enantiopure sulfoxides[J].Bioresource Technology,2011,102:1537-1542.
[9] 何玉财,周琼,张跃,等. 一株烟腈水解酶菌株的筛选及其催化特性初步研究[J]. 化工进展,2011,30(12):2714-2718.
[10] He Y C,Zhou Q,Ma C L,et al. Biosynthesis of benzoylformic acid from benzoyl cyanide by a newly isolatedRhodococcussp. CCZU10-1 in toluene-water biphasic system[J].Bioresource Technology,2012,115:88-95.
[11] 王利群,汪庆,何玉财,等. 一株脂肪酶产生菌及其脂肪酶催化[J].化工进展,2012,31(3):643-648.
[12] 夏子义,倪晔,孙志浩,等. 利用Clostridium saccharobutylicumDSM 13864 连续发酵生产丁醇[J]. 化工进展,2013,32(1):156-173.
[13] Ni Y,Zhang B H,Sun Z H. Efficient synthesis of (R)-2-chloro-1-(3-chlorophenyl)ethanol by permeabilized whole cells ofCandida ontarioensis[J].Chinese Journal of Catalysis,2012,33:681-687.
[14] 敬科举,徐志南,林建平,等. 重组大肠杆菌细胞不对称还原4-氯乙酰乙酸乙酯合成(R)-(+)-4-氯-3-羟基丁酸乙酯[J]. 催化学报,2005,26:993-998.
[15] Choia H J,Uhmb K N,Kima H K. Production of chiral compound using recombinantEscherichia colicells co-expressing reductase and glucose dehydrogenase in an ionic liquid/water two phase system[J].Journal of Molecular Catalysis B:Enzymatic,2011,70:114-118.
[16] 汪云,王利群,何玉财,等. 两相体系中固定化黏红酵母CCZU-G5催化合成(R)-2-羟基-4-苯基丁酸乙酯[J]. 化工进展,2013,32(3):661-665.
Selective oxidation resolution of racemic phenyl methyl sulfoxide with Rhodococcus sp. CCZU10-1
YANG Zhenxing,TAO Zhicheng,HE Yucai,WANG Liqun,ZHANG Yue,XING Zhen,GONG Lei,
PAN Xuehe
(Laboratory of Biochemical Engineering,School of Pharmaceutical Engineering and Life Sciences,Changzhou University,Changzhou 213164,Jiangsu,China)
To efficiently synthesize optically active chiral sulfoxides,Rhodococcussp.CCZU10-1 was used for the asymmetric resolution of rac-PMSO into (S)-PMSO (ee> 99.9%) in aqueous single-phase system. After optimization,the optimum reaction pH,reaction temperature,shaker speed,co-substrate,cells dosage were 8.0,30℃,180 r/min,galactose (50mmol/L) and 0.08g (wet weight)/mL,respectively. By biotransformation of rac-PMSO (20mmol/L) for 6h under the optimized conditions,(R)-PMSO was completely oxidized into the corresponding sulfone,and (S)-PMSO (ee> 99.9%) was obtained at a high yield of 47.1%. These results would lay the foundation of industrial production of (S)-PMSO.
Rhodococcussp.;(S)-PMSO;resolution;biotransformation;optimization
Q 814
A
1000-6613(2014)10-2744-05
10.3969/j.issn.1000-6613.2014.10.037
2014-02-19;修改稿日期:2014-03-04。
国家自然科学基金(21102011)及江苏省自然科学基金(BK20141172)项目。
杨振兴(1988—),硕士研究生。联系人:何玉财,博士,副教授。E-mail heyucai2001@163.com;yucaihe2007@aliyun.com。

