PKH26标记和分子荧光活体成像技术在软骨组织工程研究中的应用
祁霁舟徐宝山 彭 江许文静杨 强
PKH26标记和分子荧光活体成像技术在软骨组织工程研究中的应用
祁霁舟1徐宝山2△彭 江3许文静3杨 强2
目的 探讨PKH26荧光标记和分子荧光活体成像技术在软骨组织工程中的应用。方法用PKH26荧光标记犬软骨细胞,种植到多孔支架上,体外培养1周后异位移植到裸鼠背部,4周后用分子荧光活体成像系统示踪,并与X线检查结果对比。然后处死裸鼠取材,与免疫组织化学染色和免疫荧光观察结果对比。结果4周分子荧光活体成像系统观察裸鼠背部标本处呈圆形强荧光,表明组织工程软骨在裸鼠体内生长良好。组织学切片结果显示番红O染色、Ⅱ型胶原免疫组化染色和甲苯胺蓝染色阳性,荧光显微镜下观察结果显示组织工程化软骨中细胞均呈红色荧光,Ⅱ型胶原免疫荧光染色呈绿色荧光,叠加后呈黄色荧光。结论PKH26荧光标记和分子荧光活体成像2种方法结合应用于软骨组织工程中,能够较理想地且大体无创伤性评估组织工程化软骨组织在体内的生长情况。
软骨细胞;组织工程;荧光;PKH26
临床上关节软骨损伤类疾病很常见,关节软骨是不可再生组织,损伤后几乎不能自主修复[1]。目前软骨缺损修复的方法尚不成熟,均有其局限性[2],而组织工程方法的出现为关节软骨的修复提供了新的可行的思路和途径[3-4]。本实验以PKH26荧光染料标记的犬软骨细胞为种子细胞,种植到软骨脱细胞基质(CACM)多孔支架上,体外培养一段时间后,异位构建于裸鼠背部,并利用分子荧光活体成像系统(Molecular light imaging system)无创伤性评估组织工程化软骨组织在裸鼠体内的生长情况。
1 材料与方法
1.1 主要材料、试剂及仪器 高糖型DMEM培养基、胎牛血清(GIBCO公司,美国),L-脯氨酸、维生素C、Ⅱ型胶原酶、胰蛋白酶、PKH26、HEPES缓冲液(Sigma公司,美国),非必需氨基酸(Hyclone公司,美国),鼠抗人Ⅱ型胶原抗体、FITC标记的兔抗鼠二抗(武汉博士德生物工程有限公司)。CACM多孔支架(天津医院骨科研究所细胞工程室制备),Kodak In-Vivo Imaging System FX(美国Kodak公司),荧光显微镜(日本Olympus公司),流式细胞仪(COULTER公司),激光共聚焦显微镜(蔡司公司)。成年雄性家犬1只,体质量20 kg。成年雌性裸鼠5只,体质量30~40 g,由天津医院实验动物中心提供。
1.2 犬软骨细胞的获取分离及培养 实验动物行肌内注射麻醉速新眠Ⅱ号(0.1 mL/kg),动物手术室无菌条件下取膝关节负重区软骨,剪碎成约1 mm3,用0.2%(W/V)Ⅱ型胶原酶,37℃恒温消化1 h,过滤,用D-Hank’s液清洗3遍,加入含20%胎牛血清的软骨细胞培养液(含维生素C 50 mg/L,左旋羟脯氨酸40 mg/L,1%非必需氨基酸),转移至带尼龙纱巾的10 mL普通培养瓶中,置于培养箱中培养。细胞贴壁后每3~4 d换液。使用P3代以前的细胞。
1.3 PKH26染料标记细胞 消化培养的软骨细胞,用无血清培养基清洗,离心10 min,去上清,重复1次。加入1 mL缓冲液diluent C,吹匀,加入到配好的1 mL PKH26染液(4× 106mol/L)中并混匀,室温反应4 min,加入2 mL胎牛的血清终止反应,再加入4 mL高糖型DMEM培养基。400×g离心10 min,去上清,重复清洗3遍。配成需要的细胞浓度[(1~2)×107/mL]。荧光显微镜检测标记细胞荧光强度,流式细胞仪检测标记细胞百分率,台盼蓝染色及细胞计数法检测细胞活力。MTT法测定标记细胞和非标记细胞的生长曲线,设置PKH26标记组和对照组,取密度1×104个/mL标记和非标记的细胞悬液接种至96孔板,培养1~6 d。每组取5孔,MTT溶液处理后于酶联免疫检测仪中570 nm波长处测定光密度(OD)值。根据OD值和时间点制作生长曲线。
1.4 软骨细胞/多孔支架复合体制备 CACM多孔支架经冻干而成(直径6 mm,高2 mm),经25 kGy60Co照射灭菌,提前浸泡培养基12 h,然后置入24孔板中,用1 mL注射器将软骨细胞悬液注射到支架内部,每个支架50 μL,2 h后细胞基本贴附,期间每隔30 min滴加10 μL条件培养液,并翻转支架。加入软骨培养液后体外培养1周。
1.5 裸鼠体内植入实验 无菌条件下将体外培养1周的软骨细胞/多孔支架复合体移植到裸鼠背部皮袋,缝合。
1.6 分子荧光活体成像系统评估组织工程化软骨体内生长情况 4周后将裸鼠麻醉,置于仰卧位,用Kodak In-Vivo Imaging System FX观察体内荧光情况(激发光450~570 nm/发射光570~700 nm),设置参数如下:曝光时间2 min,光圈4,分辨率650 dpi。
1.7 组织工程化软骨的获取和评估
1.7.1 组织学观察和免疫组化 于4周后处死裸鼠,取材,肉眼观察组织工程化软骨的大体颜色和形态。将组织用95%乙醇固定,然后用冰冻切片包埋剂(OCT)包埋,冰冻切片机切10 μm厚,行番红O、Ⅱ型胶原免疫组化和甲苯胺蓝染色,光镜下观察。
1.7.2 免疫荧光染色和荧光显微镜观察 将10 μm冰冻切片血清封闭。4℃下鼠抗人Ⅱ型胶原一抗孵育过夜,羊抗鼠FITC标记的荧光抗体常温下孵育40 min,90%甘油封片。荧光显微镜下观察。
1.8 统计学方法 用SPSS 13.0软件包进行统计学处理。数据以均数±标准差(±s)表示,2组间比较采用两独立样本资料t检验,P<0.05为差异有统计学意义。
2 结果
2.1 电镜支架结构及倒置显微镜观察 电镜下CACM支架呈多孔性,孔径100~250 μm,孔隙率91.3%,见图1a。1周左右有部分软骨细胞贴壁,呈短梭或多角形,接近融合时原代细胞呈不规则状,见图1b。而使用纱巾培养附着的细胞呈圆形,随时间的延长,相互之间融合成片,细胞复层生长,甚至形成组织块样,见图1c。

Fig.1 SEM micrographs of porous cartilage acellular matrix scaffold and canine chondrocytes图1 电镜支架结构及倒置显微镜观察
2.2 PKH26染料标记结果 荧光显微镜下细胞膜呈红色荧光,细胞染色较均匀,见图2a。流式细胞仪显示标记百分率为95.12%,见图2b,台盼蓝染色细胞活力达96%以上。生长曲线结果显标记组与对照组示犬软骨细胞PKH26第1~6天OD值差异均无统计学意义(t分别为0.078、0.105、0.286、1.584、0.877、1.488,均P>0.05,n=5),见图2c。
2.3 分子荧光活体成像系统评估 在激发光下可见裸鼠背部组织工程化软骨组织呈现圆形强荧光,见图3a,与同位置的X线图像合并,可清楚显示组织工程化软骨组织在裸鼠体内的解剖位置,见图3b。
2.4 标本取材染色结果 4周后类软骨样组织标本切片番红O染色阳性,见图4a;Ⅱ型胶原染色阳性,见图4b;甲苯胺蓝染色阳性,见图4c。
2.5 免疫荧光染色 取材的类软骨样组织标本在荧光显微镜下细胞呈红色荧光,见图5a;同一视野内软骨细胞周围显示绿色荧光(Ⅱ型胶原免疫荧光FITC),见图5b;两视野重叠呈黄色荧光,见图5c。
3 讨论
3.1 PKH26荧光标记特点 理想的标记技术应具有操作简便、标记率高、荧光强度强等特点,PKH26作为一种荧光染料,呈现红色荧光,标记过程简单易行[5]。其作用于细胞膜半衰期长,且可随着细胞分裂而传递。基于以上特点,使其成为用于体内细胞的示踪研究的常用方法[6]。彭艳等[7]通过PKH26标记大鼠骨髓间充质干细胞,体外培养并诱导分化,然后通过鼠尾静脉移植到子宫内膜,观察其分布情况,从而证明了PKH26标记技术可用于示踪骨髓间充质干细胞的迁移、转归和移植方面的研究。在软骨组织工程研究中,有研究者把羊骨髓基质干细胞用PKH26标记后种植到多孔支架上,培养一段时间后移入到受损的羊膝关节内观察受损膝关节修复情况,于4、8周取材观察显示缺损修复良好,生成的软骨样组织主要为红色荧光细胞[8]。
3.2 活体荧光成像技术 目前在组织工程研究中,体外评估细胞-支架复合物结果直观且操作简单。常用的方法有细胞活性染色[9]、细胞增殖的评估[10]和代谢活动评估等[11]。而体内评估方法却相对单一,最常用的方法是处死动物取样本进行评估。这种方法缺点明显,无法对同一样本长期动态追踪观察,而且得到的标本无法区分细胞来源。本研究所用的分子荧光活体成像系统弥补了传统方法的不足。该方法能够检测到动物体内发出的低剂量荧光,灵敏度高,操作简便,且能够穿透一定厚度的组织。与传统的活体取材相比,具有无创、精确、可长期动态监测等特点。基于以上优点,分子荧光活体成像系统已经被应用于标记肿瘤组织[12]、转基因细胞的生长情况[13]以及基因载体传送评估[14]。当然,活体荧光成像系统也有不足之处,比如对密度或厚度较大的组织可能难以穿透而显色不足;显像不够具体,无法直接观察细胞形态等。
3.3 CACM支架及细胞培养 本研究使用的CACM多孔支架为本研究小组自行研制,具备适宜的大小、均匀的孔径和高度的孔隙率以及良好的细胞相容性。另外,本实验采用Ⅱ型胶原酶消化联合纱巾培养法分离培养犬软骨细胞,与传统的贴壁培养法相比能更好地保持软骨细胞的表型及特点。
3.4 PKH26标记和分子荧光活体成像技术联合应用 体内植入4周后,分子荧光体内成像系统显示在裸鼠背部区域可见植入的细胞/支架组织工程复合体呈现圆形强荧光,无扩散,表明软骨细胞在CACM多孔支架上生长良好。取出样本切片固定进行组织学染色,可见大量软骨细胞,番红O染色、Ⅱ型胶原免疫组化染色和甲苯胺蓝染色阳性则证明组织中含有糖胺聚糖、Ⅱ型胶原成分和硫酸软骨素,表明得到的标本是类软骨组织。此外,将荧光图像与同位置的X线图像融合,可以得到样本在裸鼠体内更准确的位置。最后,Ⅱ型胶原免疫荧光染色显示说明种植的软骨细胞在支架中与周围组织均相互融合生长,成功在裸鼠背部构建出软骨样组织。
综上所述,PKH26荧光标记着色均匀,标记率高,效果肯定。分子荧光体内成像系统灵敏度高,操作简便。两种方法相结合用于软骨组织工程,能够较理想地评估组织工程化组织在体内的生长情况。
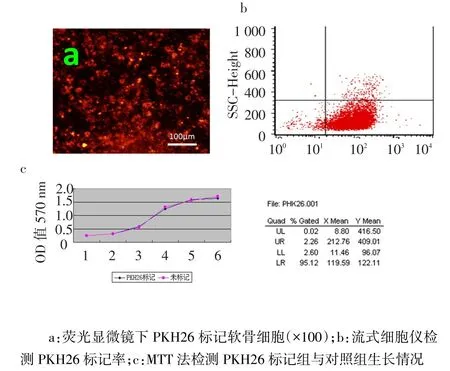
Fig.2 PKH26 labeled chondrocytes图2 软骨细胞PKH26标记结果

Fig.3 Evaluation of Molecular light imaging system图3 分子荧光活体成像系统评估

Fig.4 The staining for tissue-engineered cartilage(×40)图4 异位构建软骨样组织免疫组化染色结果(×40)

Fig.5 Immunofluorescent staining of tissue-engineered cartilage(×40)图5 异位构建软骨样组织免疫荧光染色(×40)
[1]Matsumoto T,Okabe T,Ikawa T,et al.Articular cartilage repair with autologous bone marrow mesenchymal cells[J].J Cell Physiol, 2010,225(2):291-295.doi:10.1002/jcp.22223.
[2]Schindler OS.Current concepts of articular cartilage repair[J].Acta Orthop Belg,2011,77(6):709-726.doi:10.1016/j.mporth. 2009.05.002.
[3]Kock L,van Donkelaar CC,Ito K.Tissue engineering of functional articular cartilage:the current status[J].Cell Tissue Res,2012,347 (3):613-627.doi:10.1007/s00441-011-1243-1.
[4]Adachi N,Ochi M,Deie M,et al.Implantation of tissue-engineered cartilage-like tissue for the treatment for full-thickness cartilage defects of the knee[J].Knee Surg Sports Traumatol Arthrosc,2014, 22(6):1241-1248.doi:10.1007/s00167-013-2521-0.
[5]Ding XM,Xu BS,Wu YH,et al.An Experimental Study on Bovine Nucleus Pulposus Cells Labelled with PKH26 in Vitro[J].Tianjin Medical Journal,2014,42(9):849-852.[丁晓明,徐宝山,伍耀宏,等.PKH26荧光标记牛尾髓核细胞的实验研究[J].天津医药, 2014,42(9):849-852.]
[6]Kawaguchi K,Katsuyama Y,Kikkawa S,et al.PKH26 is an excellent retrograde and anterograde fluorescent tracer characterized by a small injection site and strong fluorescence emission[J].Arch Histol Cytol,2010,73(2):65-72.doi:10.1679/aohc.73.65.
[7]Peng Y,He YL,Zhu SF.Rat bone marrow mesenchymal stem cells labeled and tracked with PKH26[J].Chinese Journal of Tissue Engineering Research,2012,16(14):2487-2490.[彭艳,何援利,朱少芳.大鼠骨髓间充质干细胞的PKH26标记和示踪[J].中国组织工程研究, 2012,16(14):2487-2490.]doi:10.3969/j.issn.1673-8225.2012.14.004.
[8]Chen J,Wang C,Lu S,et al.In vivo chondrogenesis of adult bonemarrow-derived autologous mesenchymal stem cells[J].Cell Tissue Res,2005,319(3):429-438.doi:10.1007/s00441-004-1025-0.
[9]Padial-Molina M,Galindo-Moreno P,Fernández-Barbero JE,et al. Role of wettability and nanoroughness on interactions between osteoblast and modified silicon surfaces[J].Acta Biomater,2011,7(2): 771-778.doi:10.1016/j.actbio.2010.08.024.
[10]Engebretson B,Sikavitsas VI.Long-term in vivo effect of PEG bone tissue engineering scaffolds[J].J Long Term Eff Med Implants, 2012,22(3):211- 218.doi:10.1615/JLongTermEffMedImplants.2013006244.
[11]Ekenseair AK,Boere KW,Tzouanas SN,et al.Synthesis and characterization of thermally and chemically gelling injectable hydrogelsfor tissue engineering[J].Biomacromolecules,2012,13(6):1908-1915.doi:10.1021/bm300429e.
[12]Medarova Z,Pham W,Kim Y,et al.In vivo imaging of tumor response to therapy using a dual-modality imaging strategy[J].Int J Cancer,2006,118(11):2796-2802.doi:10.1002/ijc.21672.
[13]Xia J,Martinez A,Daniell H,et al.Evaluation of biolistic gene transfer methods in vivo using non-invasive bioluminescent imaging techniques[J].BMC Biotechnol,2011,11(1):62.doi:10.1186/ 1472-6750-11-62.
[14]Nakanishi T,Kokubun K,Oda H,et al.Bioluminescence imaging of bone formation using hairless osteocalcin-luciferase transgenic mice [J].Bone,2012,51(3):369-375.doi:10.1016/j.bone.2012.06.012.
(2014-07-11收稿 2014-08-08修回)
(本文编辑 李鹏)
Evaluation of Cartilage Engineering Using PKH26 and Molecular Light Imaging System
QI Jizhou1,XU Baoshan2△,PENG Jiang3,XU Wenjing3,YANG Qiang2
1 Graduate School,Tianjin Medical University,Tianjin 300070,China;2 Tianjin Hospital;3 Institute of Orthopaedics,Chinese People’s Liberation Army General Hospital
△
E-mail:xubaoshan99@126.com
ObjectiveTo investigate the application of PKH26 and molecular light imaging system in cartilage engineering.MethodsCanine chondrocyte was labeled by fluorescent dye PKH26 and seeded into the porous cartilage acellular matrix scaffold.The cells/scaffold constructs were cultured in vitro for 1 week.Then the constructs were implanted into the dorsal pocket of nude mice.We utilized a molecular light imaging system to macroscopically observe cells/scaffold constructs in vivo with fluorescence at the 4thweeks,and compared with X-rays taken at the same position.The fluorescence images were compared with the immunohistochemical and immunofluorescent results of cartilage-like tissue in vivo.ResultsLuminescent images were acquired at the 4thweeks,a red color enhanced overlay of the luminescent image over X-ray photographic image demonstrated the location of the implants and the cell viability and cell growth on porous CACM scaffold in vivo were very well.Histological results show that the safranin O,anti-collagenⅡimmunohistochemistry and toluidine blue stain of cartilage-like tissue is positive.Immunofluorescence examination demonstrated chondrocytes in the constructs whitch is showen red fluorescence,and anti-collagenⅡimmunofluorescent staining was showen in green while the overlapping image is showen in yellow.ConclusionThis study outlines an applicable non-destructive method to evaluate cell growth in tissue engineering constructs in vivo using PKH26 and molecular light imaging system.
chondrocytes;tissue engineering;fluorescence;PKH26
R329-33,R349.89
A
10.3969/j.issn.0253-9896.2014.12.002
国家自然科学基金资助项目(81272046,31300798, 31000432);中国博士后科学基金项目(2011M500530,2012T50235);天津市卫生局科技基金(2013KR16)
1天津医科大学研究生院(邮编300070);2天津市天津医院脊柱外科;3中国人民解放军总医院
△通讯作者 E-mail:xubaoshan99@126.com

