高分辨率熔解曲线分析对38例孤独症DRD2基因外显子突变检测*
刘苗 陈星 翟静 刘金同 张燕 刘兆云 龙逢 杨树林 陈刚
高分辨率熔解曲线分析对38例孤独症DRD2基因外显子突变检测*
刘苗1,2陈星1翟静3刘金同3张燕3刘兆云1,2龙逢2杨树林4陈刚1
目的对孤独症患者DRD2基因全部外显子进行突变筛查。方法构建孤独症患者纳入研究组(38例)和对照组(95例和1 000例)3个DNA混合池,对DRD2基因的9个外显子合成了15对引物,将3个DNA混合池样本分别进行聚合酶链扩增及COLDPCR扩增,用Light Scanner高分辨率熔解曲线分析系统进行两次熔解曲线对比。结果在孤独症患者DRD2基因外显子未发现突变。结论孤独症的病因并非源于DRD2基因外显子的突变。
孤独症DRD2基因突变低变性温度下的复合PCR高分辨率熔解曲线分析
孤独症(autism)是一种始发于婴幼儿期(通常在3岁以内)的广泛性发育障碍,以社交、言语障碍及刻板重复行为为主要特征,并且这些特征不会随孤独症儿童的成长而消失,多数患者伴有精神发育迟滞,预后差[1]。近年来孤独症的发病呈上升趋势,国外报道儿童孤独症的患病率为0.6%[2]。孤独症病因尚不清楚,可能是遗传与环境共同作用的结果,是一种多基因遗传病。迄今,许多基因被发现与孤独症关联,我们用AffymetrixSNP6.0芯片对孤独症的全基因组关联分析结果发现其与DRD2基因存在关联(数据未发表)。因此,本研究采用了低变性温度下的复合PCR、DNA混合和高分辨率熔解曲线分析相结合的技术方法,对DRD2基因的全部外显子区域,在38例孤独症患者和1 095例正常对照者进行了突变筛查,结果报道如下。
1 对象与方法
1.1 对象选择了2000~2002年在山东省精神卫生中心就诊的孤独症患者(研究组)38例;其中男性36例,女性2例,男女之比为18∶1,年龄2~10岁,平均年龄(5.10±1.61)岁,患者间均无血缘关系。正常对照者1 095例(对照组),分为95例与1 000例两组,均取自山东省血液中心献血者。95例对照者中,男性48例,女性47例,男女之比为1.02∶1,年龄18~55岁,平均年龄(26.03±6.84)岁;1 000例对照者中,男性569例,女性431例,男女之比为1.32∶1,年龄17~55岁,平均年龄(23.08±5.67)岁。所有患者均符合国际疾病分类第10版(ICD-10)孤独症诊断标准,本研究得到了山东省医学科学院基础医学研究所伦理委员会的批准,并获得了患者与对照者的知情同意。
1.2 方法
1.2.1 基因组DNA制备取研究组与对照组的外周静脉血,分别放入抗凝试管与抗凝袋中-20℃冷冻保存。DNA采用厦门百维信生物科技有限公司(Bio-V)的Lab-Aid 820自动核酸提取仪与500 μl全血磁珠提取核酸试剂盒提取。DNA浓度用美国赛默飞世尔科技(Thermo Fisher Scientific)的NanoDrop 2000分光光度计检测,每个样本测定两次,如果两次误差超过10%,则进行第3次测定,取两个相近数值的平均值。而后,将所有DNA样品稀释至终浓度20 ng/μl。
1.2.2DNA混合池(DNA pooling)制作将研究组与对照组的每个个体取20 ng/μl浓度的DNA溶液10 μl进行混合,制成DNA混合池,将研究组患者的DNA构建1个DNA混合池样本;将对照组的DNA分别构建了2个DNA混合池样本(95例与1 000例)。最后,将所有DNA样品稀释至终浓度1 ng/μl,用96孔深孔板(2 ml)-20℃冻存备用。
1.2.3 DNA模板分装用美国APRICOT DESIGNs Personal Pipette PP-550N-XD移液工作站将终浓度1 ng/μl的DNA溶液分装5 μl至96孔PCR板(宁波)。
1.2.4 引物设计与合成用美国加州大学的基因组生物信息学网站UCSC Genome Bioinformatics(http:// genome.ucsc.edu/cgi-bin/hgGateway),输入DRD2基因,在众多转录本中选择最长(外显子最多)的一个,在Human Gene DRD2(uc010pxh.2)Description and Page Index页面,通过Exon Primer(外显子引物),选择Entire(全部)cDNA后生成;引物由北京六合华大基因科技股份有限公司合成。见表1。

表1 孤独症DRD2基因外显子突变检测引物序列
1.2.5 PCR反应DNA 5 μl(1 ng/μl),10×EasyTaq buffer 2.0 μl(Trans Gen Biotech全式金),10 mM dNTPs 0.8 μl,5 μM Primer(左右)各0.8 μl,5 μM SYTO9(饱和荧光染料)1.5 μl,Easy Taq polymerase (Trans Gen Biotech全式金)(5 U/μl)0.2 μl,加ddH2O 8.9 μl使总反应体系为20 μl。PCR反应在美国Applied Biosystem,ABI公司的GeneAmp PCR System 9700扩增仪上进行,反应条件如下:95℃预变性5 min;95℃变性30 s,56~59℃退火2 min,72℃延伸30 s,共50个循环;然后72℃保温7 min,最后保存于25℃。从PCR产物中取15 μl用于高分辨率熔解曲线分析,先确定PCR产物的Tm值,再制定相应PCR产物的Tc值(临界解链温度)(Tc=Tm-1)。将剩余的5 μl PCR产物加三蒸水200 μl稀释后混匀,取5 μl用作Cold-PCR的DNA模板,试剂与PCR配方相同,总反应体系为20 μl。反应条件:95℃预变性2 min;95℃变性15 s、56℃退火2 min、72℃延伸1 min,共10个循环;95℃变性15 s、70℃2 min(形成杂交异源双链)、Tc=Tm-1,每个具体PCR产物有所不同,变性10 s、56℃退火30 s、72℃延伸1 min,共40个循环;最后保存于25℃。
1.2.6 高分辨率熔解曲线分析基因突变检测(High Resolution Melting for Gene Scan)采用高分辨熔解曲线基因突变/基因分型检测系统(美国Idaho Technology,Light Scanner HI 96),温度从65℃升至95℃。饱和荧光染料结合于DNA双链之中,随着温度的逐渐上升,双链PCR产物就会发生解链,荧光染料则会随之开始脱落,直至DNA完全解链后全部脱落。此过程会通过荧光曲线的下降反映出来,如果对照组与研究组患者在这一段PCR产物的DNA序列完全一致,那么二者的熔解曲线的形状就会完全吻合;若研究组的DNA存在突变,就会形成DNA异源杂合双链,解链温度会提前,或者呈现两次解链,熔解曲线形状也会发生相应改变,通过与对照组熔解曲线做对比,便可发现患者的这一段DNA序列是否存在突变。Erali等[3]对此有非常全面而详尽的论述。
1.2.7 统计分析所有15对引物扩增后PCR产物的基因扫描通过Instrument&Analysis软件(Light Scanner wit Call-IT 2.0)完成。另外,研究组与对照组的一般统计学数据通过Microsoft Office Excel软件完成。
2 结果
对多巴胺受体2基因(dopamine D2receptor,DRD2)全部9个外显子的序列,用DNA混合池的方法,分别经过PCR与Cold PCR扩增后,对研究组与两个对照组的高分辨率熔解曲线逐一对比之后均未发现突变。见图1。
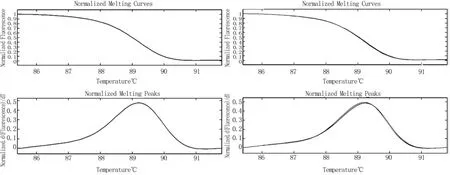
图1DRD2基因第3外显子(Exon 3)研究组与对照组高分辨率熔解曲线图
3 讨论
孤独症(Autism)的病因涉及遗传学、围产期危险因素、脑器质性疾病、神经生化等,一般认为是遗传与环境因素共同作用的结果。遗传学因素在目前病因学的研究中占主要方面,认为孤独症是多基因遗传性疾病[4]。孤独症谱系障碍显示出显著的性别差异,特发性自闭症男女之比约为(4~10)∶1,并且这一比例还会有增加的趋势[5]。
研究发现在孤独症患者中,大约75%的出现精神发育迟滞,15%~30%出现癫痫,20%~50%出现脑电图异常。此外,大约5%~14%的患者有染色体异常[6]。Lainhart等[7]的研究表示,大约有20%的孤独症患者在12~24个月的成长过程中发育相对正常,随后逐渐或突然出现变化,紧随其后的一段时间语言能力出现严重丧失,孤独症的症状变得非常明显。Ritvo等[8]对40对双生子的研究显示,同卵双生子的同病率为95.7%(23对同卵双生子有22对发病),异卵双生子同病率仅为23.5%(17对异卵双生子有4对发病)。研究还发现7、13、15、17及18号染色体上的某些区域与孤独症的易感性有关。目前发现的孤独症的易感基因包括EN2、FOXP2、RELN、MET、Reelin、CNTNAP2等[9]。
人类DRD2受体基因位于11q23.1,包含9个外显子,数个内含子及短核苷酸重复序列(STR),位于全基因组扫描所发现的与孤独症关联区域。St Clair等[10]的研究表明11q21-q22区域可能包含大部分精神疾病易感基因,而DRD2的异常表达可能是孤独症的发病原因之一。多巴胺D2受体信号与多项生理功能有关,如运动、激素分泌和药物成瘾等,同时,多巴胺D2受体也是已知的抗精神病药物治疗靶点之一,也是精神疾病研究的热点之一。Basu等[11]报道了多巴胺选择性地抑制血管内皮生长因子(VEGF),揭示了神经系统和血管生成之间的联系,并指出多巴胺D2受体可能对抗血管生成治疗有作用。DRD2基因在人脑内尾状核表达最高,可抑制腺苷酸环化酶的活性,使cAMP水平降低。DRD2是多巴胺受体的一个亚型,属于G蛋白偶联受体,位于多巴胺能神经元突触后膜[12]。大多数抗精神病药物的药理作用是通过阻断多巴胺受体及拮抗多巴胺敏感性腺苷酸环化酶的功能而发挥作用。多巴胺受体参与中枢神经系统“自我奖赏”效应,DRD2是精神活性物质依赖及成瘾形成的一个重要候选基因。TaqIA是DRD2基因的多态性标志,研究表明,TaqIA RFLP与酗酒和吸烟行为的成瘾性有关[13],DRD2基因TaqIA1等位基因见于69%的酗酒者,相比之下仅发生在20%的对照者中。Comings等[14]比较研究了酗酒与多巴胺能神经传递缺陷有关的疾病,为了降低基因频率的种族差异,研究仅限于非西班牙裔白人;结果发现在抑郁症、惊恐发作、帕金森病以及肥胖患者中的A1等位基因频率无明显增加。该研究还表明DRD2基因A1等位基因与许多精神疾病有关,可能是一个修饰基因,而不是主要致病基因。
DNA混合池(DNA pooling)是将许多患者与正常对照者的DNA样本分别加以混合后对其进行PCR扩增,比较不同组合混合样本之间等位基因频率的差异,其优点是提高研究效率,缩短研究周期。陈刚等[15]利用此技术对双相情感障碍等疾病进行了关联分析。
Boisselier等[16]在对异柠檬酸脱氢酶1(IDH1)基因突变检测中发现,低变性温度下的复合PCR (COLD-PCR)与高分辨率熔解曲线(High resolution melting curve analysis,HRM)相结合的方法是一种高灵敏度的突变检测方法,能够从大量野生型DNA中选择性扩增低丰度的未知突变,提高低丰度突变检测灵敏度[17]。每一段双链DNA都有一个Tm值,即指把DNA的双螺旋结构降解一半时的温度;不同序列的DNA,Tm值不同。而单核苷酸的突变会稍微降低双链DNA的熔解温度,而COLD-PCR正是利用这一特性,使用较低的变性温度TC(TC=Tm-1),优先扩增在序列上含有突变的DNA。再对COLD-PCR扩增产物通过HRM技术进行突变筛选。
高分辨率熔解曲线是近年来国际上兴起的一种SNP及突变研究工具,即可以进行SNPs的分型,又可以进行突变筛查。其原理是在DNA片段扩增过程中加入饱和荧光染料,并使其镶嵌在DNA双链之间,饱和了DNA双螺旋结构中的沟。不同的双链DNA分子在被加热变性时,在不同的温度下解链释放出饱和荧光染料,从而形成不同的熔解曲线。因为不同DNA序列的GC含量有所不同,因此在相同温度下双链DNA的解链情况是不同的,因此熔解曲线的形状也不相同。与传统方法相比,HRM检测不受突变位点和种类的限制,既能检测已知突变,又能检测未知突变,并且具有敏感性高,操作简便,成本低的优势。然而由于HRM的敏感性高,所以结果容易受各种因素的影响,因此优化扩增过程和扩增引物非常重要[18]。虽然HRM可以检测到突变,但是不能最终明确突变的性质[19]。
本实验对38例孤独症样本DRD2基因的全部9个外显子都进行了检测,未发现突变的原因可能有以下两点:(1)孤独症患者中,DRD2基因外显子中根本就不存在突变,而突变可能存在于外显子之外的其他DNA序列中(如内含子)。目前,内含子突变与疾病关系的研究逐渐增多,基因内含子的核苷酸序列并不参与转录,虽然与蛋白产物无关但却影响着相应的基因的表达。目前发现内含子具有许多功能,既有增强子作用,也有抑制作用,还与RNA编辑有关;研究还发现许多内含子突变及多态性与多种疾病的易感性相关。(2)DRD2基因启动子区CpG岛甲基化有待于探查。DNA甲基化是指生物体在DNA甲基转移酶(DNA methyltransferase,DMT)的催化下,以s-腺苷甲硫氨酸(SAM)为甲基供体,将甲基转移到特定的碱基上的过程。在哺乳动物中DNA甲基化主要发生在5’-CpG-3’的C上生成5-甲基胞嘧啶(5 mC)。基因启动子区是基因表达的重要调控区域,也是甲基化的集中区域,该区域CpG岛甲基化是调控基因表达的重要机制之一[20,21]。CpG岛在正常组织中处于非甲基化状态,DNA甲基化异常与许多中枢系统疾病,肿瘤等密切相关,CpG位点是发生自发突变的重要位点。(3)用于研究的患者样本数量不够大。(4)HRM敏感性不足。
总之,本文系统地对38例孤独症的DRD2基因全部9个外显子进行了突变检测,未能发现突变。这对以后孤独症病因的研究以及临床治疗具有参考意义,以后的研究既要考虑到基因外显子区域,同时更要考虑到基因内含子区域和调控区域的甲基化问题。
[1]Bailey A,Phillips W,Rutter M.Autism:towards an integration of clinical,genetic,neuropsychological,and neurobiological perspectives[J].Journalofchildpsychologyand psychiatry,and allied disciplines,1996,37(1):89-126
[2]Rutter M.Incidence of autism spectrum disorders:changes over time and their meaning[J].Acta paediatrica,2005,94(1):2-15
[3]Erali M,Wittwer CT.High resolution melting analysis for gene scanning[J].Methods,2010,50(4):250-261
[4]杨树林,陈刚,翟静,等.山东省孤独症7号染色体基因扫描研究[J].精神医学杂志,2009,22(1):1-4
[5]Folstein SE,Rosen-sheidley B.Genetics of autism:complex aetiology for a heterogeneous disorder[J].Nature reviews Genetics,2001,2(12):943-955
[6]Smalley SL.Genetic influences in childhood-onset psychiatric disorders:autism and attention-deficit/hyperactivity disorder[J].American journal of human genetics,1997,60(6): 1276-1282
[7]Lainhart JE,Ozonoff S,Coon H,et al.Autism,regression,and the broader autism phenotype[J].American journal of medical genetics,2002,113(3):231-237
[8]Ritvo ER,Freeman BJ,Mason-brothers A,et al.Concordance for the syndrome of autism in 40 pairs of afflicted twins[J]. The American journal of psychiatry,1985,142(1):74-77
[9]Alarcon M,Abrahams BS,Stone JL,et al.Linkage,association,and gene-expression analyses identify CNTNAP2as an autism-susceptibility gene[J].American journal of human genetics,2008,82(1):150-159
[10]St Clair D,Blackwood D,Muir W,et al.Association within a family of a balanced autosomal translocation with major mental illness[J].Lancet,1990,336(8706):13 -16
[11]Basu S,Nagy JA,Pal S,et al.The neurotransmitter dopamineinhibitsangiogenesisinducedbyvascular permeability factor/vascular endothelial growth factor[J]. Nature medicine,2001,7(5):569-574
[12]Neville MJ,Johnstone EC,Walton RT.Identification and characterization of ANKK1:a novel kinase gene closely linked to DRD2on chromosome band 11q23.1[J]. Human mutation,2004,23(6):540-545
[13]Comings DE,Blum K.Reward deficiency syndrome:genetic aspects of behavioral disorders[J].Progress in brain research,2000,126:325-341
[14]Comings DE,Comings BG,Muhleman D,et al.The dopamine D2receptor locus as a modifying gene in neuropsychiatric disorders[J].JAMA:the journal of the American Medical Association,1991,266(13):1793-1800
[15]栾萌,陈刚,周鹏,等.山东省双相情感障碍6号染色体基因扫描研究[J].精神医学杂志,2010,23(3):161-164
[16]Boisselier B,Marie Y,Labussiere M,et al.COLD PCR HRM:a highly sensitive detection method for IDH1 mutations[J].Human mutation,2010,31(12):1360-1365
[17]Li J,Makrigiorgos GM.COLD-PCR:a new platform for highly improved mutation detection in cancer and genetic testing[J].Biochemical Society transactions,2009,37 (Pt 2):427-432
[18]Tindall EA,Petersen DC,Woodbridge P,et al.Assessing high-resolution melt curve analysis for accurate detection of gene variants in complex DNA fragments[J].Human mutation,2009,30(6):876-883
[19]Milbury CA,Li J,Makrigiorgos GM.COLD-PCR-enhanced high-resolutionmeltingenablesrapidandselective identification of low-level unknown mutations[J].Clinical chemistry,2009,55(12):2130-2143
[20]Ohgane J,Yagi S,Shiota K.Epigenetics:the DNA methylation profile of tissue-dependent and differentially methylated regions in cells[J].Placenta,2008,29 Suppl A:S29-S35
[21]张海生,王伟,余道军,等.5-羟色胺转运体基因启动子区CpG岛甲基化状态与精神分裂症Ⅰ型和Ⅱ型的关联[J].中国临床心理学杂志,2011,19(3):289-292
Mutation screening of exons in DRD2gene by using high-resolution melting curve analysis in 38 patients with autism.
LIU Miao,CHEN Xing,ZHAI Jing,et al. Laboratory of Medical Genetics,Institute of Basic Medicine,Shandong Academy ofMedical Sciences,Jinan 250062,China
ObjectiveTo screen the exons in DRD2 gene in autistic patients to find the mutations.Methods3 DNA poolswere constructed in 38 cases with autism,95 healthy controls and 1000 healthy controls. 15 pairs of primer were synthesized for9 exons in DRD2 gene. DAN in 3 pools was amplified with polymerase chain reaction ( PCR) and Cold-PCR. Mutation detectionwas performed by using Light Scanner high-resolution melting curve ( HRM) analysis system to compare the melting curvebetween autistic patients and healthy controls.ResultNo mutation was found in all the 9 exons of DRD2 gene in autisticpatients.ConclusionMutations on exons of DRD2 gene is not involved in the etiology of autism.
Autism DRD2Gene Mutation Cold-PCR HRM
R749.94
A
1009-7201(2014)-01-0008-04
10.3969/j.issn.1009-7201.2014.01.003
2013-08-08)
山东省自然科学基金项目(编号:ZR 2010HQ051);山东省科技发展计划项目(编号:2011GSF11821)
1.250062济南,山东省医学科学院基础医学研究所2.济南大学山东省医学科学院医学与生命科学学院3.山东省精神卫生中心4.泰山医学院公共卫生学院
陈刚,导师,研究员,E-mail:chengang 560515@163.com

