MTA 和光固化氢氧化钙及光固化玻璃离子对人牙髓细胞增殖影响的比较
董 刚 张丰雷 李 冰
牙髓病治疗的成功与否在很大程度上依赖于根管充填材料的生物性能。作为长期存留于口腔内的治疗材料,其生物性能的优劣对于牙髓病的成功治疗及预后、患牙保存、口腔健康具有重要意义。理想的根充材料应具有以下性能:①良好的组织相容性;②无细胞毒性;③良好的封闭性能;④具有诱导牙髓再生的能力[1]。常用的治疗材料主要有氢氧化钙制剂、抗生素糊剂、羟磷灰石制剂、玻璃离子、银汞合金等[2]。但至今为止尚未有一种材料能全部符合上述理想要求,诸多学者都致力于对口腔材料的生物性能的研究,以期研制出生物相容性更好的、更具生物活性的治疗牙髓根尖周病的口腔材料。
应用体外细胞培养技术对材料进行细胞水平及分子水平生物活性的检测已被公认为是评价材料生物性能的一种重要手段。人牙髓细胞(human dental Pulp Cells,HDPCs)是牙髓病治疗材料作用的直接效应细胞,易于体外培养获得[3],其中含有一定数目的人牙髓干细胞,其增殖和分化能力很强,它们对材料的反应在一定程度上可以说明材料的性能。
光固化氢氧化钙、三氧化矿物聚合体(MTA)、光固化玻璃离子是三种应用广泛的牙髓根尖周病治疗材料,本课题分别用以上三种材料浸提液体外培养人牙髓细胞,检测材料对细胞增殖的影响,从而研究材料的生物相容性及生物活性。
1. 材料与方法
1.1 材料和仪器
1.1.1 材料来源 培养第5 代的人牙髓细胞(本实验室保存)用做细胞增殖试验,培养第3 代人牙髓细胞做细胞分化试验。
1.1.2 主要仪器 CO2细胞培养箱(LAB 公司,美国)、倒置相差显微镜(Olympus 公司,日本)、超净工作台(苏净集团公司)、离心机(安亭科学仪器公司)、塑料培养皿(海门市康泰实验器材厂)、细胞培养瓶(浙江所华医用塑料有限公司)、培养板(Costar 公司,美国)、酶标仪(BIO-TEK 公司,美国)。
1.1.3 主要试剂 DMEM (Gibco 公司,美国)、胎牛血清(杭州四季青生物材料有限公司)、青链霉素双抗(Sigma 公司,美国)、PBS(Gibco 公司,美国)、D-Hanks(Sigma 公司,美国)、胰蛋白酶(Sigma 公司,美国)、EDTA-2 钠、MTT(Sigma 公司,美国)等。
1.1.4 主要试剂的配制 参照文献[4]制备各生物材料的浸提液。
(1) 光固化Ca(OH)2浸提液制备 光固化Ca(OH)2粉、液按比例以1∶1 调制,严密压制于96 孔板小孔内,制成厚度为1mm 的膜片,在5%CO2、37℃细胞培养箱中静置24h,固化后取出粉碎,称取1g 加入10ml 完全培养液,在5%CO2、37℃细胞培养箱中静置3d,取上清液,配制成标准浸提液,按体积比用含完全培养液稀释成50%、10%过滤除菌,4℃保存备用。
(2)MTA 浸提液的制备 将MTA 粉、液按使用比例以体积比1∶1 调制,严密压制于96 孔板小孔内,制成厚度为lmm 的膜片,在5%CO2、37℃细胞培养箱中静置24h,固化后取出粉碎,称取1g 加入10ml 完全培养液,在5%CO2、37℃细胞培养箱中静置3d,取上清液,配制成标准浸提液,按体积比用含完全培养液稀释成50%、10%过滤除菌,4℃保存备用。
(3)光固化玻璃离子浸提液的制备 取少许LGIC 粉末,加入碘仿,丁香油酚调制成糊剂,压制于96 孔板小孔内,制成厚度为lmm 小膜片,在5%CO2、37℃细胞培养箱中静置24h,取出粉碎,称取lg 加入10ml 完全培养液,在5%CO2、37℃细胞培养箱中静置3d,取上清液,配制成标准浸提液,按体积比用含完全培养液稀释成50%、10%过滤除菌,4℃保存备用。
(4)MTT 测试 50mg MTT+10ml PBS,混匀后过滤除菌,分装,4℃冰箱避光保存。
1.2 实验方法
1.2.1 倒置显微镜观察细胞形态
1.2.2 MTT 法 试验分组如下:hDPCs 实验组(1)10%Ca(OH)2浸提液组;(2)50%Ca(OH)2浸提液组;(3)100%Ca(OH)2浸提液组; (4)10%MTA 浸提液组;(5)50%MTA 浸提液组;(6)100%MTA 浸提液组;(7)10%LGIC 浸提液组;(8)50%LGIC 浸提液组;(9)100%LGIC 浸提液组、空白对照组为完全培养液组。
测定不同浓度的各种材料浸提液对hDPCs 增殖的影响,步骤如下:(1)取第5 代生长良好的hDPCs,等量接种于4 块96 孔板中,接种细胞密度为2×104个/ml,每块板分为10 组,每组5孔,每孔100μl,在5%CO2、37℃的培养箱中培养。(2)培养24h 后换液:吸净原培养液及悬浮的未贴壁细胞,每孔分别加入对应的各组溶液200μl,在5%CO2、37℃的培养箱中继续培养,每3d 换液1 次。(3)在培养的第2d、4d、6d、8d 测量细胞增殖活性。(4)取出培养板,每孔加入MTT 20μl,在5%CO2、37℃浓度的培养箱继续培养4h。(5)弃去孔内液体,每孔加入150μl DMSO,振荡5min。(6)酶标仪测定各孔的OD 值,波长490 nm,每块板测3 次,取平均值做统计学处理。
1.3 统计分析 试验数据采用SPSS l3.0 统计软件进行统计学分析,各数据间的差异显著性用t检测,以P<0.05 为差异具有统计学意义。
2. 结果
2.1 细胞形态观察 倒置显微镜下观察细胞与不同材料浸提液接触培养后细胞形态的变化,参照文献标准[5]对细胞毒性等级按以下标准进行分类(见表1)。

表1 细胞形态观察分析毒性等级细胞形态
以完全培养液作为阴性对照,发现各浓度Ca(OH)2浸提液均属于中度毒性,100%MTA、50%MTA 浸提液、100%LGIC、50%LGIC 属于轻度毒性,10%MTA 组与10%LGIC 浸提液组均属于无毒性。
2.2 细胞增殖分析 三种材料浸提液对细胞增殖作用(MTT 法)人hDPCs 在不同材料浸提液培养下增殖变化(见表2)。
2.2.1 比较浸提液浓度相同的三种根充材料对细胞增殖的影响 统计分析表明,与完全培养液组(对照)相比,当材料浸提液浓度同为10%和50%时,在复合培养的第2d,各个组之间OD 值无明显差别,第4d,第6d 和第8d,Ca(OH)2组细胞OD 值均低于完全培养组(对照组)(P<0.05);各时间点MTA 组、LGIC 组与空白对照组之间OD 值的差异比较无统计学意义(P>0.05);当材料浸提液浓度均为100%时,第2、4、6、8d,Ca(OH)2组细胞OD 值均低于完全培养组(对照组),而MTA 组、LGIC 组与空白对照组之间OD 值比较无统计意义(P>0.05)。
2.2.2 比较三种根充材料浸提液浓度变化对细胞增殖的影响 材料浸提液在低浓度时就能影响细胞的增殖说明该材料毒性较强,而高浓度的材料浸提液对细胞的增殖影响甚小说明该材料无毒性或毒性很小,本研究以低浓度浸提液(10%)为对照,在相同时间点与另外两种高浓度浸提液(50%与100%)统计分析表明,三种材料不同浓度浸提液第2、4、6、8d 细胞的OD 值无明显差异(P>0.05),说明三种材料浸提液浓度的变化对细胞的增殖的无明显影响。
2.2.3 细胞对材料增殖敏感性的比较 分别比较三种材料各浓度浸提液培养下,第2、4、6、8d 细胞OD 值的大小。统计学结果表明hDPCs 分别与三种材料浸提液接触培养后,各时间点OD 值大小差别无统计学意义(P>0.05),说明三种材料在实际应用中或实验中在与细胞接触时,对hDPCs 的增殖敏感性影响无明显差别。
3. 讨论
在牙髓病的治疗中,通常需要治疗材料与周围的组织直接接触,因此治疗材料的性能对于牙髓病的成功及预后、患牙保存、口腔健康具有重要意义。
随着对牙髓根尖周病的深入研究以及口腔材料学的发展,各种生物材料不断涌现。生物材料不仅要符合生物安全性的要求,同时还应该具有良好的生物相容性和生物活性。Ca(OH)2、MTA、LGIC可应用于直接盖髓、活髓切断、髓室底穿孔修补、根管侧穿修补、根尖诱导形成、根尖倒充填等多个治疗领域[6-10]。体外研究Ca(OH)2、MTA、LGIC三种牙髓病治疗材料对牙髓细胞生物学行为的影响及它们的生物活性,探讨它们作用的机制,为进一步全面深入地认识这三种材料的生物性能提供理论依据,也为开发更具生物活性的牙髓治疗材料奠定理论基础。
表2 不同浓度的各种材料浸提液对hDPCs 增殖的影响(MTTOD值)(n=5,±s)
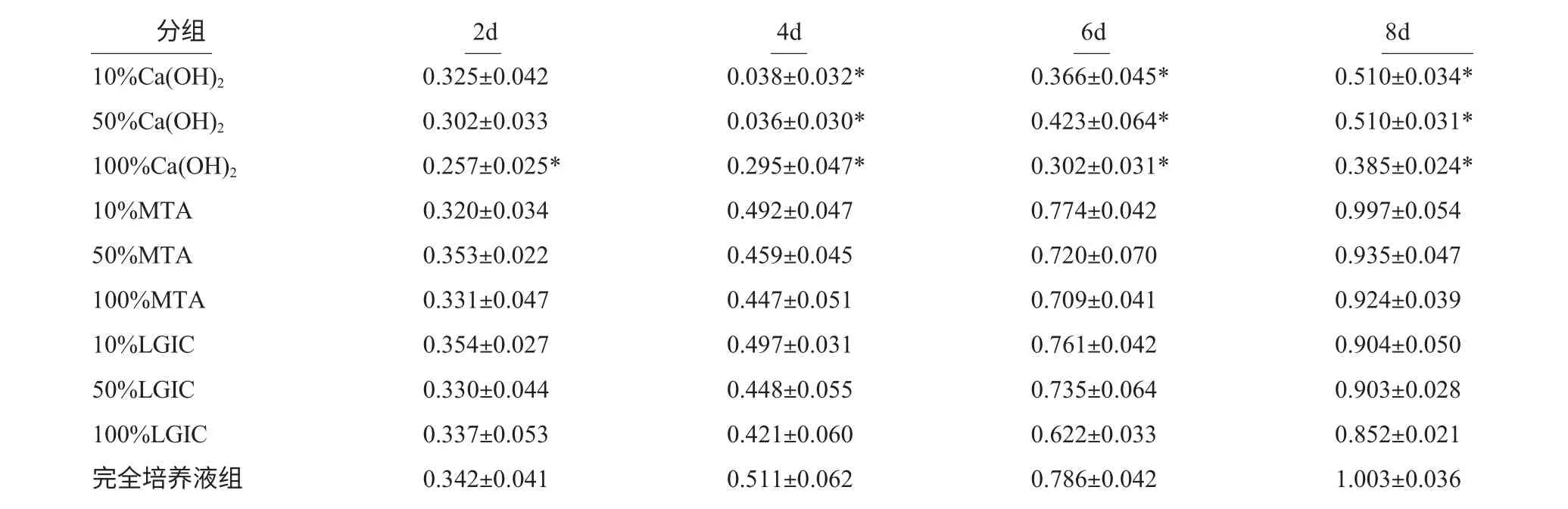
表2 不同浓度的各种材料浸提液对hDPCs 增殖的影响(MTTOD值)(n=5,±s)
*代表在同等时间段,该组数据与完全培养组(对照组)相比差异显著
分组 2d 4d 6d 8d 10%Ca(OH)2 0.325±0.042 0.038±0.032* 0.366±0.045* 0.510±0.034*50%Ca(OH)2 0.302±0.033 0.036±0.030* 0.423±0.064* 0.510±0.031*100%Ca(OH)2 0.257±0.025* 0.295±0.047* 0.302±0.031* 0.385±0.024*10%MTA 0.320±0.034 0.492±0.047 0.774±0.042 0.997±0.054 50%MTA 0.353±0.022 0.459±0.045 0.720±0.070 0.935±0.047 100%MTA 0.331±0.047 0.447±0.051 0.709±0.041 0.924±0.039 10%LGIC 0.354±0.027 0.497±0.031 0.761±0.042 0.904±0.050 50%LGIC 0.330±0.044 0.448±0.055 0.735±0.064 0.903±0.028 100%LGIC 0.337±0.053 0.421±0.060 0.622±0.033 0.852±0.021完全培养液组 0.342±0.041 0.511±0.062 0.786±0.042 1.003±0.036
hDPCs 是牙髓组织中的功能细胞,在牙髓的治疗中通常与直接对材料的生物作用作出反应,因此常作为牙髓生物学、药理学和毒理学等研究领域中的研究对象[11]。
用MTT 法对细胞的增殖进行检测。MTT 法检测结果显示,各浓度的Ca(OH)2对hDPCs 的增殖有明显的抑制,而MTA 与LGIC 对hDPCs 的增殖抑制轻微,浸提液浓度增大时未出现抑制增强。从材料浸提液对细胞增殖的抑制程度来看,Ca(OH)2对细胞增殖抑制较明显,而MTA 与LGIC 对细胞的增殖无明显抑制,材料的生物相容性较好。
本研究通过将三种临床常用的牙髓治疗材料浸提液与体外培养的人hDPCs 接触培养,从细胞水平比较其生物相容性和生物活性。结果表明,Ca(OH)2浸提液对细胞的生长抑制较明显。光固化玻璃离子是一种生物相容性良好的牙髓根尖周病治疗材料,但本研究未发现它有显著抑制hDPCs 活性的现象。MTA 是一种较有发展前景的治疗材料,不但具有良好的细胞生物相容性,而且本实验中也未表现出明显的抑制hDPCs 细胞活性的特征,但MTA 的价格较高,且临床远期疗效尚缺乏大量追踪病例来证明,更重要的是MTA 的作用机制尚不明确,因此仍需要更多深入的研究。
[1] Atari M,Barajas M,Hernandez-Alfaro F. Isolation of pluripotent stem cells from humanthirdmolar dentalpulp[J].Histology and Histopathology ,2011,26(8):1057-1070
[2] Couble ML,Farges JC,Bleicher F,et a1.Odontoblast differentiation of humandental pulp cells in explant cultures[J].CalcifTissue Int,2000,66(2):129-138
[3] 李晓娜,凌均棨.人牙龈上皮细胞上清液对牙髓细胞增殖及分化影响的研究[J].中华老年口腔医学杂志,2007,5(1): 8-11
[4] 苏 勤,叶 玲,周学东.纳米羟磷灰石/ 聚酰胺66 对牙髓细胞生物学作用的实验研究[J].华西口腔医学杂志,2005,23(1):79-83
[5] 奚延裴. 组织工程医疗产品的安全性评价[J]. 现代康复,2001,5(6):3-15
[6] Peters LB,Van Winkeloff AJ,Buys J F. Effects of instrumentation,irrigation,and dressing with calcium hydroxide on infection in pulpless teeth with periapical bone lesions[J].Int Endod J,2002,35(1):13-21
[7] Gomes JA,Geraldes Monteiro B,Melo GB. Corneal reconstruction with tissue-engineered cell sheets composed of human immature dental pulp stem cells[J]. Investigative Ophthalmology &Visual Science,2010,51(3):1408-1414
[8] 刘 琨,潘 涛,杨 鹏,等.三种水门汀粘接纵裂磨牙封闭效果的体外研究[J]. 口腔颌面修复学杂 志,2013,14(2):98-102
[9] Eidelman E, Holan G, Fuks AB, et al. Mineral trioxide aggregates VS. formoc-resol in pulpotomized primary molars:a preliminary report [J].Pediatr Dent,2001,23(1):15-18
[10] Arens DE, Torabinejad M. Repair offurcal perforations with miner altrioxideaggregate:two case reports[J].Oral Surg Oral Med Oral Pathol Oral radiol Endod,1996,82(1):84-88
[11] Shiba H,Fujita T,Doi N,et al. Differential effects ofvarious growth factors andcytokines on the syntheses ofDNA,type I collagen,laminin,fibronectin,osteonectin secreted protein,acidic and rich in cysteine(SPARC), and alkalinephosphatase by human pulp cells in culture[J].Cell Physiol,1998,174(2):194-205

