微杆菌Z4产几丁质酶的发酵条件研究
缑敬轩, 董文宾, 曾 桥
(陕西科技大学 生命科学与工程学院, 陕西 西安 710021)
0 引言
几丁质(Chitin)又称甲壳素、甲壳质,是地球上蕴藏最丰富的有机物之一[1].其水解产物几丁寡糖具有抗真菌、调节机体免疫、抗肿瘤以及抗植物病虫害等功能,已在食品、医药、农业、环保和保健等方面得到广泛应用[2-5].这些几丁质水解产物目前主要用化学降解的方法生产,对环境造成严重的污染.酶降解法则具有条件温和,得率高且无污染等优点,是公认的最佳生产工艺[6].但目前所选菌株产酶能力和酶活性均比较低,不能满足生产的需要,因此几丁质酶在实际中应用程度还并不高[7,8].故筛选产酶量高的菌株,寻找合适的发酵工艺,是微生物产几丁质酶研究的当务之急[9-12].本实验室在前期筛选到的一株几丁质酶高产菌株Z4,初步鉴定属于微杆菌属,本文对其产酶发酵条件进行优化研究,以期提高几丁质酶产量,了解该菌株的特性,为进一步的发酵罐发酵生产该酶和工业化应用提供技术参考.
1 材料与方法
1.1 材料
菌株:菌株Z4,本实验室从土壤中分离获得.
种子培养基和发酵培养基:参照DiPietro的配方[13],稍作改变.KH2PO40.03 g、 K2HPO40.07 g、FeSO4·2H2O 0.001 g、 MgSO4· 7H2O 0.05 g、ZnSO40.000 1 g、胶体几丁质0.2 g、酵母膏0.2 g、水100 mL(pH7.0).
试剂: 几丁质(国药集团化学试剂有限公司),N-乙酰氨基葡萄糖(生工生物工程(上海)有限公司),其余试剂均为国产分析纯.
1.2 实验方法
1.2.1 胶体几丁质的制备
胶体几丁质的制备参考Rodriguez的方法[14],并略作修改:称20 g几丁质加入200 mL浓盐酸,在40 ℃搅拌3 min,使之溶解.溶液中加入2 L 4 ℃的冷水,过滤后的胶体沉淀用蒸馏水洗涤至中性.
1.2.2 单因素实验
菌株活化后,以4%的接种量将种子发酵液接入发酵培养基中,30 ℃,160 rpm恒温培养96 h,每隔24 h取样,测定几丁质酶活性.根据预实验结果,分别考察培养温度、接种量、初始pH和装液量对菌株Z4产几丁质酶的影响.
1.2.3 正交试验
根据单因素试验结果设计正交试验,对以上因素进一步优化.具体因素水平安排见表1.
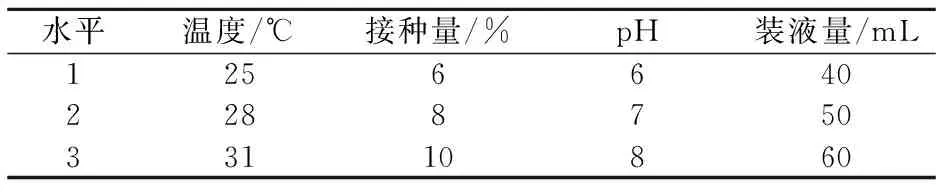
表1 正交试验因素水平表
1.2.4 发酵液酶活测定
参照Antonio的方法[15]:取0.5 mL上清液与0.5 mL 1%胶体几丁质混合,37 ℃恒温30 min,放入沸水浴5 min,立即冷却,并用DNS法[16]测定还原糖.酶活力单位定义为:在上述反应条件下,每分钟释放相当于1μmol NAG所需酶量为1个酶活力单位(U).
2 结果与讨论
2.1 单因素实验
2.1.1 温度对产酶的影响
在其他培养条件不变的情况下,改变培养温度,比较25 ℃,28 ℃,31 ℃,34 ℃,37 ℃ 5个不同培养温度下发酵液酶活的变化.Z4产酶情况如图1所示,由图1可看出,在实验测定的不同发酵时间中,28℃培养的发酵液中产酶量在24 h至48 h增长迅速,此后一直保持最高的酶活,酶活性明显大于其他培养温度.故该培养条件下,最适产酶的温度为28 ℃.

图1 温度对产酶的影响
2.1.2 接种量对产酶的影响
将种子培养液按2%、4%、6%、8%、10%的接种量接入发酵培养基中,其他培养条件不变,每隔24 h测一次发酵液酶活力,结果如图2所示.
由图2可知,接种量为4%时,酶的产量在24~48 h增加最快,且产量最高.但是48 h以后,接种量为8%的发酵液中酶活力迅速增加并在72 h后超过其他几种接种量的发酵液,保持最大产酶量.故选择8%为最适接种量.

图2 接种量对产酶的影响
2.1.3 初始pH对产酶的影响
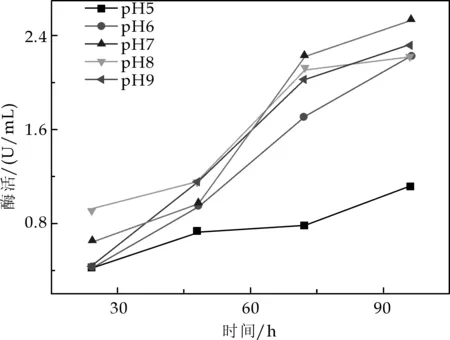
图3 初始pH对产酶的影响
将发酵培养液的起始pH值分别调为5、6、7、8、9,进行摇床发酵培养,每隔24 h测定一次发酵液的酶活力(图3).从图3可看出,pH值为7时,产酶量最高, 达到2.525μ/mL;pH值为6、8和9时,酶产量次之;pH为5时,酶产量最低,而且与其他几种pH值时发酵液酶的产量差距很大.由此看来,pH中性条件适宜菌体产酶,随着pH值的增加或减少都会影响菌体几丁质酶的合成,pH值降低影响更大.
2.1.4 装液量对产酶的影响
在250 mL三角瓶中分别装40 mL、50 mL、60 mL、75 mL、100 mL的发酵培养基,30 ℃恒温培养,每24 h测定发酵液的酶活(图4).结果表明,装液量为50 mL的发酵液在48 h后产酶量高于其他装液量的发酵液,但是差值不是很大.所有装液量的发酵液中,几丁质酶的产量基本保持相同的趋势,即48 h前,增长不明显,48~72 h,酶产量快速增加,而72 h以后,基本趋于稳定.该趋势同Z4生长曲线特征基本一致,说明菌体数量的增加同几丁质酶的合成具有一定的相关性.这是因为在发酵培养基中几丁质为微生物的生长提供碳源,Z4需要通过几丁质酶系的作用才能把几丁质降解为可以吸收利用的寡糖或单糖,因此几丁质酶的产量影响菌株对碳源的利用,进而影响菌体生长.

图4 装液量对产酶的影响
2.2 正交试验
根据单因素实验结果,设计四因素三水平正交试验确定Z4发酵产几丁质酶的最佳条件,利用正交设计助手ⅡV3.1,对正交结果进行极差分析和方差分析.试验结果和分析见表2和表3.
极差分析表明,对酶产量影响最大的因素为温度,其次为pH,接种量和装液量影响最小.其中温度对酶产量影响明显大于其他三个因素.方差分析也证明四个因素中只有温度对酶产量的影响具有显著性,与极差分析结果一致.

表2 L9(34)正交试验结果和极差分析
正交试验结果表明,Z4产几丁质酶的最佳条件为A2B1C2D3,即培养温度28 ℃,起始pH为7,装液量60 mL,接种量为6%.

表3 L9(34) 正交试验方差分析表
3 结论
本研究在单因素实验的基础上,通过三因素四水平的正交试验确定Z4产几丁质酶的最佳发酵条件为:培养温度为28 ℃,培养基初始pH为7,接种量为6%,三角瓶装液量为60 mL培养基/250 mL三角瓶.在该发酵条件下,所得发酵液酶产量达到4.13 U/mL,与优化前的酶产量2.3 U/mL相比,提高了79.6%.
该菌株虽然经过条件优化,产酶能力显著增加,但距离工业化应用还有一定差距.作为一株野生型菌株,同其他已经报道的野生型菌株一样产酶能力还达不到实际应用的要求,都需要进一步诱变育种或基因改造.该菌株相对较高的产酶能力保证其可以作为一个优良的出发菌株进行诱变育种或杂交育种的亲本.本实验通过对温度、pH、转速、装液量等不同发酵条件的组合优化,初步掌握了该菌株适合的培养条件,为进一步的育种提供依据.
[1] 王爱勤.甲壳素化学[M].北京:科学出版社,2008.
[2] 杨雪松,李 丽,刘红全.海洋微生物几丁质酶的研究进展[J].安徽农业科学,2011,39(16):9 481-9 485.
[3] 缑敬轩,董文宾,曾 桥.一株可降解几丁质的Bacillus sp D23的分离和筛选[J].陕西科技大学学报,2011,30(2):32-35.
[4] Patil N S,Waghmare S R,Jadhav J P.Purification and characterization of an extracellular antifungal chitinase from Penicillium ochrochloron MTCC 517 and its application in protoplast formation[J].Process Biochemistry,2013,48(1):176-183.
[5] 张利平.几丁质酶及其在农业生产中的应用[J]. 浙江柑橘,2013,30(2):11-13.
[6] 薛永常,张 灿.1株产几丁质酶海洋细菌Z-1的分离与鉴定[J].微生物学杂志,2013,33(3):58-62.
[7] 杨绍青,张舒平,闫巧娟,等.高产几丁质酶高温紫链霉菌的筛选和发酵条件优化[J].中国农业大学学报,2013,18(2):167-173.
[8] 施腾鑫,刘 嘉,贺淹才.粘质沙雷氏菌产几丁质酶的发酵工艺优化[J].华侨大学学报(自然科学版),2010,31(6):667-670.
[9] Song Y S,Oh S,Han Y S,et al.Detection of chitinase ChiA produced by serratia marcescens PRC-5,using anti-PrGV-chitinase[J].Carbohydrate Polymers,2013,92(2): 2 276-2 281.
[10] Singh R K,Kumar D P,Solanki M K,et al.Optimization of media components for chitinase production by chickpea rhizosphere associated Lysinibacillus fusiformis B-CM18[J].Journal of Basic Microbiology,2013,53(5):451-460.
[11] 王振东,罗春艳,杨 晨,等.海洋细菌QDC01的鉴定及其几丁质酶基因的克隆与分析[J].农业生物技术学报,2013,21(6):734-744.
[12] 王慧敏,祖国仁,尹 璐,等.响应面法优化海洋细菌产几丁质酶培养条件[J].中国酿造,2012,31(2):103-106.
[13] Di Pietro A,Lorito M,Hayes C K,et al.Endochitinase from gliocladium virens:isolation,characterization,and synergistic antifungal activity in combination with gliotoxin[J].Phytopathology,1993,83:308-312.
[14] Rodriguez K, Godoy Q,Morgan J,et al.The determination of soil chitinase activity:Conditions for assay and ecological studies[J].Plant and Soil,1983,75(1):95-106.
[15] Antonio Romaguera,Utrich Menge,Roland Breves,et al.Chitinases of streptomyces olivaceoviridis and significance of processing for multiplicity[J].Journal of Bacteriology,1992,174(11):3 450-3 454.
[16] 宋宏新,李敏康.现代生物化学实验技术教程[M].西安:陕西人民出版社,2002.

