唾液乳杆菌BSH1及其突变体的底物特异性
毕洁,方芳,仇钰莹,杨庆利,陈坚,2
1 江南大学生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122 2 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122 3 山东省花生研究所,山东 青岛 266100
血清中高胆固醇含量是诱发高血压、冠心病等心血管疾病的重要因素。研究发现,服用益生菌及相关制品具有减少人体血清胆固醇含量,降低心血管疾病发病率的功效,这与益生菌所产生的胆盐水解酶 (Bile salt hydrolase,BSH,EC 3·5·1·24) 密切相关[1-2]。胆盐水解酶是由bsh基因编码的一种胞内酶,是肠道微生物为了抵抗胆盐得以生存而产生的一种代谢产物,它属于氨基末端亲核水解酶类 (N-terminal nucleophile,Ntn) 中的甘氨胆酰水解酶家族[3]。该酶能够水解肠道内的结合胆盐形成氨基酸和游离胆汁酸,经BSH酶作用后产生的去结合型胆盐比结合型胆盐重吸收效率低,导致大量的去结合型胆盐从粪便中排出,而胆固醇的主要去路是转变成胆酸,因此通过胆盐水解酶的水解作用可以使胆固醇不断向合成结合胆盐的方向进行以保证肠道内结合胆盐与脂质物质的平衡,从而消耗体内更多的胆固醇,达到降低血清胆固醇的目的[4-5]。
健康人体的胆汁中,胆汁酸按结构 (图1)[6]可分为两大类[7-8]:一类为游离型胆汁酸 (Free bile acid),包括胆酸 (Cholic acid, CA)、脱氧胆酸 (Deoxycholic acid, DCA)、鹅脱氧胆酸(Chenodeoxycholic acid, CDCA) 和少量的石胆酸 (Lithocholicacid, LCA);另一类为结合型胆汁酸 (Conjugated bile acid),主要包括甘氨胆酸(Glycocholic acid, GCA)、甘氨脱氧胆酸(Glycodeoxycholic acid, GDCA)、甘氨鹅脱氧胆酸 (Glycochenodeoxycholic acid, GCDCA)、牛磺胆酸 (Taurocholic acid, TCA)、牛磺脱氧胆酸(Taurodeoxycholic acid, TDCA) 及牛磺鹅脱氧胆酸 (Taurochenodeoxycholic acid, TCDCA)等。研究表明,人体内6种主要的结合胆盐和3种胆酸分别参与了不同的代谢活动,通过激活不同的信号传导途径,可以分别起到调节体内能量代谢平衡、控制肥胖的作用以及抑制肠道细菌过度增殖等作用。其中,GCA能够显著抑制IgM和IgG 的含量,并增加IL-2及TNF-A的含量,提高CD4+/CD8+的比值,提高非特异体性免疫功能[9]。Boever 等猜测 GDCA 与TDCA的对胆酸的高效率解离可能是使胆汁酸的毒性降低的重要原因[10]。GCDCA可诱导原代培养的大鼠肝细胞凋亡,这为临床治疗胆汁淤积性肝病提供了新的思路和理论基础[11-12]。TCDCA可通过减少NO和LTB4的产生,直接发挥抗炎作用[13]。此外Wenger等发现TCDCA能够促进乳糖苷神经酰胺 β-半乳糖苷酶的活性,这对研究克拉贝氏病具有指向性意义[14-15]。因此,通过胆盐水解酶的水解作用,影响胆汁酸的组成和流量对于治疗高胆固醇相关的糖尿病、肥胖症及与此相关的代谢类疾病,维护人类健康有重要的意义。
目前已有多种微生物的BSH同工酶得到了纯化、鉴定、克隆以及异源表达[16-24]。虽然不同的微生物产生的胆盐水解酶都能够水解结合胆盐,但由于氨基酸序列的差异导致此类同工酶底物特异性及酶活性的差异。本研究的前期工作发现位于唾液乳酸杆菌Lactobacillus salivariusLMG14476的巨大质粒的胆盐水解酶BSH1具有广泛的底物特异性,但对不同底物的活性却有所差异[25]。因此,本文以大肠杆菌的表达系统为分子改造平台,通过理性设计及分子改造技术鉴定出与酶特性相关的关键残基和结构元件,为提高该酶的底物特异性,阐明其催化机制和作用机理,开发应用其潜在的生理功能,使其更好地在医药领域发挥作用奠定理论基础。

图1 人体中几种主要的胆汁酸结构[6]Fig. 1 Structures of several major bile acids in the human body[6].
1 材料与方法
1.1 菌株与质粒
大肠杆菌Escherichia coliJM109用于构建和增殖重组质粒,本研究室保存。
Escherichia coliBL21(DE3)为表达宿主,本研究室保存。
重组质粒pET201,特点Ampr,bsh1,pelB信号肽,pET-20b(+)的衍生质粒,C末端融合组氨酸标签,T7启动子,本研究室构建。
1.2 酶及主要试剂
甘氨酸结合胆盐 (GCA)、甘氨脱氧结合胆盐 (GDCA)、甘氨鹅脱氧结合胆盐 (GCDCA)、牛磺结合胆盐 (TCA)、牛磺脱氧结合胆盐(TDCA)、牛磺鹅脱氧结合胆盐 (TCDCA) 均购自Sigma公司。DNA片段回收试剂盒、胶回收试剂盒、连接酶 (SolutionⅠ)、定点突变试剂盒(TaKaRa MutanBEST Kit)、感受态制备试剂盒、DNA marker均购自TaKaRa公司。2×TaqPCR MasterMix购自天根生化科技(北京)有限公司。质粒小量提取试剂盒、氨苄青霉素 (Amp)、异丙基-β-D-硫代吡喃半乳糖苷 (IPTG) 购自上海生物工程有限公司。标准分子量蛋白及SDS-PAGE试剂盒购自碧云天生物技术研究所。其他试剂均为国产分析纯。
1.3 培养基
LB培养基(g/L):蛋白胨10,酵母膏5,NaCl 10,pH 7.0;121 ℃湿热灭菌15 min;配制固体培养基则加入2%琼脂。
1.4 引物设计及目的片段的扩增
以重组质粒pET201为模板,利用 Primer 5软件设计互补引物,参照定点突变试剂盒的操作手册通过 PCR扩增 BSH1突变体的基因序列。定点突变的引物设计如表 1所示,由上海生物工程技术服务有限公司合成引物。反应体系如下:5 μL 10×PyrobestBufferⅡ,8 μL dNTPs(各 2.5 mmol/L),0.2 μL 模板 DNA,1 μL 正向引物,1 μL 反向引物,0.25 μLPyrobestDNA Polymerase (5 U/µL),补加双蒸水至 50 μL。反应条件:95 ℃预变性 5 min;94 ℃变性 30 s,按各引物对的Tm退火30 s,72 ℃延伸5 min,共30个循环;72 ℃再延伸10 min。PCR产物经1%琼脂糖凝胶电泳进行鉴定。
1.5 表达载体的构建
PCR产物经胶回收纯化后,经末端平滑化及5′末端磷酸化后,于16 ℃连接1 h,连接液转化至感受态细胞E.coliTop10,筛选阳性重组子,小量提取质粒,进行PCR鉴定。反应体系:12.5 μL 2×MasterMix,0.1 μL 模板 DNA,1 μL 正向引物B1u,1 μL 反向引物B1d,补加双蒸水至 25 μL。反应条件:94 ℃预变性 3 min;94 ℃变性 30 s,58 ℃退火 30 s,72 ℃延伸 1 min 20 s,共25个循环;72 ℃再延伸10 min。PCR产物经1%琼脂糖凝胶电泳进行鉴定。阳性质粒送上海生物工程技术服务有限公司测序。
Supported by:National Natural Science Foundation of China (No. 31100064), the Priority Academic Program Development of Jiangsu Higher Education Institutions.
Corresponding author:Jian Chen. Tel: +86-510-85918312; Fax: +86-510-85918309; E-mail: jchen@jiangnan.edu.cn
国家自然科学基金 (No. 31100064),江苏省优势学科建设工程项目资助。
1.6 目的基因的诱导表达
将重组质粒转化感受态E.coliBL21(DE3),挑取单个菌落,接种于氨苄青霉素终浓度为100 μg/mL的LB培养基中,37 ℃、200 r/min培养 12 h。将种子液以 2%的接种量转接于25 mL含100 μg/mL氨苄青霉素的LB培养基中,于37 ℃、200 r/min条件下振荡培养至菌体浓度OD600值为 0.5−0.6时,加入终浓度为0.1 mmol/L的 IPTG进行诱导,于 20 ℃、200 r/min条件下继续培养至发酵结束。取一定量的菌液 (OD600=1),经8 000 r/min、4 ℃离心10 min,弃上清,菌体沉淀用预冷的磷酸盐缓冲液 (20 mmol/L,pH 7.0) 洗涤两次后,菌体细胞用于12% SDS-PAGE电泳分析。剩余菌液重复上述操作后,菌体细胞用1/10体积预冷的结合缓冲液(3.8 mmol/L Na2HPO4,16.2 mmol/L NaH2PO4,500 mmol/L NaCl,20 mmol/L 咪唑,pH 7.4)重悬,于冰浴中用超声波破碎仪破壁 (工作时间:间歇时间=1:2) 30 min,15 000 r/min、4 ℃离心20 min后取上清,得到无细胞提取物用于12% SDS-PAGE分析。

表1 定点突变引物序列Table 1 Primer used for construction of site-directed mutations

1.7 胆盐水解酶及突变体的纯化
将无细胞提取物经 0.22 μm 膜过滤后注入经结合缓冲液平衡的亲合层析柱,并用结合缓冲液洗去未结合蛋白;随后以0−500 mmol/L洗脱缓冲溶液(3.8 mmol/L Na2HPO4,16.2 mmol/L NaH2PO4,500 mmol/L NaCl,500 mmol/L 咪唑,pH 7.4)进行梯度洗脱,流速为1 mL/min,收集含有BSH1蛋白的部分。
1.8 BSH1及其突变体的活性分析
1.8.1 酶活定性检测
将含有转化子的菌液取5 μL转接到分别含有 1% (W/V) 猪胆盐 (Porcine bile) 的LB固体平板 (含 100 μg/mL 氨苄青霉素和 24 μg/mL IPTG) 上,通过是否产生白色或透明沉淀圈验证 BSH1及其突变体的活性,如果产生了沉淀圈,即说明具有胆盐水解酶的活性。
1.8.2 底物特异性分析
取适量酶液与磷酸盐缓冲液(20 mmol/L,pH 6.0)混合,使酶在反应体系中的终浓度为10 μg/mL,分别以6种结合胆盐TCA、TDCA、TCDCA、GCA、GDCA和GCDCA作为反应底物,反应体系中底物的终浓度为30 mmol/L,在37 ℃温育30 min,加入等体积的三氯乙酸(15%,W/V)终止反应,12 000 r/min离心 5 min,取10 μL上清液加入190 μL茚三酮反应试剂,100 ℃煮15 min后,迅速冷却至室温,于紫外可见分光光度计中测定570 nm的光吸收,通过甘氨酸标准曲线换算得到氨基酸的含量。1个单位的酶活力定义为:37 ℃下每分钟催化底物生成1 μmol氨基酸的酶量(U/mL)。
2 结果与分析
2.1 同源建模
在目的蛋白缺少晶体结构的前提下,根据已知晶体结构的同源蛋白,模拟目的蛋白的结构是一种有效的策略。本文利用在线软件SWISS-MODEL,以已报道的产气荚膜梭菌Clostridiumperfringens来源的CBAH mutant晶体结构(PDB No. 2rf8B)为模板[26](两者氨基酸序列同源性为35.168%),模拟得到L.salivariusBSH1 (LsBSH1)的晶体结构(图2)。胆盐水解酶BSH1的晶体结构显示,N-末端亲核水解酶家族所共有高保守性氨基酸位点 Cys2位于 N-末端酰胺键亲核攻击的位置上,被认为是在脱蛋氨酸以后的蛋白自动水解过程中的接触反应中心[27-29]。前人对双歧杆菌胆盐水解酶Cys2的研究表明,该位点的突变将显著影响 BSH对GDCA的水解活性,但并未考察其突变体对其他底物的水解能力。因此,为了考察处于疏水腔中心的高保守性氨基酸位点Cys2对BSH1底物特异性的影响,我们对其进行点突变。此外,在高保守性活性位点Cys2的周围有5个loop,分别是 loop 21–26、loop 79–84、loop 133–138、loop 256–264 和 loop 267–270。这些 loop 位于疏水腔入口处,将 Cys2埋在疏水腔中。根据L.salivariusBSH1的 5个 loop中的氨基酸与C.perfringensCBAH突变体的保守性以及氨基酸残基的极性,预测可能影响底物特异性的结合位点分别为 loop 21–26上的 Asp21、loop 79–84上的 Asn79和 Phe80、loop 126–138上的Ala137、loop 256–264上的 Thr264以及 loop 267–270 上的 Glu269。
2.2 LsBSH1突变体的构建
为了研究预测位点与底物结合作用的相关性,通过定点突变分别对预测氨基酸位点Asp21进行丙氨酸替换突变,即将Asp21经Ala替换为 D21A。对预测氨基酸位点Ala137进行丝氨酸替换突变,即将Ala137经Ser替换为A137S。通过Ala或Ser替换去除氨基酸侧链对底物的结合作用,进而研究各位点对 BSH1底物特异性的作用。
以含有bsh1的重组质粒pET201为模板,PCR扩增出含有编码 BSH1的 7种突变体BSH1C2S、BSH1D21A、BSH1N79A、BSH1F80A、BSH1A137S、BSH1T264A和BSH1E269A的表达质粒基因序列 (图3)。
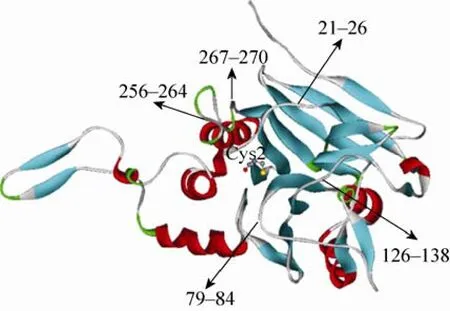
图2 同源建模L. salivarius BSH1的晶体结构Fig. 2 Homology modeling of the crystal structure of L. salivarius BSH1.
Received:October 10, 2013; Accepted: December 30, 2013
Supported by:National Natural Science Foundation of China (No. 31100064), the Priority Academic Program Development of Jiangsu Higher Education Institutions.
Corresponding author:Jian Chen. Tel: +86-510-85918312; Fax: +86-510-85918309; E-mail: jchen@jiangnan.edu.cn
国家自然科学基金 (No. 31100064),江苏省优势学科建设工程项目资助。

图3 LsBSH1突变体PCR扩增产物核酸电泳图Fig. 3 Amplification of pET201 derivatives for construction of LsBSH1 mutants. M1: DL5000 DNA marker; M2:Trans5K DNA marker; 1–7: BSH1D21A, BSH1N79A, BSH1F80A, BSH1A137S, BSH1T264A, BSH1E269A and BSH1C2S.
将7种突变体的PCR产物分别经过末端平滑化及磷酸化处理后,连接转化至E.coliJM109,挑选克隆子进行菌落PCR验证,如图4所示,根据目的产物条带与预测大小 1 200 bp相符,筛选得到阳性克隆,并进行测序,获得最终测序正确的转化子。
2.3 LsBSH1及7种突变体的表达与纯化
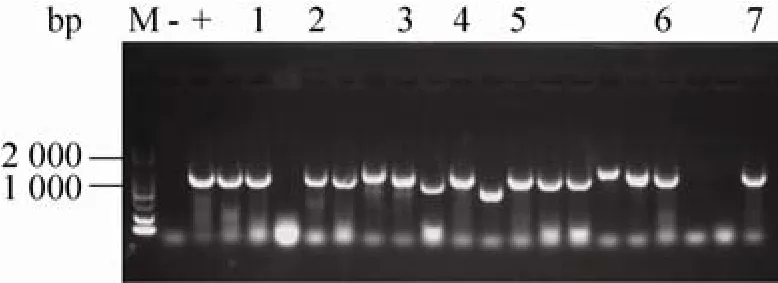
图4 菌落PCR验证阳性克隆Fig. 4 Verification of positive clones via colony PCR.M: DL2000 DNA marker; -: negative control; +: positive control; 1–7: PCR products of E. coli JM109 strains harboring positive clones of BSH1D21A, BSH1N79A,BSH1F80A, BSH1A137S, BSH1T264A, BSH1E269A and BSH1C2S.
对得到的转化子进行发酵,收集的菌体细胞经超声破壁后,对细胞内上清液进行SDS-PAGE蛋白电泳 (图5A)。图5B为纯化后的蛋白电泳图。结果显示 BSH1及突变体经表达及纯化后得到分子量均为37 kDa的目的条带,经Ni2+亲和柱层析后可以得到纯度较高的 BSH1及其突变体酶蛋白。并且根据所有重组菌在含有猪胆盐的LB平板上所出现的沉淀圈可知,BSH1的突变体均具有BSH活性,因此,我们继续考察了 BSH1及其突变体分别对 6种结合胆盐的水解活性。
2.4 LsBSH1及其突变体的底物特异性分析
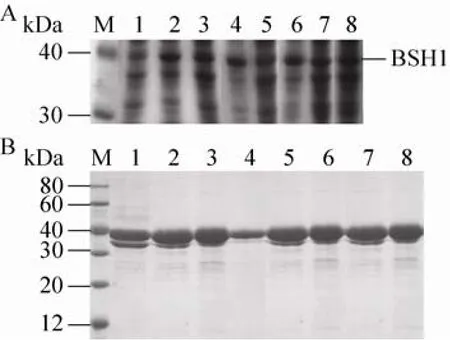
图5 LsBSH1及其突变体的表达与纯化Fig. 5 Expression and purification of LsBSH1 and its mutants in E. coli. (A) Expression of LsBSH1 and its mutants in E. coli. (B) Purification of LsBSH1 and its mutants. M: protein marker; 1–8: BSH1D21A,BSH1N79A, BSH1F80A, BSH1A137S, BSH1T264A,BSH1E269A, BSH1C2S and BSH1.
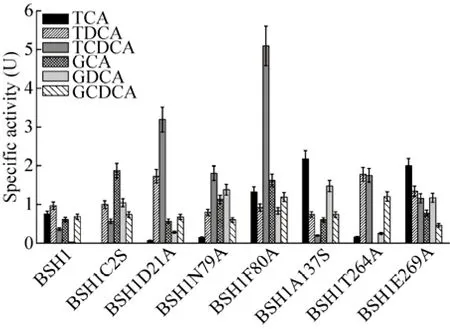
图6 LsBSH1及其突变体的底物特异性Fig. 6 Substrate specificities of LsBSH1 and its mutants.
分别以6种结合胆盐TCA、GCA、TDCA、GDCA、TCDCA和GCDCA为底物,测定纯化后的BSH1及其突变体BSH1C2S、BSH1D21A、BSH1N79A、BSH1F80A、BSH1A137S、BSH1T264A和BSH1E269A对6种结合胆盐的水解能力。结果如图6所示。结果表明,对BSH1的 Cys2和 Thr264的位点突变分别导致 BSH1对TCA和GCA失去水解活性,并且与原始的重组BSH1相比,对BSH1的Cys2的位点突变导致BSH1对GCA和GDCA的水解活性提高,而对TDCA、TCDCA和GCDCA的水解活性变化不明显;对BSH1的Asp21的位点突变会引起BSH1水解TCA的活性降低,水解GDCA和TCDCA的活性增加,对TDCA、GCA和GCDCA的水解活性变化不显著;Asn79的位点突变对BSH1水解TDCA和GCDCA的能力改变不明显,但对其水解TCA、GCA、GDCA和TCDCA的活性影响较为显著;除了对TDCA的水解能力变化不明显外,Phe80的位点突变均会引起BSH1对其余 5种结合胆盐水解能力的改变;Ala137的位点突变仅引起 BSH1对 TCA和GDCA水解活性的提高;Thr264的位点突变导致 BSH1对 6种结合胆盐的水解活性都发生不同程度的改变,其中对固醇核基团是 DCA和CDCA的结合胆盐的水解活性提高,对固醇核基团是 CA的结合胆盐水解活性降低;Glu269的位点突变引起 BSH1对 6种结合胆盐的水解活性不同程度增加。
通过以上对突变体的活性分析,我们可知Cys2和Thr264分别是催化TCA和GCA的关键残基,对催化活性的保持具有关键作用,并且由此可以判断高保守性的氨基酸位点Cys2不是BSH1唯一的活性位点,针对不同的结合胆盐,BSH1的活性位点可能不同,这些活性位点共同构成了BSH1的催化中心。同时,7个氨基酸位点均会不同程度地影响 BSH1对不同结合胆盐的水解活性,其作用可能是它们作为的结合位点参与了底物的结合,也可能是其影响了底物进入活性中心的通道或底物结合口袋的体积与形状,进而影响了 BSH1对不同结合胆盐的水解活性。
3 讨论
以产气荚膜梭菌ClostridiumperfringensCBAH突变体 (PDB No. 2rf8B) 的晶体结构作为模板,对L.salivariusBSH1的晶体结构进行同源建模,通过理性设计对L.salivariusBSH1参与底物结合的重要氨基酸位点进行预测。采用定点突变策略成功构建了BSH1的7种突变体。根据突变体的表达宿主的表现型分析可知,在含有混合结合胆盐的 LB平板上均呈现不同程度的沉淀圈,说明 7种突变体对结合胆盐均有活性,但是在不同程度上影响了BSH1的活性。BSH1及其突变体的底物特异性分析说明,Cys2和Thr264分别是催化TCA和GCA的关键残基,对催化活性的保持具有关键作用,且高保守性的氨基酸位点Cys2可能不是BSH1唯一的活性位点,而 7种突变体对不同的结合胆盐呈现不同的水解活性,原因是预测的氨基酸位点可能作为 BSH1的结合位点参与了底物的结合,也可能是其影响了底物进入 BSH1活性中心的通道或底物结合口袋的体积与形状,进而影响了BSH1对不同结合胆盐的水解活性。
上述研究表明,基于分子模拟及结合位点的预测对 BSH1酶分子功能进行改造的方法具有可行性。在后续研究中可通过了解酶与底物的相互作用以及酶蛋白本身氨基酸间的相互作用,利用蛋白质结构信息将氨基酸研究位点缩小到有效的范围内,从而提高酶功能改造的成功率,提高BSH的底物特异性选择,阐明其催化机理、作用机制,拓展其在医药领域的应用。
[1]Begley M, Gahan CGM, Hill C. The interaction between bacteria and bile. FEMS Microbiol Rev,2005, 29(4): 625–651.
[2]Jones ML, Tomaro-Duchesneau C, Martoni CJ, et al. Cholesterol lowering with bile salt hydrolase-active probiotic bacteria, mechanism of action, clinical evidence, and future direction for heart health applications. Expert Opin Biol Ther,2013, 13(5): 631–642.
[3]Patel AK, Singhania RR, Pandey A, et al. Probiotic bile salt hydrolase: current developments and perspectives. Appl Biochem Biotechnol, 2010, 162:166–180.
[4]Lu TT, Makishima M, Repa JJ, et al. Molecular basis for feedback regulation of bile acid synthesis by nuclear receptors. Mol Cell, 2000, 6(3): 507–515.
[5]Philipp B. Bacterial degradation of bile salts. Appl Microbiol Biotechnol, 2011, 89: 903–915.
[6]Kyoto encyclopedia of genes and genomes database[EB/OL]. [2013-01-29]. http://www.genome.jp/kegg/ (in Chinese).
京都基因和基因组百科全书数据库[EB/OL].[2013-01-29]. http://www.genome.jp/kegg/.
[7]Sharma KR. Review on bile acid analysis. Int J Pharm Biomed Sci, 2012, 3(2): 28–34.
[8]Huang XL. Bile acid metabolism and its clinical applications. Clin Focus, 1986, 1(Z1): 75–78 (in Chinese).
黄贤磷. 胆汁酸代谢及其临床应用. 临床荟萃,1986, 1(Z1): 75–78.
[9]Li PF, Zhao Z, Guan H, et al. Eeffect of glycocholic acid on immune function in mice. Chin J Vet Med, 2007, 43(10): 6–8 (in Chinese).
李培锋, 赵珍, 关红, 等. 甘氨胆酸对小鼠免疫功能的影响. 中国兽医杂志, 2007, 43(10): 6–8.
[10]Boever PD, Verstraete W. Bile salt deconjugation byLactobacillusplantarum80 and its implication for bacterial toxicity. J Appl Microbiol, 1999,87(3): 345–352.
[11]Chuan LM, Huang WF, Zeng YL, et al. Changes in caspase-3,9 activity and mRNA expression of normal human hepatocyte HL-7702 cell in the process of apoptosis induced by glycodeoxycholate.Chin J Clin Hepatol, 2008, 24(1): 28–31 (in Chinese).
传良敏, 黄文方, 曾娅莉, 等. 甘氨脱氧胆酸盐诱导人正常肝细胞株 HL-7702凋亡过程中caspase3,9活性与mRNA表达水平变化. 临床肝胆病杂志, 2008, 24(1): 28–31.
[12]Woudenberg-Vrenken TE, de la Rosa LC,Buist-Homan M, et al. Metformin protects rat hepatocytes against bile acid-induced apoptosis.PLoS ONE, 2013, 8(8): e71773.
[13]Li PF, He XL, Guan H, et al.Taurochenodeoxycholic acid (TCDCA)anti-inflammatory mechanism. Chin J Vet Sci,2008, 28(11): 1317–1320 (in Chinese).
李培锋, 何秀玲, 关红, 等. 牛磺鹅去氧胆酸的抗炎作用机理. 中国兽医学报, 2008, 28(11):1317–1320.
[14]Wenger DA, Sattler M, Clark C. Effect of bile salts on lactosylceramide β-galactosidase activities in human brain, liver and cultured skin fibroblasts.Biochim Biophys Acta, 1975, 409(3): 297–303.
[15]Renga B, Mencarelli A, D'Amore C, et al.Discovery that theonellasterol a marine sponge sterol is a highly selective FXR antagonist that protects against liver injury in cholestasis. 2012,PLoS ONE, 7(1): e30443.
[16]Rashmi GS, Phillip BH. Cloning and characterization of a conjugated bile acid hydrolase gene fromClostridiumperfringens. Appl Environ Microbiol, 1995, 61(7): 2514–2520.
[17]Tanaka H, Hashiba H, Kok J, et al. Bile salt hydrolase ofBifidobacteriumlongum-biochemical and genetic characterization. Appl Environ Microbiol, 2000, 66(6): 2502–2512.
[18]Sridevi N, Vishwe P, Prabhune A, et al.Hypocholesteremic effect of bile salt hydrolase fromLactobacillusbuchneriATCC 4005. Food Res Int, 2009, 42: 516–520.
[19]Saavedra L, Taranto MP, Sesma F, et al.Homemade traditional cheeses for the isolation of probioticEnterococcus faeciumstrains. Int J Food Microbiol, 2003, 88: 241–245.
[20]Dussurget O, Cabanes D, Dehoux P, et al.Listeria monocytogenesbile salt hydrolase is a PrfA-regulated virulence factor involved in the intestinal and hepatic phases of listeriosis. Mol Microbiol, 2002, 45(4): 1095–1106.
[21]Sridevi N, Srivastava S, Khan BM, et al.Characterization of the smallest dimeric bile salt hydrolase from a thermophileBrevibacillussp..Extremophiles, 2009, 13: 363–370.
[22]Ren J, Sun KJ, Wu ZJ, et al. All 4 Bile salt hydrolase proteins are responsible for the hydrolysis activity inLactobacillusplantarumST-III. J Food Sci, 2011, 76(9): 622–628.
[23]Delpino MV, Marchesini MI, Estein SM, et al. A bile salt hydrolase ofBrucella abortuscontributes to the establishment of a successful infection through the oral route in mice. Infect Immun, 2007,75(1): 299–305.
[24]Jarocki P. Molecular characterization of bile salt hydrolase fromBifidobacteriumanimalissubsp.lactisBi30. J Microbiol Biotechnol, 2011, 21(8):838–845.
[25]Bi J, Fang F, Lu SY, et al. New insight into the catalytic properties of bile salt hydrolase.J Mol Catal B-Enzym, 2013, 96: 46–51.
[26]Rossocha M, Schultz-Heienbrok R, H von Moeller,et al. Conjugated bile acid hydrolase is a tetrameric N-terminal thiol hydrolase with specific recognition of its cholyl but not of its tauryl product. Biochem,2005, 44(15): 5739–5748.
[27]Niu ZX, Liu EM, Li XD, et al. Study progress of the bile salt hydrolyses enzymes (BSHs)in vivo.Chin Dairy Ind, 2007, 35(9): 35–40 (in Chinese).
牛治霞, 刘恩梅, 李晓东, 等. 益生菌中胆盐水解酶(BSHs)研究进展. 中国乳品工业, 2007,35(9): 35–40.
[28]Ren J, Wu ZJ, Wang YY. Research progress on mechanism of bile salt hydrolase in probiotics.Chin Dairy Ind, 2010, 38(2): 45–51 (in Chinese).
任婧, 吴正钧, 王荫榆. 益生菌中胆盐水解酶作用机理研究现状. 中国乳品工业, 2010, 38(2): 45–51.
[29]Guo CF, Zhang LW. Cholesterol-lowering effects of probiotics—a review. Acta Microbiol Sin, 2010,50(12): 1590–1599 (in Chinese).
郭春锋, 张兰威. 益生菌降胆固醇功能研究进展.微生物学报, 2010, 50(12): 1590–1599.

