紫杉醇组合生物合成的研究进展
李杰,王春梅
北京中医药大学生物制药系,北京 100102
紫杉醇 (Paclitaxel,商标名为 Taxol) 是 20世纪70年代由Wani等从Taxus brevifoliaNutt树皮中提取出来的具有独特抗癌作用的天然产物。从1992年获得美国FDA认证以来,紫杉醇以其对乳腺癌、卵巢癌和非小细胞肺癌等多种癌症的疗效,成为化疗的首选药物。直接从红豆杉树皮中提取紫杉醇产量极低,每3 kg树皮只能提取约300 mg的紫杉醇[1],因此,通过直接提取获得数量可观的紫杉醇将对红豆杉造成毁灭性的影响。目前紫杉醇的药源主要来自化学半合成,但化学半合成法产率和选择性不高,代价昂贵,而且原料依然来自植物组织,对提高紫杉醇产量造成一定限制[2]。获得紫杉醇的途径还有化学全合成、植物细胞培养或内生真菌的培养。植物细胞培养的方法稳定性低、放大培养困难且目的产物含量低,目前还没有工业化的报道[3-5]。化学全合成的方法产率低,很难应用于工业生产[2,6-19]。内生真菌生产虽具有生产周期短、操作简单的优势,但产量低、不稳定的问题亟待解决[20]。自从青蒿素的组合生物合成取得巨大进展[21],紫杉醇的生物合成途径逐渐阐明,人们对利用组合生物合成的方法获得紫杉醇也寄予厚望。研究人员已经在大肠杆菌、酵母、小立碗藓、拟南芥、番茄和人参等体系对紫杉醇的组合生物合成进行了探索,对各个体系的研究均取得了一定的成果。本文以不同体系为线索综述了紫杉醇组合生物合成的研究进展,并探讨了未来可能的研究方向和方法,希望最终实现紫杉醇组合生物合成的产业化。
紫杉醇的生物合成过程已基本清楚[22],如图1所示,以异戊烯焦磷酸 (Isopentenyl pyrophosphate,IPP) 和二甲基丙烯基焦磷酸(Dimethylallyl pyrophosphate,DMAPP) 为分界线,紫杉醇的生物合成过程可以人为地分为两个部分:上游途径和下游途径。
紫杉醇生物合成机制的逐步明确,为紫杉醇在异源体系中的组合表达奠定了充分的基础。目前,紫杉醇的组合生物合成在不同体系的研究进展如下。
1 大肠杆菌
大肠杆菌遗传背景清楚,可用的商业载体丰富,因此大肠杆菌是目前合成生物学研究最多的底盘细胞。在大肠杆菌中建立紫杉醇生物合成的路径并最终用于生产是科学家们努力的方向。由于大肠杆菌中存在MEP途径,自身可以合成IPP和DMAPP,能够为下游途径提供原料,所以研究者对大肠杆菌的改造主要在于将 DXPS(1-Deoxy-D-xylulose 5-phosphate synthase,1-脱氧-D-木酮糖-5-磷酸合成酶)、DXR (1-Deoxy-D-xylulose 5-phosphate reductoisomerase,1-脱氧-D-木酮糖-5-磷酸还原异构酶)、IDI (Isopentenyl diphosphate isomerase,异戊烯基焦磷酸异构酶)以及下游途径中 GGDPS (Geranylgeranyl diphosphate synthase,香叶基香叶基焦磷酸合酶)、TS (Taxadiene synthase,紫杉烯合酶) 和T5αH (Taxadiene-5-alpha-hydroxylase,紫杉烯-5α-羟基化酶) 基因整合到大肠杆菌中并过表达。研究者使用的策略如下:
1.1 上游途径中关键酶的过表达
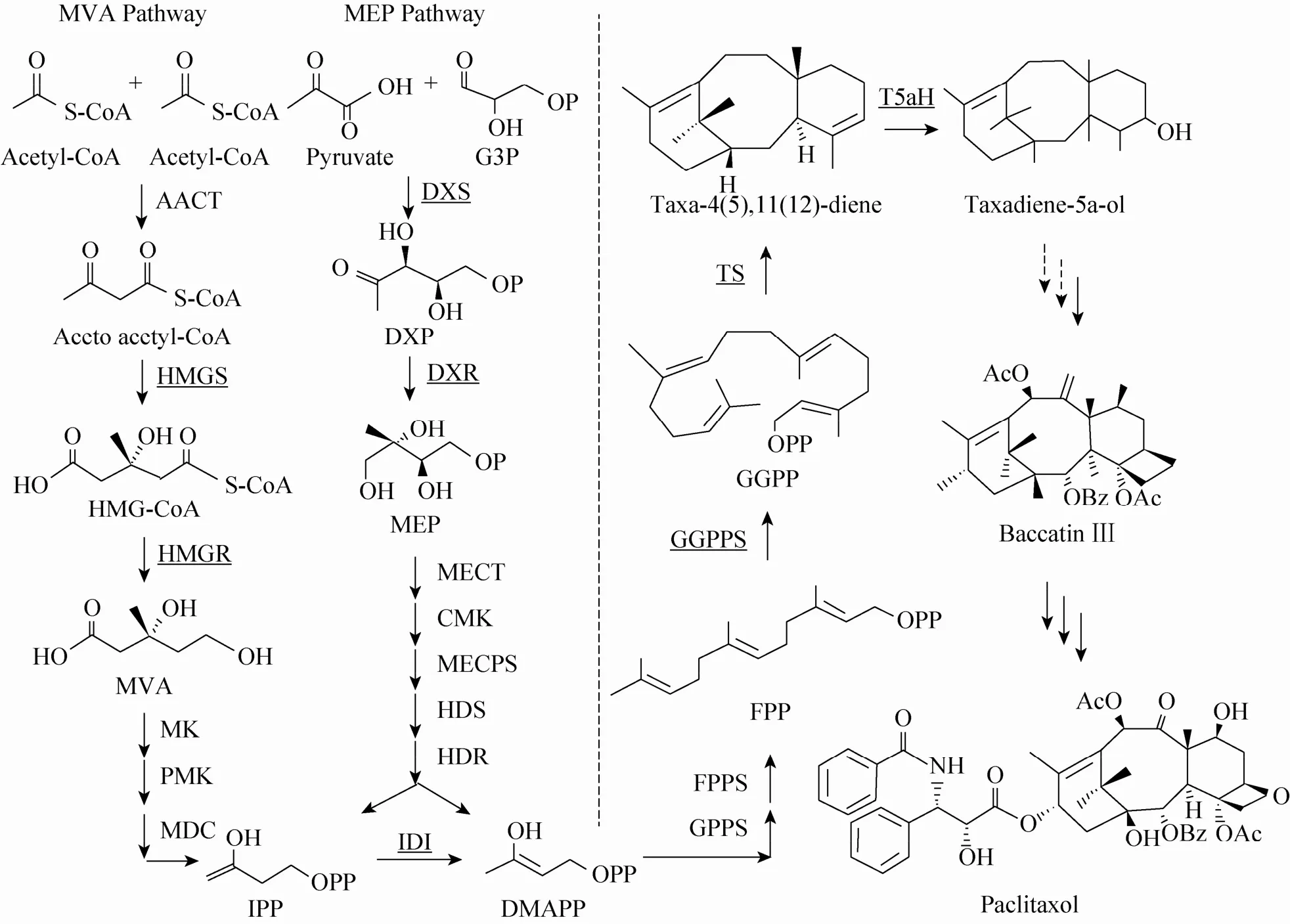
图1 紫杉醇生物合成过程概览[22]Fig. 1 Overview of the Taxol biosynthetic pathway. The biogenesis of Taxol can be artificially divided into two processes: the upstream isoprenoid pathway (MVA pathway or MEP pathway) and a heterologous downstream terpenoid pathway. The dotted line separates the two parts. The underlined enzymes indicate the enzyme has been modified. For more details refer to the relevant review [22].
在上游MEP途径中,DXPS、IDI是关键酶,对途径末端IPP和DMAPP的产量有决定性的影响。有实验室将大肠杆菌内源性的DXPS基因和IDI基因、来自辣椒Capsicum annuum的GGDPS基因以及中国红豆杉的TS基因在大肠杆菌中共表达[23],GC-MS分析得到了代谢产物taxa-4(5),11(12)-diene。但是,研究者发现,4个基因共表达时彼此相互影响,推测其原因可能是DXPS和 GGDPS的表达对宿主菌有一定的毒性,或者是这4个基因同时在同一个工程菌中诱导表达时可能导致能量代谢障碍。另有研究组[24]在大肠杆菌中共表达大肠杆菌内源性的 DXPS和IDI、来自草生欧文菌的GGDPS和来自太平洋红豆杉的 TS,结果表明,4种酶同时过表达可以得到1.3 mg/L的taxa-4(5),11(12)-diene,是只过表达 IDI、GGDPS和 TS的紫杉烯产量的2.6倍。
同一载体中外源基因的排列顺序会影响这些基因功能的发挥。Lü等[25]构建了含有银白杨异戊二烯合酶的载体 pET-32a,同时又将 MEP途径中的3个关键酶——DXS、DXR和IDI的基因按照不同的顺序 (3种基因共有6种排列顺序)插入到pET-30a载体上,将前者和含有不同顺序的后者同时导入到大肠杆菌中,经过诱导后分析萜类物质的产量发现:导入两种载体的大肠杆菌与只导入含有异戊二烯合酶基因载体的大肠杆菌相比,萜类物质的产量的确有不同程度的提高。而且有趣的是,含有按照 T7 Pro—dxs—dxr—idi顺序构建载体的菌株中,萜类物质的产量达到最大,能够达到2.721 mg/(g·h),而更改这3个基因的顺序之后,萜类物质的产量均有所下降。
1.2 游离酶蛋白溶解性的提高
在红豆杉细胞中,成熟的TS含有信号肽,在帮助其到达液泡后被切掉,但是这一段信号肽的存在影响了TS的溶解性,继而影响到了酶活性的发挥。为了提高TS的溶解性,Huang等[24]在非细胞体系中使用去除了前 78个氨基酸的“假熟体”TS (即不含信号肽),使之成为几乎完全可溶的蛋白,在正常表达量的IDI和GGDPS存在的情况下,几乎使100%的IPP转变为GGDP,而只有 70%的 GGDP转变为 taxa-4(5),11(12)-diene。后者效率降低的原因可能为GGDP上磷酸的水解或者是产物的抑制作用。Huang等[24]除了获得可溶性TS之外,还获得了两种活性同时存在的 IDI和 GGDPS的融合蛋白,这样做同样增加了这两种蛋白的溶解性。在 1 L细胞培养液中得到 0.5 mg的 taxa-4(5),11(12)-diene。
1.3 “多元模块通路工程”的建立
前期试验是建立在从 IPP或 DMAPP到GGDP再到taxa-4(5),11(12)-diene是线性行为这一假设上的,于是在大肠杆菌内依次过表达这一线性过程上的基因就可以提高这一条线上的代谢流,从而提高taxa-4(5),11(12)-diene的产量[23]。然而,这种提高是有限的,原因是它忽视了一些其他因素,比如中间代谢产物对细胞是否有毒、用于表达的载体对细胞是否有不利影响,以及是否在对细胞改造之后出现隐藏代谢通路从而弥补主要代谢通路或者抑制目的分子的产量。于是,有人[2]提出了“多元模块通路工程”,即将上下游途径作为两个相对独立的模块,利用代谢工程的方法来平衡上下游模块中碳元素的代谢平衡,使紫杉烯的产量达到最大优化。同时,这种方法还需考虑启动子的强度 (T7、T5和trc)、不同基因 (分别位于染色体或质体) 的拷贝数以及温度对宿主的影响,综合各个方面的最优条件之后,发现过表达利用T7启动子启动的低拷贝的质粒最有利于紫杉烯的生产,其产量与对照相比可以提高15 000倍,达到1.02 g/L左右。更为可观的是,这个结果是在较大规模的分批式发酵罐中得到的,这对于将研究成果推向工业化无疑是一个重大突破。
1.4 细胞色素氧化酶和还原酶的成对引入
Ajikumar等[2]首次利用代谢工程的方法在大肠杆菌中使紫杉烯的表达量达到最优化,使人们看到了代谢工程的巨大潜力。但是,将同样的方法运用到后面的步骤中还有一些困难:首先,细胞色素P450酶系在植物细胞中是锚定在内质网膜上的,而大肠杆菌没有细胞内膜系统,这就使得在大肠杆菌中成功表达这种酶的难度增加了很多。其次,每个P450氧化酶都需要一个特定的与之配对的P450还原酶来传递电子,从而完成氧化还原反应,而大肠杆菌中同样没有P450还原酶系。为了解决这两个问题,Ajikumar在T5αH的基因中截去表达跨膜区域蛋白的密码子,同时对与之配对的P450还原酶也进行改造,将其 N端的跨膜区域也截去,并将两种酶通过连接肽连在一起组成融合蛋白。以大肠杆菌中两种酶的融合蛋白代替红豆杉中原本定位在内质网膜上的这两种酶的功能,巧妙地将对紫杉烯的氧化反应引入到了大肠杆菌中,使得taxadiene-5α-ol的产量达到 58 mg/L,达到了酵母中产量的2 400倍。
1.5 提高紫杉醇前体物质的产量需要注意的其他条件
1.5.1 适合生产紫杉烯菌株的选择
Ajikumar的研究中选用的菌株是大肠杆菌MG1655的衍生株系。然而在这个株系的紫杉烯合成通路中还存在着一个十分复杂的、非线性的调控机制,涉及到更多细胞的代谢产物。同样作为大肠杆菌,不同株系的细胞里代谢通路有或多或少的差异,Boghigian等[26]发现,在B株系和K株系的大肠杆菌中分别构建从IPP或DAMPP到taxa-4(5),11(12)-diene的代谢通路。在B株系中,丙酮酸激酶和磷酸烯醇式丙酮酸羧激酶的表达都上调了,使得 B株系中丙酮酸量减少,使得下游的紫杉烯产量相应地减少;同时,K株系中,磷酸果糖激酶I的基因表达显著上调,使得更多的代谢流流向 3-磷酸-甘油醛这一萜类代谢通路的又一个直接前体,增加了紫杉烯的产量。因此,K株系的菌株比 B株系本身更适合作为合成紫杉醇的对象。
1.5.2 适合紫杉烯积累最适温度的选择
温度可以显著影响大肠杆菌内聚酮化合物的产量[27],在紫杉烯的生产中也不例外。比较K株系和 B株系生产紫杉烯的实验中,在培养温度22 ℃这一最佳温度下,紫杉烯的产量达到了最大值。
2 酵母
大肠杆菌是应用最为广泛的原核表达载体,但由于大肠杆菌在组合表达较多基因时存在能量代谢障碍、筛选标记少、质粒缺乏足够的兼容性、没有完整的细胞内膜系统等问题,使其应用受到局限。而酵母作为宿主具有独特的优点:1)酵母中有类异戊二烯途径——MVA途径(Mevalonate,甲羟戊酸),可提供GGDP用于合成紫杉醇中间体;2) 能提供充足的NADPH,参与代谢反应;3) 在发酵条件下容易生长,适应力强;4) 没有致病性;5) 可以产生有功能的Ⅱ型 P450单加氧酶[28-29]。6) 具有完整的细胞内膜系统,能确保与紫杉醇生物合成相关的羟基化酶基因的共表达;7) 有多个营养缺陷型供选择,并有多个选择标记可供使用。酵母被用作组合生物合成的宿主具有较强的应用前景。
利用酵母进行紫杉醇组合生物合成的研究主要集中在上游途经的关键酶 HMGR(3-hydroxy-3-methylglutaryl-CoA reductase,3-羟甲基戊二酰辅酶A还原酶) 和下游途径中的GGDPS、TS、T5αH、TAT (Taxadien-5α-ol-O-acetyltransferase,紫杉烯 5α-氧-乙酰基转移酶) 及 T10βH(Taxadien-10β-hydroxylase,紫杉烯 10β-羟基化酶)的改造。研究者使用了以下策略:
2.1 启动子的优化
酿酒酵母内源性的GGDP水平较低,其合成途径中的 HMGR将 HMG催化还原成 MVA是酿酒酵母内源性的类异戊二烯/固醇途径中的重要限速反应。王伟等[30]利用组成型表达的乙醇脱氢酶基因启动子来启动HMGR基因的表达,从而消除了这一限速反应,增加了MVA途径的代谢流,使得GGDP的产量提高。从而为紫杉烯合酶提供更多的催化底物,并使其与中国红豆杉紫杉烯合酶基因共同表达,在酵母细胞中成功建立了一个合成紫杉烯的代谢途径。DeJong等[31]将紫杉醇生物合成中的 5种酶GGDPS、TS、T5αH、T10βH 和 TAT 共同转到酵母细胞中成功进行了功能性表达,试图建立紫杉醇生物合成途径中从 IPP到 taxdiene-5αacetate-10β-ol的组合生物合成途径。最终得到紫杉烯 1.0 mg/L,而 T5αH 催化作用的产物taxadien-5a-ol的产量只有微量的25 μg/L,没有检测到TAT和T10βH作用的产物。作者将T5αH基因的组成型启动子GPD换成可诱导的GAL1启动子,得到的 T5αH约是之前的 5倍。研究者预测如果将 T5αH基因置于 GAL1调控下,同时与红豆杉还原酶共表达将至少使 5α-羟基化步骤的代谢流增加10倍。
2.2 流向甾醇代谢流的控制
Engels等[32]在研究中使用两种方法减少代谢流向甾醇,一是引入 HMGR的一个同工酶upc2.1等位基因,它表达的转录因子 UPC2.1,可以使酵母在有氧条件下也从环境中吸收类固醇,从而抑制了类固醇的合成,使代谢流向紫杉醇途径;二是以嗜酸热硫化叶菌的GGDPS代替中国红豆杉的GGDPS,前者以IPP和DMAPP为底物,后者以FPP (Farnesyl pyrophosphate,法尼基焦磷酸) 为底物,而角鲨烯也以FPP为底物,通过连续添加DMAPP合成GGDP,避免了与类固醇途径竞争FPP,结果香叶基香叶醇增加较多。
2.3 密码子的优化
提高表达常用的一个策略就是改变目的基因的稀有密码子,使之更接近于宿主细胞的密码子使用方式,而不改变所编码蛋白的氨基酸序列。研究发现对 TS密码子进行优化,taxa-4(5),11(12)-diene在酵母中的产量增加了约40倍,达到 (8.7±0.85) mg/L,而香叶基香叶醇的表达量达到 (33.1±5.6) mg/L,表明紫杉烯的表达量可以达到更高,这是迄今为止在酵母中紫杉烯表达量最大的报道[32]。
2.4 生物合成基因簇的构建
考虑到酿酒酵母等外源表达体系有限的选择标记以及染色体的插入会阻碍重建途径的后续修饰,Dahm等[33]应用SOE-PCR和体外同源重组的方法在酵母中建立了一个生物合成基因簇,实现了来自嗜酸热硫化叶菌的 GGDPS、酵母的HMGR以及优化了密码子的TS的3个蛋白的协同表达。
2.5 与T10βH同源的细胞色素还原酶的同时表达
细胞色素P450氧化酶催化的反应是通过电子传递系统,将电子从NAD(P)H转移到微粒体系统中的NADPH-细胞色素P450还原酶,或铁氧蛋白还原酶,然后到细胞色素P450氧化酶;这样使得分子氧还原活化,随后将一个氧原子插入底物。其中细胞色素P450还原酶 (Cytochrome P450 reductase,CPR) 是细胞色素P450酶系中重要的功能单位。在生物体内,细胞色素 P450还原酶是细胞色素 P450氧化酶主要的电子供体,它与细胞色素P450氧化酶电子传递反应是细胞色素 P450氧化酶氧化还原反应的限速步骤。CPR将电子供体NAD(P)H的电子经过FAD和FMN两个辅基传递给细胞色素P450氧化酶,然后细胞色素P450氧化酶才能与底物发生氧化还原反应。有两个因素可能降低细胞色素 P450氧化酶的催化效率,一是酵母CPR量的不足,另一个是酵母CPR和植物P450的电子传递效率不匹配,可能无法支持P450的最大催化活性。这种情况下,需要加入内源 CPR来提高细胞色素P450氧化酶活性。将T10βH基因与红豆杉还原酶基因在酵母中共表达时,与只有内源性的酵母还原酶存在的情况相比,T10βH的催化活性增加了6倍,说明将红豆杉还原酶与同源的细胞色素P450紫杉烯羟基化酶共表达在微生物中重建紫杉醇合成途径是很重要的一步[34]。
3 小立碗藓
与微生物表达系统和哺乳动物细胞表达系统相比,作为苔藓植物的小立碗藓由于其在进化地位上的优势使得它兼具了二者的优势,不但具有前者的基因操作的简便性和高产性,而且同样具有哺乳细胞的对产物的更复杂的折叠和翻译后修饰。小立碗藓还能够弥补二者的不足,本身含有的合成次生代谢产物的酶系更加发达,拥有比酵母中还要完善的萜类物质代谢通路,如类胡萝卜素、赤霉素、质体醌和多种维生素这些以 GGDP为代谢起点的物质,为生产更加丰富的代谢产物提供了较为完善的代谢通路。同时,植物表达体系还消除了潜在的来自哺乳细胞的毒性[35-36]。
以苔藓植物作为表达体系的研究已经有人尝试。Anterola等[35]将TS基因导入小立碗藓中,应用泛素启动子作为启动子,产生了taxa-4(5),11(12)-diene,并且证明,在稳定的小立碗藓转化子中,taxa-4(5),11(12)-diene的含量可以达到组织湿重的0.05%。
与拟南芥、番茄和烟草等高等植物表达系统相比,尽管在番茄中紫杉烯的产量已经与从红豆杉针叶中提取的产量相当,但是转基因的拟南芥和番茄生长明显慢于野生型,使得生产周期明显延长。而且,在转基因烟草中共表达TS和T5αH的同时,没有得到预期产物 taxadien-5α-ol,却得到副产物5(12)-oxa-3(11)-cyclotaxane。这两个难题的存在阻碍了高等植物体系中紫杉醇生物合成的研究[35]。小立碗藓具有非常高的同源重组率,达到了 10–3–l0–4,为紫杉醇生物合成基因的整合提供保证。除此之外,小立碗藓具有相对简单的发育模式和较短的生长周期,有利于规模化培养和突变体的筛选,其生活史世代以单倍体的配子体形态为主,这利于突变的产生和遗传性状的直接分析[37]。
鉴于小立碗藓系统用于紫杉醇组合生物合成具有如此明显的优势,本实验室拟在小立碗藓中建立紫杉醇的生物合成路径。外源基因可以被整合在小立碗藓的基因组中或者叶绿体的基因组中,因为叶绿体系统相比于核转化系统有性状稳定、不易交叉感染,外源基因拷贝数多,没有位置效应,没有基因沉默和可以同时表达多个基因等特点[38]。因此,本实验室选择小立碗藓的叶绿体系统作为紫杉醇生物合成酶的表达系统。本实验室已将紫杉醇生物合成的关键酶 10-去乙酰巴卡亭 III-10-氧-乙酰转移酶 (10-DeacetylbaccatinIII-10-O-acetyl transferase,DBAT) 基因转入小立碗藓叶绿体中表达,项目正在进行中,希望通过将紫杉醇生物合成酶逐个转化小立碗藓,最终实现紫杉醇在小立碗藓中的生产。
4 拟南芥
拟南芥是研究最多的模式植物之一。Besumbes等[39]在拟南芥中首先表达了欧洲红豆杉中缺少质体定位信号肽、同时又在 C端融合了His标签的TS,这种方法检测到了taxa-4(5),11(12)-diene的积累,尽管量很少,但同时导致了转化植株中那些以 GGDP为底物合成的异戊二烯化合物如光合色素的下降。这样的结果不排除紫杉烯本身对植株的毒性,更为可信的说法是因为TS的组成型表达会影响内源GGDP代谢的平衡,与那些以GGDP为底物的代谢途径竞争而使植株本身正常生长受到影响。组成型表达产生的相对较少的taxa-4(5),11(12)-diene积累表明TS的过表达没有有效地使产生的GGDP向萜类合成的途径中流动。于是作者又使用了糖皮质激素诱导型的表达系统,即用地塞米松诱导 TS在拟南芥成熟叶片中表达。实验结果很令人振奋,在诱导后的植株中检测到了 taxa-4(5),11(12)-diene的表达,产量达到600 ng/g干重。
5 番茄
番茄果实中含有丰富的类胡萝卜素,其中使番茄呈现红色的类胡萝卜素就是番茄红素。在番茄果实中,番茄红素的合成起始于两个分子GGDP的连接形成phytoene,八氢番茄红素。而紫杉烯生物合成的直接底物同样也是GGDP,两种物质的代谢途径拥有共同的底物。因此,如果在红色果实中构建紫杉烯的代谢途径必然会与番茄红色竞争底物使得紫杉烯的产量减少。Kovacs等[40]在黄色果实的番茄株中,成功构建了含有TS基因的表达载体,利用土壤农杆菌转化番茄植株,在每1 kg冻干的果实中可以得到160 mg的taxa-4(5),11(12)-diene。与红色果实的番茄植株相比,黄色果实的番茄植株有两个天然的优势:第一,由于黄色果实中没有番茄红素合酶,这样就可以使更多的 GGDP进入合成紫杉烯的代谢通路中,为紫杉烯的合成提供更多的原料;第二,用于提取紫杉烯的溶剂在红色果实的番茄植株中同样可以提取到类胡萝卜素,使两种物质无法分开,而在黄色果实中的类胡萝卜素很少,而含量较多的黄酮类物质又恰好不溶于己烷(紫杉烯溶于己烷)。这样,就为紫杉烯的提取和下游操作提供了方便。
6 人参
由于在人参中本身就存在萜类的代谢途径,而且人参根培养的方法也较为成熟,使得对人参向着合成紫杉烯的方向进行改造相对比较方便,而且能够进一步提高紫杉烯的产量。目前,已将TS基因整合到人参根细胞基因组中并进行了表达,taxa-4(5),11(12)-diene的产量[41]达到了9.1 μg/g干重。在对转化植株经过茉莉酸甲酯的处理后,taxa-4(5),11(12)-diene的产量可以提高到15.9 μg/g干重。在获得比苔藓和番茄还要高产的紫杉烯的同时,植株本身的表型与野生型相比没有明显的差异。这一点使得人参成为了很有潜力的表达系统。
7 讨论与展望
从以上的研究进展可以看出,在大肠杆菌和酵母中,组合生物合成紫杉醇已经可以从萜类共同前体IPP开始进行到taxadien-5α-ol;而在小立碗藓、拟南芥、番茄和人参中却只得到了taxa-4(5),11(12)-diene。在大肠杆菌和酵母中对途经的优化研究主要集中在通过改造上游途经的关键酶来增加IPP的产量和对下游途径中TS的改造,而对此后的研究比较少;在植物表达系统的研究缺乏对上游途径的优化。因此在不同体系中合成紫杉醇还有很多工作有待深入,进一步的工作可以考虑以下几个方面。
对于大肠杆菌和酵母体系来说,它们中存在典型的MVA或MEP代谢途径,研究者已经通过对上游途经中关键酶如DXS、DXR、HMGS、HMGR的改造,获得了高产的IPP和DMAPP,为下游途径提供了足够的原料。因此,接下来的研究可把重点放在对下游途径的改造中,尤其是需要引入在taxadiene-5α-ol之后的一系列羟化和酰化反应的酶,从而推进紫杉醇的组合生物合成。在大肠杆菌中,Ajikumar等已经将T5aH和与其对应的细胞色素还原酶成功引入到大肠杆菌中,使得taxadiene-5α-ol的产量比在酵母中的产量更高,达到58 mg/L[2,32]。但是在大肠杆菌中还没有将TAT或T10βH与上游的酶一同转入的尝试,使得紫杉醇在该体系中的生物合成只停留在 taxadiene-5α-ol这一步。而在酵母中,DeJong等[31]虽然已经将TAT和T10βH引入体系中,但由于紫杉醇生物合成的代谢流容易在T5αH受到阻碍,使得taxadien-5a-ol的产量很少,更无法检测到下游产物。Ajikumar和DeJong的研究组分别将T5αH、T10βH引入到大肠杆菌和酵母中,并且发现在引入这两种羟基化酶的同时,引入与之同源的还原酶可以得到更多的产物。由于在紫杉醇生物合成的过程中,大多数的反应都是由细胞色素氧化酶参与的羟化反应,因此,每一个细胞色素氧化酶必然伴随着与它同源的还原酶同时引入到体系中。所以,在这两种体系中,研究者下一步需要努力的就是将参与反应的细胞色素酶成对引入到体系中去。
研究专门适用于合成生物学的新型菌株:大肠杆菌和酵母都是开发研究较早的工业微生物,并且应用于多种代谢工程,但是将它们用于合成生物学的潜力还未充分发挥出来。Siddiqui等[42]综述了将酵母生物学与合成生物学相结合使酿酒酵母成为构建次生代谢物途径的微生物宿主的发展。认为将来需要更多地借助于合成生物学的方法和工具,将一些新的特征整合入异源的代谢途径,构建产天然产物的酵母菌株。同时认为可以构建产大量前体物质的酵母菌株,这些菌株的细胞或细胞器的运输能力可能改变,但将更有利于底物的吸收、中间体的贮存以及产物的输出。从近年的研究可以看到有些用于生产植物次生代谢产物的新型酵母也已经构建出来,或者正处于研究阶段。例如Ignea等[43]应用可循环的集成盒的方法,产生了具有更强的生产植物萜类的新型酵母菌株。
解除或减少副产物对主要产物的抑制作用:在大肠杆菌中构建合成紫杉烯代谢通路的实验中,副产物吲哚一直是一个十分难解决的问题,越是紫杉烯高产的菌株,受到吲哚的影响就越大[26]。尽管紫杉烯和吲哚相互影响的机制还不清楚,但是从减少副产物吲哚这个角度入手,无疑可以对紫杉烯产量的提高起到促进作用。
解决多个基因共表达时互相影响和中间产物积累的问题[23]:在大肠杆菌中紫杉烯合成途径中4个基因共表达时互相影响,导致终产物的减少,推测其原因可能是DXPS和GGDPS的表达对宿主菌有一定的毒性,或者是这4个基因同时在同一个工程菌中诱导表达时导致能量代谢障碍。另外,在检测到主产物 taxa-4(5),11(12)-diene产生的同时,还检测到其前体verticillene的积累,而且所占的比例较高。但中间体积累的原因还不清楚。
添加代谢途径前体物质增加产物产量:在培养基中添加代谢途径的前体物质是弥补代谢底物不足的有效方法。3-磷酸甘油醛和丙酮酸是MEP途径的直接前体,通过中间体的添加,可以降低代谢途径中中间体合成的能量消耗,从而促进代谢流向目的产物。Ajikumar等[2]通过摇瓶发酵水平所获得的代谢工程菌菌株26能够利用葡萄糖或甘油合成异戊二烯,当在连续补加总量为3 g/L甘油的合成培养基上利用补料批次发酵获得紫杉烯的最大产量高达1 g/L。
借鉴其他萜类组合生物合成的研究成果和经验:萜类生物合成有共同的前体物质和相似的途径。目前对萜类物质组合生物合成研究最深入的是青蒿素,从中我们可以借鉴一些经验用于紫杉醇的组合生物合成。以酵母中合成青蒿素为例,紫穗槐二烯是合成青蒿素的重要前体,而合成紫穗槐二烯底物即为 FPP。为了提高 FPP的量,通过对 FPP合成途径依次进行 5次基因改造:过表达 HMGR,解除反馈抑制;利用一个methioninerepressible启动子(PMET3),对编码鲨稀合酶 (固醇生物合成途径中 FPP合成后第一步) 的ERG9基因进行负调控,减少合成固醇类物质的代谢流;过表达 upc2-1 (一个可以加强UPC2 (啤酒酵母中调节固醇合成的一个的通用转录因子) 活性的半显性突变体等位基因);在酵母染色体更远处再转进一个HMGR拷贝;在细胞密度降低的情况下过表达编码 FPP合酶的基因 (ERG20),综合应用上述所有的策略,最终将紫穗槐二烯的合成量增加到了 153 mg/L,几乎是之前报道的紫穗槐二烯合成量的500倍。萜类前体物质在酵母中有共同的合成途径,可以借助倍半萜类物质青蒿素的组合生物合成中构建的FPP合成途径,通过提高底物FPP的产量增加taxa-4(5),11(12)-diene或紫杉醇的产量。将Ro等[44]构建的该途径与紫杉醇组合生物合成研究中的优化策略相比,发现还可以通过下调编码鲨烯合酶的ERG9、上调编码FPP合酶的ERG20基因,或者改变细胞密度,提高 FFP的供应,最终达到提高紫杉醇中间产物或终产物产量的目的。
在植物表达体系中,除了加强对上游途经改造来增加IPP和DMAPP的产量外,还有以下的策略可以运用:
用诱导型的系统代替组成型的系统:在拟南芥中,利用诱导型的表达系统比组成型的系统取得了更好的效果[39]。组成型的系统由于组合在基因组中,从宿主细胞产生时就开始表达,势必会与宿主初级代谢产物争夺基础物质和能量,不仅使目的产物的产量减少,而且影响宿主细胞的生长。诱导型的系统可以充分考虑到时间和空间的选择,使目的产物在合适的时期、合适的地点(比如不同细胞器) 进行表达,不仅没有影响宿主细胞的生长代谢,而且能使目的基因的产量提高,达到合理分配资源的效果。
多策略、新方法的综合应用:观察紫杉醇在不同体系中的组合生物合成发现,这些研究综合应用了蛋白质工程、代谢工程、合成生物学等策略设计微生物,来产生有价值的产物[45]。随着诸如基因组学、转录组学、蛋白质组学以及代谢组学等现代“组学”技术的建立,许多新的方法尤其是一些代谢工程的方法,例如通过克服限速步骤、减少流向竞争途径的代谢流、降低分解代谢以及过量表达调节基因等都可以用来增加次级代谢物产量[46]。除此之外,利用计算模型预测影响代谢通路的基因,然后进行这些基因缺失或高表达,进行靶基因对终产物合成的相关性分析。如Boghigian等[47]利用计算模型成功地鉴定了3个中心途径靶基因,这3个基因的高水平表达能提高紫杉烯的产量。因此,综合运用多种方法,成为解决这类问题的必需手段。
随着紫杉醇生物合成过程的逐步明确,其代谢调控机制的阐明,合成生物学方法的发展,相信在不远的将来,利用组合生物合成的方法生产紫杉醇将会成为现实。
[1]Horwitz SB. How to make taxol from scratch.Nature, 1994, 367(6464): 593–594.
[2]Ajikumar PK, Xiao WH, Tyo KE, et al. Isoprenoid pathway optimization for taxol precursor overproduction inEscherichia coli. Science, 2010,330(6000): 70–74.
[3]Christen AA, Gibson DM, Bland J. Production of taxol or taxol-like compounds in cell culture: US,5019504. 1991-05-28.
[4]Ketchum REB, Gibson DM, Croteau RB, et al. The kinetics of taxoid accumulation in cell suspension cultures of Taxus following elicitation with methyl jasmonate. Biotechnol Bioeng, 1999, 62(1): 97–105.
[5]Lü XH, Zang X, Yang DZ. The cell industrialization culture of taxus. Lishizhen Med Mater Med Res, 2006, (5): 844−846 (in Chinese).
吕晓辉, 臧新, 杨冬之. 红豆杉细胞的工业化培养. 时珍国医国药, 2006, (5): 844–846.
[6]Xu L, Wang FP. Total synthesis of taxol developed by Nicolaou. Chin J Org Chem, 2001, 21(7):493−504 (in Chinese).
徐亮, 王锋鹏. 抗癌药物紫杉醇的全合成—Nicolaou 法全合成紫杉醇的剖析. 有机化学,2001, 21(7): 493–504.
[7]Chen QH, Wang FP. Total synthesis of taxol developed by Holton. Nat Prod Res Dev, 2001,13(3): 88−95 (in Chinese).
陈巧鸿, 王锋鹏. 抗癌药物紫杉醇的全合成—Holton 合成紫杉醇路线的剖析. 天然产物研究与开发, 2001, 13(3): 88–95.
[8]Kusama H, Hara R, Kawahara S, et al.Enantioselective total synthesis of (−)-taxol. J Am Chem Soc, 2000, 122(16): 3811–3820.
[9]Morihira K, Hara R, Kawahara S, et al.Enantioselective total synthesis of taxol. J Am Chem Soc, 1998, 120(49): 12980–12981.
[10]Shiina I, Iwadare H, Sakoh H, et al. A new method for the synthesis of baccatin III. Chem Lett, 1998,27(1): 1.
[11]Wender PA, Badham NF, Conway SP, et al. The pinene path to taxanes. 5. Stereocontrolled synthesis of a versatile taxane precursor. J Am Chem Soc,1997, 119(11): 2755–2756.
[12]Wender PA, Badham NF, Conway SP, et al. The pinene path to taxanes. 6. A concise stereocontrolled synthesis of taxol. J Am Chem Soc,1997, 119(11): 2757–2758.
[13]Danishefsky SJ, Masters JJ, Young WB, et al. Total synthesis of baccatin III and taxol. J Am Chem Soc,1996, 118(12): 2843–2859.
[14]Nicolaou KC, Nantermet PG, Ueno H, et al. Total synthesis of taxol. 1. Retrosynthesis, degradation,and reconstitution. J Am Chem Soc, 1995, 117(2):624–633.
[15]Nicolaou KC, Liu JJ, Yang Z, et al. Total synthesis of taxol. 2. Construction of A and C ring intermediates and initial attempts to construct the ABC ring system. J Am Chem Soc, 1995, 117(2):634–644.
[16]Nicolaou KC, Yang Z, Liu JJ, et al. Total synthesis of taxol. 3. Formation of taxol’s ABC ring skeleton.J Am Chem Soc, 1995, 117(2): 645–652.
[17]Nicolaou KC, Ueno H, Liu JJ, et al. Total synthesis of taxol. 4. The final stages and completion of the synthesis. J Am Chem Soc, 1995, 117(2): 653–659.
[18]Holton RA, Kim HB, Somoza C, et al. First total synthesis of taxol. 2. Completion of the C and D rings. J Am Chem Soc, 1994, 116(4): 1599–1600.
[19]Hohon RA, Somoza C, Kim HB, et al. First total synthesis of taxol. 1. Functionalization of the B ring. J Am Chem Soc, 1994, 116(4): 1597–1598.
[20]Stierle A, Strobel G, Stierle D. Taxol and taxane production byTaxomyces andreanae, an endophytic fungus ofPacific yew. Science, 1993, 260(5105):214–216.
[21]Arsenault PR, Wobbe KK, Weathers PJ. Recent advances in artemisinin production through heterologous expression. Curr Med Chem, 2008,15(27): 2886–2896.
[22]Croteau R, Ketchum RE, Long RM, et al. Taxol biosynthesis and molecular genetics. Phytochem Rev, 2006, 5(1): 75–97.
[23]Wang W, Kong JQ, Meng C, et al. Studies on combinatorial biosynthesis of taxadiene inEscherichia coli. Chin Pharm J, 2005(18):1428−1431 (in Chinese).
王伟, 孔建强, 孟超, 等. 大肠杆菌组合生物合成紫杉烯的研究. 中国药学杂志, 2005(18):1428–1431.
[24]Huang Q, Roessner CA, Croteau R, et al.EngineeringEscherichia colifor the synthesis of taxadiene, a key intermediate in the biosynthesis of taxol. Bioorgan Med Chem, 2001, 9(9):2237–2242.
[25]Lü X, Xu H, Yu H. Significantly enhanced production of isoprene by ordered coexpression of genes dxs, dxr, and idi inEscherichia coli. Appl Microbiol Biot, 2012: 1–9.
[26]Boghigian BA, Salas D, Ajikumar PK, et al.Analysis of heterologous taxadiene production in K-and B-derivedEscherichia coli. Appl Microbiol Biot, 2012, 93(4): 1651–1661.
[27]Boghigian BA, Zhang H, Pfeifer BA.Multi-factorial engineering of heterologous polyketide production inEscherichia colireveals complex pathway interactions. Biotechnol Bioeng,2011, 108(6): 1360–1371.
[28]Jiang M, Stephanopoulos G, Pfeifer BA.Downstream reactions and engineering in the microbially reconstituted pathway for taxol. Appl Microbiol Biot, 2012, 94(4): 841–849.
[29]Julsing MK, Koulman A, Woerdenbag HJ, et al.Combinatorial biosynthesis of medicinal plant secondary metabolites. Biomol Eng, 2006, 23(6):265–279.
[30]Wang W, Meng C, Zhu P, et al. Preliminary study on metabolic engineering of yeast for producing Taxadiene. China Biotechnol, 2005, 25(8): 103−108(in Chinese).
王伟, 孟超, 朱平, 等. 代谢工程酵母菌合成紫杉烯的研究. 中国生物工程杂志, 2005, 25(8):103–108.
[31]DeJong JHM, Liu Y, Bollon AP, et al. Genetic engineering of taxol biosynthetic genes inSaccharomyces cerevisiae. Biotechnol Bioeng,2006, 93(2): 212–224.
[32]Engels B, Dahm P, Jennewein S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards Taxol (Paclitaxel) production.Metab Eng, 2008, 10(3/4): 201–206.
[33]Dahm P, Jennewein S. Introduction of the early pathway to taxol biosynthesis in yeast by means of biosynthetic gene cluster construction using SOE-PCR and homologous recombination. Methods Mol Biol, 2010, 643: 145–163.
[34]Jennewein S, Park H, DeJong JM, et al.Coexpression in yeast of Taxus cytochrome P450 reductase with cytochrome P450 oxygenases involved in Taxol biosynthesis. Biotechnol Bioeng,2005, 89(5): 588–598.
[35]Anterola A, Shanle E, Perroud PF, et al. Production of taxa-4(5),11(12)-diene by transgenicPhyscomitrella patens. Transgenic Res, 2009,18(4): 655–660.
[36]Decker EL, Reski R. Moss bioreactors producing improved biopharmaceuticals. Curr Opin Biotechnol, 2007, 18(5): 393–398.
[37]Wang YY, Wang CM, Chen C, et al. The genetic transformation system in model speciesPhyscomitrella patens. China Biotechnol, 2012,32(1): 103–108 (in Chinese).
汪运洋, 王春梅, 陈琛, 等. 模式生物小立碗藓遗传转化系统的研究进展. 中国生物工程杂志,2012, 32(1): 103–108.
[38]Sidorov VA, Kasten D, Pang SZ, et al. Technical Advance: Stable chloroplast transformation in potato: use of green fluorescent protein as a plastid marker. Plant J, 1999, 19(2): 209–216.
[39]Besumbes OS, Sauret-G U Eto S, Phillips MA, et al.Metabolic engineering of isoprenoid biosynthesis inArabidopsisfor the production of taxadiene, the first committed precursor of Taxol. Biotechnol Bioeng, 2004, 88(2): 168–175.
[40]Kovacs K, Zhang L, Linforth RST, et al.Redirection of carotenoid metabolism for the efficient production of taxadiene[taxa-4(5),11(12)-diene]in transgenic tomato fruit.Transgenic Res, 2007, 16(1): 121–126.
[41]Cha M, Kim SH, Lee SW, et al. Production of taxadiene from cultured ginseng roots transformed with taxadiene synthase gene. Biochem Mol Biol Rep, 2012, 45(10): 589–594.
[42]Siddiqui MS, Thodey K, Trenchard I, et al.Advancing secondary metabolite biosynthesis in yeast with synthetic biology tools. Fems Yeast Res,2012, 12(2): 144–170.
[43]Ignea C, Cvetkovic I, Loupassaki S, et al.Improving yeast strains using recyclable integration cassettes, for the production of plant terpenoids.Microb Cell Fact, 2011, 10(4): 4.
[44]Ro DK, Paradise EM, Ouellet M, et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature, 2006, 440(7086):940–943.
[45]Du J, Shao Z, Zhao H. Engineering microbial factories for synthesis of value-added products. J Ind Microbiol Biot, 2011, 38(8): 873–890.
[46]Hussain MS, Fareed S, Ansari S, et al. Current approaches toward production of secondary plant metabolites. J Pharm Bioallied Sci, 2012, 4(1):10–20.
[47]Boghigian BA, Armando J, Salas D, et al.Computational identification of gene over-expression targets for metabolic engineering of taxadiene production. Appl Microbiol Biot, 2012,93(5): 2063–2073.

