白藜芦醇合成酶基因在基因工程中的应用及功能研究进展
郑世刚,李臻,赵善仓,王庆国,刘炜
1 青岛农业大学生命科学学院,山东 青岛 266000 2 山东省农业科学院生物技术研究中心和山东省作物遗传改良与生态生理重点实验室,山东 济南 250100 3 山东省农业科学院农业质量标准与检测技术研究所,山东 济南 250100
白藜芦醇 (Resveratrol, Res) 作为植物中一种重要的植保素及抗毒素,其参与真菌等生物胁迫,以及紫外 (Ultraviolet, UV) 辐射、机械损伤和激素等非生物胁迫并引起抗性反应的研究已被广泛报道[1]。研究还表明,Res在抑制动物细胞癌变、治疗心血管疾病、抗氧化和延长寿命等方面也具有一定的作用[2]。已知Res主要存在于葡萄、花生、虎杖和高粱等少数物种中,许多物种虽然含有Res合成所需的底物,但自身缺乏Res合成途径的关键酶,如白藜芦醇合成酶(Resveratrol synthase, RS) 等,因而不能合成Res[3]。RS属于芪合酶 (Stilbene synthase, STS)或称二苯乙烯合酶家族,在同一植物中存在多种同源异构体,以4-香豆酰辅酶A和丙二酰辅酶A为底物合成Res[3]。因此利用基因工程手段将RS基因整合入不含有Res或Res含量低的细胞或物种基因组中进行表达,可以研究RS基因及其代谢产物Res的生物学功能与调控机制,进而为改良物种品质及抗性,获得Res及其相关代谢物提供一种有效的途径。
1 RS基因在植物中的转化及相关代谢产物
1.1 RS基因的克隆及转化
以往研究中,研究者通过对Res的生物合成及相关代谢途径的分析,从而揭示了RS基因和RS的生物学特性及功能,相关RS基因的分离、克隆和异源表达也受到研究者的广泛关注。1988年,Schröder等从悬浮培养的花生Arachis hypogaea细胞中分离得到两个约1.6 kb的RS基因cDNA克隆,这两个基因序列高度重复,都含有一个单一内含子,其序列编码区与查尔酮合酶 (Chalcone synthase, CHS) 基因序列同源性较高,达到70%–74%,且内含子所在位置一致,仅在CHS的保守区存在一定差异[4]。之后,Melchior等从葡萄Vitis viniferaL.中获得RS基因PSV25的约1.5 kb的全长cDNA序列,经在大肠杆菌中表达获得43 kDa的蛋白产物,以香豆酰辅酶A和丙二酰辅酶A为底物对蛋白表达产物进行酶活性检测,结果显示蛋白产物主要是Res,而没有查尔酮或柚皮素,进一步证明PSV25编码具有催化活性的RS[5]。目前,有关花生和葡萄中RS基因的异源转化研究报道相对较多,除上述PSV25外,葡萄中的RS基因还包括Vst1[6]和StSy[7]等;花生中的RS基因主要有AhRS[8]、AhRS3[9]等。本实验室的前期研究中,通过同源克隆法,从花生“鲁花14”中分离到全长1 537 bp的RS基因,命名为PNRS1,序列比对显示,其与花生数据库中其他RS基因的相似性在90%以上,与葡萄和虎杖中RS基因的同源性也较高[10]。此外,研究者在川鄂爬山虎Parthenocissus henryana、虎杖Polygonum cuspidatum及单子叶植物高粱Sorghum bicolor中,也发现并分离到PhSTS[11]、PcRS[12]和SbSTS1[13]等RS类基因。
1990年,Hain等首次将花生RS基因AhRS转入烟草Nicotiana tabacumL.,并以大豆疫霉Phytophthora megasperma和紫外辐射作为诱导因素分析其表达响应情况,结果显示,AhRS的mRNA水平与Res含量的积累呈协同变化,花生中反式Res在受UV处理后含量升高,在处理8 h后达到最大值,为600 ng/g鲜重,而转基因烟草中Res含量在受UV处理24 h后达到最大值,为50 ng/g鲜重[8],结果显示不管在同源或异源表达情况下,RS基因均可对生物胁迫和非生物胁迫产生响应,且其代谢产物Res的积累与基因表达量呈正相关。之后,研究者在拟南芥Arabidopsis thalianaL.[12]、水稻Oryza sativaL.[14]、小麦Triticum aestivumL.[15]、苜蓿Medicago sativa[16]、猕猴桃Actinidia deliciosa[17]、苹果Malus domesticaBorkh.[18]、番木瓜Carica papayaL.[19]、白杨树Populus albaL.[20]、番茄Lycopersicon esculentumMill.[7]、油菜Brassica napusL.[21]、地黄Rehmannia glutinosaL.[9]、莴苣Lactuca sativaL.[22]、豌豆Pisum sativumL.[23]、啤酒花Humulus lupulusL.[24]、草莓Fragaria ×ananassa[25]、紫薯Ipomoea batatas[26]、小白菜Brassica campestris[27]和胡萝卜Daucus carota[28]等不含Res或自身Res含量较低的植物中,均进行了RS基因的异源转化及表达研究,部分成果见表1。本实验室前期工作中也已将克隆到的花生RS基因PNRS1转入烟草和水稻中进行表达[29-30],研究结果表明,异源转化的PNRS1的表达仍可受UV-C的诱导,经紫外胁迫后,转基因烟草叶片提取液中Res的含量较野生型烟草叶片提取液中升高了约4 μg/mL,而转基因烟草叶片中Res的含量较野生型烟草叶片提高了约117 μg/g鲜重[29]。
1.2 转RS基因植物中的相关代谢产物
受RS基因来源、基因特异性启动子和受体材料等因素的影响,转基因植物中新合成代谢产物的种类和积累量均有所差异。预期转入RS基因后可新合成反式Res,但一些研究结果显示,新产物多为反式白藜芦醇糖苷 (Piceid;trans-resveratrol-3-O-b-D-glucopyranoside),也有顺式Res和顺式白藜芦醇糖苷的报道,究其原因可能是植物内源糖基化酶及异构酶修饰造成的。Nicoletti等应用反相高效液相色谱(RP-HPLC) 与光电二极管阵列 (PDA) 并结合质谱 (MS),对转RS基因番茄果实中4种芪类化合物 (反式和顺式白藜芦醇糖苷与反式和顺式Res) 的积累水平进行了测定,结果显示,不管是成熟还是未成熟的果实,Res的糖基化形式均优先积累于果皮中,而在红熟期番茄果皮中检测到较高含量的反式白藜芦醇糖苷和反式Res[7]。而Lo等通过液相色谱-串联质谱(LC/MS/MS),对转高粱RS基因拟南芥粗提物中三种Res相关代谢物,即Res二葡萄糖苷、反式乙酰己糖苷和顺式乙酰己糖苷的含量测定结果显示,Res二葡萄糖苷和顺式乙酰己糖苷的积累量较大,而反式乙酰己糖苷几乎检测不到[33]。
由于不同植物代谢过程的差异和内源修饰酶的影响等,使得受体材料在转入RS基因后,是否能合成新的代谢产物及代谢物的种类有时难以确定,如Hanhineva等将CaMV 35S启动子和花丝特异性启动子fil1控制的葡萄RS基因NS-Vitis3异源转入草莓,但未在转基因草莓中检测到预期的Res或其衍生物[25]。Hammerbacher等将挪威云杉Picea abies中的RS基因PaSTS再同源转化入挪威云杉进行过表达时,仅在代谢产物中检测到四羟基芪糖苷均二苯乙烯和异土大黄苷两种物质的含量有明显升高,而未检测到Res含量的明显变化,推测挪威云杉中RS基因参与合成的Res可能进一步通过羟基化、O-甲基化和O-糖基化等多种过程而被加工、修饰[34]。虽然产物在植物体内的后期加工和修饰可能会影响到Res的产生及产量,但该过程同时也会产生一些有利的物质。据报道,Res衍生物紫檀芪 (Pterostilbene)在体外具有比Res更强的抗菌等生物活性,因此有关植物中Res的后期加工及修饰也受到研究者的关注。2011年,Xu等将葡萄中Res甲基转移酶(Resveratrol O-methyltransferase, ROMT) 基因ROMT和RS基因VST1共转化入烟草后,转基因烟草中可检测到紫檀芪的积累[35]。之后,Rimando等也报道了共转化ROMT基因和RS基因,可在拟南芥代谢产物中检测到紫檀芪的积累[36]。
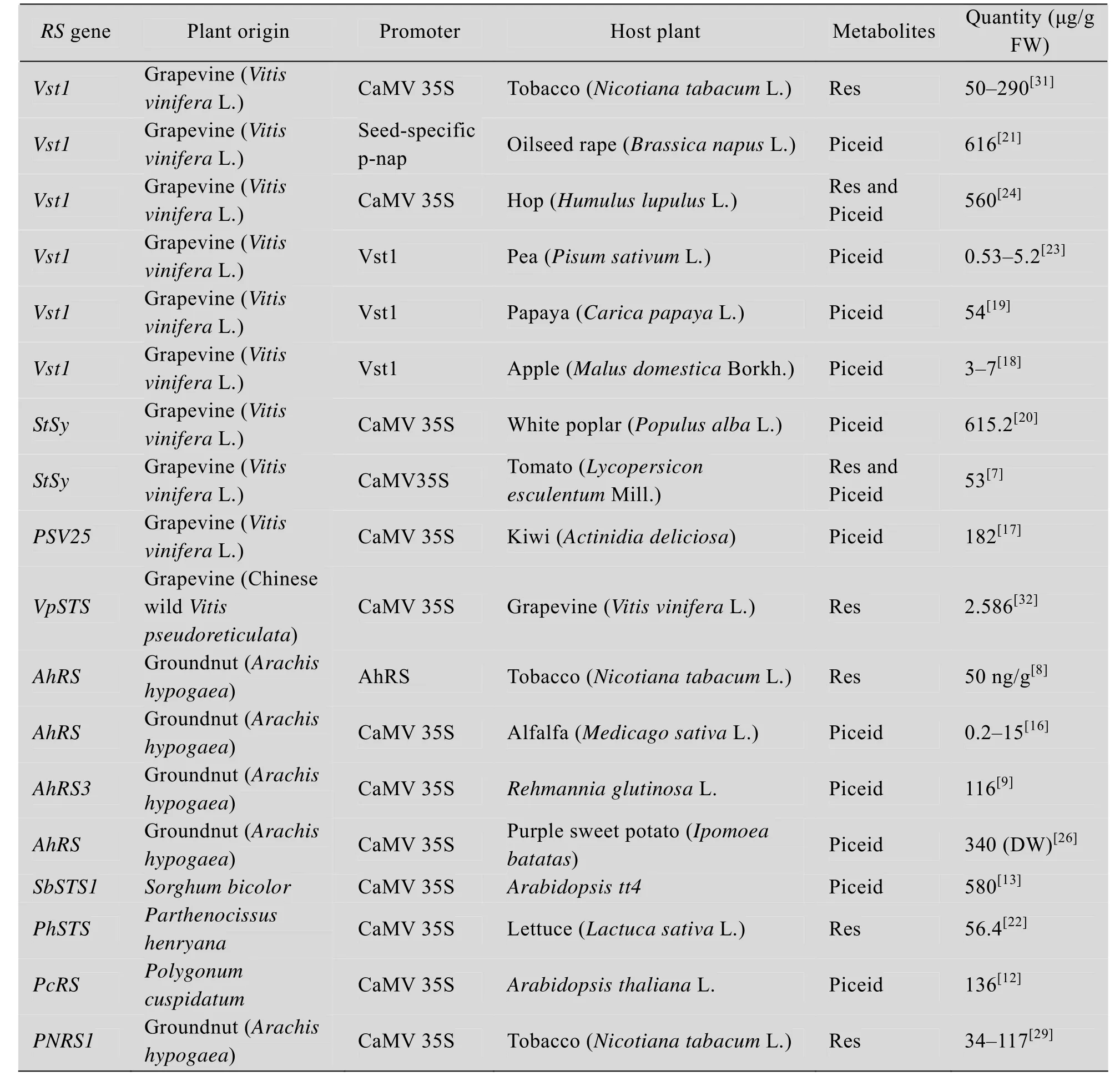
表1 转RS基因植物中Res及白藜芦醇糖苷的积累Table 1 Accumulation of Res and piceid in RS transgenic plants
表1列出了转RS基因植物中Res或其衍生物的积累量,一般在0.2–616 μg/g鲜重之间,如在转基因苹果和豌豆中Res或其衍生物的含量较低,约0.5–7 μg/g鲜重[18,23],而在转基因油菜和啤酒花中,相应物质的含量较高,约为560–616 μg/g鲜重[21,24]。本实验室对转基因烟草和水稻中Res的含量也进行了测定,前期研究通过紫外分光光度法测得转基因烟草叶片中Res含量较野生型提高了34 μg/g鲜重[29],之后进一步通过HPLC的方法,对转基因水稻幼苗和种子中的Res含量进行了测定,结果显示水稻幼苗和种子中相应物质的含量较野生型对照材料中也有所提高(数据未发表)。这种产物量上的差异,除了受基因在受体植物中转录及表达差异的影响外,或许与受体植物中内源香豆酰辅酶A和丙二酰辅酶A含量以及代谢相关酶如CHS等的活性的差异有关。同时,对RS基因异源转化入受体植物后,植物体内代谢产物及含量变化的分析发现,黄酮醇等类黄酮物质的含量有轻微下降,而ɑ-酸、β-酸、柚皮素和异戊烯基黄酮等黄酮类代谢物,以及黄烷醇、根皮素衍生物和羟基肉桂酸等酚类化合物的含量则没有明显改变[18,24]。Hüsken等在转Vst1基因的油菜中,通过干扰UDP葡萄糖芥子酸糖基转移酶表达而抑制芥子酸酯的合成,从而减少对前体物质4-香豆酸的利用从而达到增加Res合成的效果,而油、蛋白质、脂肪酸和硫代葡萄糖甙等物质的含量则未检测到明显变化[21]。而番茄中转入RS基因后导致的转基因番茄中芸香苷、柚皮素和绿原酸等物质的含量的变化,则被认为可能与遗传转化等过程相关,而非外源基因转入引起的[7]。
2 转RS基因植物的表型和功能
2.1 抗病原菌活性
葡萄受到灰霉菌Botrytis cinerea侵染时体内会积累RS基因的mRNA和Res,且已有报道显示,Res在体外对病原菌具有一定的抑制作用[2],表明RS基因可参与植物抗病过程,从而使RS基因对植物材料的转化与受体植物对病原菌的防御等相关研究受到研究者的广泛关注。Hain等发现,转花生RS基因的烟草受大豆疫霉侵染后,植物体内可诱导RS基因的mRNA积累,显示转基因植物中RS基因的转录与病原菌侵染存在一定相关性[8]。之后,Hain等又报道了葡萄RS基因Vst1异源转化入烟草后,转基因烟草对灰霉菌的抗性较野生型烟草有所提高,这是RS基因转化可提高受体植物对病原菌抗性的首次报道[6]。2005年,Serazetdinova等研究显示,将葡萄的RS基因Vst1和Vst2异源转化入小麦后,转基因小麦抵抗小麦叶锈菌Puccinia reconditaf. sp.tritici和小麦颖枯病菌Septoria nodorumBerk.的侵染能力提高,发病症状较野生型材料明显减轻[15]。Zhu等的研究也显示,转入葡萄Vst1的番木瓜中,RS基因的mRNA和白藜芦醇糖苷的积累受棕榈疫霉Phytophthora palmivora感染的诱导,转基因植株与对照相比表现出更强的抗真菌活性[19]。对转Vst1基因的水稻的研究显示,转基因植株中Vst1基因的mRNA的积累与植物受稻瘟病Pyricularia oryzae侵染的程度呈正相关,植株受真菌侵染后其体内Vst1的mRNA可在短时间内积累,从而使转基因水稻对稻瘟病的抗性增强[37]。研究结果还显示,转Vst1基因还可同时提高水稻对白叶枯病Xanthomonas oryzae等病害的抗性[14]。本实验室在获得花生RS基因异源转化的水稻材料的基础上,将转基因水稻进行了温室及大田种植,初步观察显示,转基因水稻对稻瘟病等病害侵染的抵抗能力较野生型有所提高,转基因水稻叶片提取液在体外对稻瘟病菌的生长具有一定的抑制作用,同时转基因植株在室内接种稻瘟病菌的条件下,表现出良好的抗病性[38]。
鉴于启动子对于基因的表达及受体植物所表现的生理生化特性具有重要的调控作用,故增强型和诱导型启动子在RS基因与植物抗病性研究方面也有较多应用。如前文所述,RS基因主要通过自身启动子的调控进行异源表达,而Hipskind等的研究结果显示,以增强型CaMV 35S为启动子时,经花生RS基因异源转化的转基因苜蓿,其叶片经茎点霉Phoma medicaginis处理后,与对照叶片相比,转基因叶片在坏死斑大小、密度和真菌繁殖方面的症状明显下降,而这种病原菌孢子形成的减少可大幅度降低茎点霉的传播和危害,表明转基因苜蓿抗病性有所提高[16]。同样以CaMV 35S为启动子,2005年,Lim等的研究结果也显示,异源转化入花生RS基因AhRS3的地黄可较好地抵抗尖镰孢菌Fusarium oxysporum的侵染[9];2011年,Liu等也报道,转虎杖RS基因PcRS的拟南芥,可通过抑制病菌孢子的繁殖,对菜心炭疽病Colletotrichum higginsianum具有一定抗性[12]。同时,Thévenot等还报道了将RS基因和诱导型启动子相结合,应用于葡萄成熟过程中抗病性的研究。他们将猕猴桃病原菌诱导型启动子PR10和基因Vst1构建成嵌合基因导入葡萄中进行表达,获得的大部分转基因株系中Res产量都有所提高,产量为非转基因株系的5–100倍,且这些Res含量升高株系的离体叶片在受到灰霉菌感染时,感病症状均大幅减轻,表明病原菌诱导型启动子和抗性基因的组合在增加葡萄对真菌的抗性及耐受性方面具有一定作用,但具体作用机制及应用前景还有待进一步验证[39]。
然而,RS基因转化所引起的受体材料抗性的改变并非完全是正向的,也存在部分受体材料对病原菌抗性未提高以及致敏的报道。2000年,Kobayashi等的研究结果显示,转CaMV 35S启动子调控的葡萄RS基因PSV25的猕猴桃叶片中有白藜芦醇糖苷的产生,但这些转基因植株并没有对灰霉菌的侵染表现出抗性[17]。2004年,Giorcelli等也报道,转CaMV 35S启动子调控的葡萄RS基因StSy的白杨树中检测到顺式和反式两种白藜芦醇糖苷的产生,但该转基因植株对杨树叶锈病Melampsora pulcherrima未表现抗性。研究者对相关结果的分析指出,植物的抗病性与植物体内游离的Res和其二聚体e-葡萄素水平直接相关,而芪类的抗真菌活性与其疏水性有关,因此虽然转基因材料中合成了Res的相关代谢产物白藜芦醇糖苷,但其作为Res的可溶形式,在抗病原菌方面的生物活性可能较低,导致转基因材料抗病能力并没有明显变化[20]。2009年,Hanhineva等还报道,转葡萄RS基因NS-Vitis3的草莓中没有检测到预期的Res或其衍生物,但叶片代谢物中肉桂酸、香豆酸和阿魏酸衍生物含量升高,类黄酮含量降低,并且这些酚类成分的变化导致该转基因草莓对灰霉病的敏感性增加,认为这种现象可能与草莓中苯丙氨酸代谢途径有关,但目前对该过程了解还不够深入,因此对这种遗传修饰结果还不能作很好的解释[25]。
2.2 抗自由基活性
RS基因在植物中表达产生的Res及其衍生物都具有多酚结构,因此具有很强的清除自由基和抑制自由基引起的氧化损伤的能力,可在提高抗氧化酶活性、降低 H2O2和O2-等活性氧(ROS) 水平方面发挥作用。2005年,Giovanna等的研究结果显示,转RS基因StSy的番茄中,反式Res的含量随番茄果实的成熟而发生变化,且含有反式Res的转基因果实中抗坏血酸和谷胱甘肽等抗氧化成分的初级代谢物含量上升,转基因番茄较野生型番茄的抗氧化活性升高,脂质过氧化程度降低[7]。Morelli等利用电子顺磁共振光谱 (EPR) 对导入RS基因后体内Res合成增多的转基因番茄果实进行抗自由基活性检测,结果显示,转基因番茄的抗自由基活性是普通番茄的两倍,且这种差异随着果实的成熟而更加明显[40]。
植物果实抗自由基活性的升高可用于提高果实的营养价值。2009年,Annalisa等报道了将果实特异性启动子TomLoxB控制的葡萄RS基因StSy导入番茄以提高其营养价值,在成熟转基因番茄果皮中检测到有反式Res和反式白藜芦醇糖苷的积累,果实的抗坏血酸和抗氧化能力都有明显升高[41]。这种营养效应在试验中也得到了证实。用经RS基因遗传修饰后的番茄果实饲喂老鼠,较以未经改造的番茄饲喂的老鼠表现出更好的心脏机能,如心肌梗塞规模减小,心肌细胞凋亡数目减少,氧化程度降低等[40]。另有研究指出,转RS基因的番茄果实提取物,对抗生素佛波酯 (Phorbol ester) 在单核巨噬细胞中引起的促炎作用有更好的抑制能力,推测转基因番茄中合成的Res等芪类代谢物可能通过抑制细胞内环加氧酶活性而发挥作用[41]。同时,这种抗自由基活性的提高还可用于许多果实,特别是农作物相关果实的储存。Ureňa等就曾用0.16 mmol/L的Res对采摘后的苹果作短时间(5 s) 处理,与未处理的苹果于室温条件下储存75 d后做比较,发现Res处理过的苹果保存良好,而未处理的苹果已经腐烂变质,显见其有效性,但目前有关转RS基因果实与非转基因果实在储存方面差异的报道仍较少[42]。
植物体内抗自由基活性的增强,除了有利于提高转基因植物果实的营养价值和延长储存时间,也可参与提高植物对自然界的胁迫抗性过程,如降低因紫外辐射对植物造成的伤害和延缓叶片衰老等[43]。目前,大气中臭氧层的破坏导致光照中紫外辐射强度增加,对植物生长发育造成严重影响,表现为破坏蛋白质、核酸和膜脂,影响光合系统和代谢产物合成,造成植株发育不良,农作物产量和品质下降[44]。Res和RS基因转录产物的积累均受到UV诱导,表明它们之间存在一定的相关性。2010年,Tang等报道,花生经UV-C处理后内源性Res和RS基因的mRNA迅速且大量地积累,UV-C辐射前用Res处理可减少UV-C导致的花生叶片锈斑和枯萎,且SOD、谷胱甘肽还原酶 (GSR)、抗坏血酸过氧化物酶 (APX) 和脱氢抗坏血酸还原酶(DHAR) 等物质的活性在Res处理后都有所提高,而以3,4-亚甲基二氧肉桂酸抑制Res活性则可加剧UV-C造成的损伤,说明Res可通过影响植物体内抗氧化酶活性以应对UV-C引起的氧化胁迫[45],转入RS基因以提高受体植物体内Res含量可作为一种减少紫外辐射造成植物伤害的有效途径。研究结果表明,转RS基因的烟草受紫外胁迫后伤害症状较野生型轻,且转基因烟草株系胁迫损伤后其恢复情况与体内Res含量正相关,说明转RS基因在缓解植株紫外损伤方面有一定作用[29]。
叶片衰老是植物生长过程中的正常生理现象,除自然老化外,自然界中的诸多胁迫因素,如光照不足、紫外辐射、低温、干旱、营养缺乏、机械损伤和病原体侵染等,都能引起植物叶片早衰。叶片早衰伴随着光合作用能力下降、蛋白质降解和脂质过氧化,直接导致农作物产量锐减,是全球农作物产量损失的一个主要原因[46]。前文所述,Res的积累可降低植物细胞内ROS水平,从而推测其可直接作用于延缓植物叶片衰老,RS基因的异源转化与受体植物延缓叶片衰老之间存在一定相关性。本实验室前期研究中,已将RS基因PNRS1转入水稻品种“圣稻13”中进行表达[30],目前正以获得的转基因水稻为材料,对RS基因与紫外胁迫、叶片衰老等性状的相关性进行研究。同时,Res可降低UV对动物细胞的损伤及延长微生物与动物寿命的研究已有报道[2],然而关于转RS基因植物中Res及其衍生物的积累如何参与植物抗UV胁迫以及延缓叶片衰老的研究还鲜有报道,随着对Res这种物质及抗自由基活性研究的深入,这些问题有望被逐一解答。
2.3 花青素着色改变和雄性不育现象
研究报道,RS基因经异源转化、表达后,大部分受体植物的生长发育正常,但在烟草、拟南芥和番茄等少数物种中发现,RS基因的过表达对花青素着色和花粉发育具有一定影响。1997年,Fischer等的研究结果显示,过表达RS基因Vst1的烟草株系花色着色发生改变,究其原因可能与导入的RS与内源CHS竞争底物相关,并指出而该特性可应用于改变花色的研究中[31]。2011年,Liu等报道,转虎杖RS基因PcRS的拟南芥种子的种皮颜色与野生型拟南芥种子的种皮颜色存在差异,检测表明,转基因拟南芥中花青素含量明显下降,而CHS基因表达未受影响,认为导入的外源RS与植物内源CHS在底物利用上存在竞争从而导致该表型的出现[12]。2012年,Rimando等也报道,转高粱O-甲基转移酶基因SbOMT3和花生RS基因AhRS3的烟草中,虽检测到具有更高生物活性的Res衍生物紫檀芪的积累,但转基因烟草花色着色降低,二氢槲皮素衍生的黄酮类和苯丙氨酸结合的多胺类成分大幅下降,文中指出RS基因的转化应考虑将其对苯丙氨酸衍生代谢物的影响最小化[36]。综合以上研究结果,显示烟草和拟南芥中花青素着色改变,与外源转入RS基因后合成的表达产物RS与受体植物内源的CHS竞争底物直接相关,即RS基因过表达使得RS积累,导致CHS可利用底物减少,以致合成花青素所需的类黄酮等代谢物合成减少而引起花色改变。然而,除烟草和拟南芥外,其他植物中的转RS基因研究并未提及这种表型改变,且研究结果显示转RS基因的地黄和啤酒花生长发育均正常[9,24],这或许与外源RS基因表达水平较低,或这些受体植物内源的丙二酰辅酶A等底物水平较高有关。
RS基因的表达还可导致花粉雄性不育。Fischer等报道,过表达RS基因Vst1的烟草株系表现出完全的雄性不育,而在基因表达水平较低的株系中雄性不育现象则不是很明显,且当Vst1基因由金鱼草Antirrhinum majus绒毡层特异性启动子tap1驱动表达时,所有株系均表现出雄性不育现象,说明RS基因与花粉发育及育性有一定的相关性;另外,实验结果还显示,外源补加CHS所需的前体物质可在一定程度上缓解花粉雄性不育,因此推测,花粉育性的改变可能也是因为导入的RS基因与内源CHS竞争底物,使得类黄酮等物质的合成减少所致[31]。但随着研究的深入,研究者否认了类黄酮等物质合成减少导致花粉败育的可能性。2006年,Höfig等的研究结果显示,转化松树雄果特异性启动子PrMALE1所驱动的RS基因的烟草,有70%表现出完全的雄性不育表型,显微观察显示转基因烟草和野生型烟草在花粉发育过程中存在差异,失活花粉的孢子外壁层与正常花粉的在结构上有所不同,但孢子花粉素的合成并没有受影响,且黄酮类物质只在正常花粉发育的晚期产生,因此排除了黄酮类物质合成减少是导致花粉败育的原因[47]。2011年,Ingrosso等的研究结果也表明,转入葡萄RS基因StSy的番茄表现为花粉雄性不育,其花粉显微结构与正常花粉的存在差异,转基因番茄中柚皮素合成明显下降,其他糖基化类黄酮物质含量上升,该结果进一步排除了类黄酮合成下降是导致番茄单性结实的原因[48]。同时,对其他成分的分析发现,木质素和孢子花粉素合成所需前体物质香豆酸和阿魏酸的含量明显下降,推测这些结构成分的破坏可能是导致花粉失活的原因,但具体机制还有待于进一步验证[48]。综合以上研究成果,认为RS基因的转化在一定程度上可导致部分受体材料雄性不育,该现象在遗传转化过程中应受到一定的关注。同时,该特性在杂交育种中也具有潜在的应用价值。
3 RS基因在微生物中的转化及应用
RS基因在微生物中的转化,主要是为构建工业化生产Res的平台作准备。鉴于Res等植物次级代谢产物都具有多样化的生物活性,故在医药、保健和食品等行业存在广泛的需求,该方面的工作被认为是应对这些需求的一条有效途径。Res属于聚酮类化合物家族中的芪合物家族,具有多酚结构,因此利用RS基因在微生物或动物细胞中代谢产生Res,需保证苯丙氨酸类底物或酪氨酸类底物的充足,以供代谢使用,即需在微生物中导入相关基因构建Res合成途径。已知酵母中存在RS的底物丙二酰辅酶A,但是没有p-香豆酰辅酶A,所以在酵母中引入RS的催化反应,需要先使酵母产生p-香豆酰辅酶A。Res在酵母中代谢合成的一个实例是基于白酒品质的改善,即葡萄中Res主要积累于果皮中,而在果肉中含量很低,这使得带果皮发酵产生的红酒中Res含量明显高于白酒。于是Becker等构建了杨树Hybrid poplar辅酶A连接酶基因4CL216和RS基因Vst1的共表达系统,并转化酿酒酵母Saccharomyces cerevisiaeFY23,实验证实转基因酵母菌株能够将葡萄果汁中含有的成分p-香豆酸代谢生成p-香豆酰辅酶A,进而合成Res,从而提高发酵产生的红酒和白酒中Res含量,以提高酒类的品质[49]。类似的方法也被应用于大肠杆菌,Watts等报道了将花生RS基因和拟南芥4-香豆酰辅酶A连接酶基因4CL1共转化大肠杆菌Escherichia coliBW27784,在培养基中通过添加4-香豆酸后,可在产物里检测到大于100 mg/L的Res[50]。
然而,如何通过条件优化以达到提高Res产量的目的,是广大科研工作者面临的一大难题。表2列出了在不同培养条件下,不同酵母和大肠杆菌菌株中Res的合成及产出情况。目前认为,影响Res产量的因素主要包括菌株、目标基因来源、载体、培养基和前体等,不同研究者选取的条件不同,着重的优化方向也不同。Zhang等的研究结果显示,共转化拟南芥4CL基因和葡萄RS基因的酵母,在添加4-香豆酸的培养基中可合成Res,但当从红假单胞菌Rhodobacter sphaeroides中分离的一个翻译融合蛋白加入到4CL和RS之间后,酵母细胞的Res产量由0.65 mg/L提高到5.25 mg/L,说明4CL和RS这两种酶的协同作用有利于Res的合成,该实验室进一步对合成条件进行了优化,最终可使酵母细胞中Res的产量达到14.4 mg/L[51]。2010年,Sydor等报道,共转化拟南芥4CL基因和葡萄RS基因的酵母,在富营养YEPD培养基中的Res产量比在普通SD培养基中的高,而都生长于YEPD培养基中时,酵母菌Saccharomyces cerevisiaeCEN.PK2-1的Res产量为262 mg/L,而酵母菌S. cerevisiaeBarra Grande的Res产量为391 mg/L,这是目前酵母中Res产量的最高报道[52]。2011年,Lim等比较了不同物种来源的RS基因、不同表达系统、不同遗传背景和底物水平对转基因大肠杆菌合成Res能力的影响,结果显示,转化含有拟南芥4CL基因和葡萄RS基因的pUC系统的大肠杆菌 (BW27784) 株系中,Res产量可达1.4 g/L,进一步在培养基中加入0.05 mmol/L脂肪酸合成抑制剂浅蓝菌素(Cerulenin) 后,Res产量可增高至2.3 g/L[53]。以上这些对培养条件和Res合成影响因子的研究,将对在微生物中构建工业化生产Res等植物代谢物的平台起到极大的促进作用。

表2 通过基因工程手段在微生物中进行Res的生产Table 2 Production of Res in microbes by genetic engineering
此外,2009年,Trantas等的研究结果表明,共导入杨树苯丙氨酸解氨酶PAL、细胞色素P450还原酶CPR、大豆肉桂酸4-羧化酶C4H、4CL以及葡萄RS后的酵母,能够利用苯丙氨酸合成Res[56]。2012年,Shin等也报道,共转化苯丙氨酸解氨酶基因PAL、拟南芥肉桂酸4-羧化酶基因C4H、拟南芥4CL基因和花生RS类基因的酿酒酵母,在含有2%半乳糖的培养基中可产生2.6 mg/Lp-香豆酸和3.3 mg/L Res,进一步在原重组酵母的基础上过表达乙酰辅酶A羧化酶基因ACC1以解决酵母中丙二酰辅酶A缺乏的问题后,重组酵母中Res的产量提高到了4.3 mg/L,当酪氨酸添加到培养基中后,Res的产量可达到5.8 mg/L[55]。该方面的研究为利用廉价氨基酸实现高经济效益Res的生产提供了线索及参考依据,预期可产生较大的经济效益。
4 研究展望
转RS基因旨在增加植物体内Res及其衍生物的积累,以提高植物应对病原菌胁迫和非生物胁迫的能力,满足人们对健康及保健产品日益增加的需求。本实验室前期研究结果表明:转RS基因不仅可提高植株对病菌的抗性,更能增加植株应对紫外胁迫时的缓解能力,以及通过降低植物体内ROS的水平,从而对延缓叶片衰老起到积极作用。随着RS基因被越来越多的应用于不同物种的基因工程研究,特别是农作物的遗产改良及品种培育,对于RS如何参与胁迫响应及其作用机制还有待深入研究,以期进一步将RS及其代谢产物Res的生物学特性,如抗自由基活性、育性等,应用于植物抗胁迫和生长发育调控过程;同时,通过转入RS基因从而提高受体植物自身的营养附加值也是值得关注的一个方面。此外,提高转RS基因的重组微生物中 Res的产量,从而形成有效的经济化生产平台,以应对 Res在食品、保健和医药等行业的需求也是一种发展的必然趋势。
[1]Delaunois B, Cordelier S, Conreux A, et al.Molecular engineering of resveratrol in plants.Plant Biotechnol J, 2009, 7(1): 2–12.
[2]Kovacic P, Somanathan R. Multifaceted approach to resveratrol bioactivity: focus on antioxidant action, cell signaling and safety. Oxid Med Cell Longev, 2010, 3(2): 86–100.
[3]Han JJ, Liu W, Bi YP. Advances in resveratrol studies. Chin J Biotech, 2008, 24(11): 1851–1859(in Chinese).韩晶晶, 刘炜, 毕玉平. 白藜芦醇的研究进展.生物工程学报, 2008, 24(11): 1851–1859.
[4]Schröder G, Brown JW, Schröder J.Molecular analysis of resveratrol synthase: cDNA, genomic clones and relationship with chalcone synthae. Eur J Biochem, 1988, 172(1): 161–169.
[5]Melchior F, Kindl H. Grapevine stilbene synthase cDNA only slightly differing from chalcone synthase cDNA is expressed inEscherichia coliinto a catalytically active enzyme. FEBS Lett,1990, 268(1): 17–20.
[6]Hain R, Reif HJ, Krause E, et al. Disease resistance results from foreign phytoalexin expression in a novel plant. Nature, 1993, 361(6408): 153–156.
[7]Nicoletti I, De Rossi A, Giovinazzo G, et al.Identification and quantification of stilbenes in fruits of transgenic tomato plants (Lycopersicon esculentumMill.) by reversed phase HPLC with photodiode array and mass spectrometry detection.J Agric Food Chem, 2007, 55(9): 3304–3311.
[8]Hain R, Bieseler B, Kindl H, et al. Expression of a stilbene synthase gene inNicotiana tabacumresults in synthesis of the phytoalexin resveratrol. Plant Mol Biol, 1990, 15(2): 325–335.
[9]Lim JD, Yun SJ, Chung IM, et al. Resveratrol synthase transgene expression and accumulation of resveratrol glycoside inRehmannia glutinosa. Mol Breeding,2005, 16(3): 219–233.
[10]Han JJ, Liu W, Bi YP. Molecular cloning of peanut resveratrol synthetic enzyme 1 (PNRS1) and its expression in prokaryote. Acta Agron Sin, 2010,36(2): 341–346 (in Chinese).
韩晶晶, 刘炜, 毕玉平. 花生白藜芦醇合成酶基因PNRS1的克隆及其在原核中的表达. 作物学报, 2010, 36(2): 341−346.
[11]Zhong J, Liu SJ, Ma SS, et al. Effect of matrix attachment regions on resveratrol production in tobacco with transgene of stilbene synthase fromParthenocissus henryana. Acta Botan Sin,2004,46(8): 948–954 (in Chinese).
钟瑾, 刘树君, 马世嵩, 等. 核基质结合区对转爬山虎芪合酶基因烟草中产生白藜芦醇的作用.植物学报, 2004, 46(8): 948–954.
[12]Liu ZY, Zhuang CX, Sheng SJ, et al.Overexpression of a resveratrol synthase gene(PcRS) fromPolygonum cuspidatumin transgenicArabidopsiscauses the accumulation oftrans-piceid with antifungal activity. Plant Cell Rep, 2011, 30(11): 2027–2036.
[13]Yu CK, Lam CN, Springob K,et al. Constitutive accumulation ofcis-piceid in transgenicArabidopsisoverexpressing a sorghum stilbene synthase gene.Plant Cell Physiol, 2006, 47(7): 1017–1021.
[14]Tian WZ, Ding L, Cao SY, et al. Rice transformation with a phytoalexin gene and bioassay of the transgenic plants. J Integr Plant Biol, 1998, 40(9): 803–808 (in Chinese).
田文忠, 丁力, 曹守云, 等. 植物抗毒素转化水稻和转基因植株的生物鉴定. 植物学报: 英文版,1998, 40(9): 803–808.
[15]Serazetdinova L, Oldach KH, Lörz H. Expression of transgenic stilbene synthases in wheat causes the accumulation of unknown stilbene derivatives with antifungal activity. J Plant Physiol, 2005, 162(9):985–1002.
[16]Hipskind JD, Paiva NL. Constitutive accumulation of a resveratrol-glucoside in transgenic alfalfa increases resistance toPhoma medicaginis. Mol Plant Microbe Interact, 2000, 13(5): 551–562.
[17]Kobayashi S, Ding CK, Nakamura Y, et al.Kiwifruits transformed with a vitis stilbene synthase gene produce piceid (resveratrol-glucoside). Plant Cell Rep, 2000, 19(9): 904–910.
[18]Szankowski I, Briviba K, Fleschhut J,et al.Transformation of apple (Malus domesticaBorkh.)with the stilbene synthase gene from grapevine (Vitis viniferaL.) and a PGIP gene from kiwi (Actinidia deliciosa). Plant Cell Rep,2003, 22(2): 141–149.
[19]Zhu YJ, Agbayani R, Jackson MC, et al.Expression of the grapevine stilbene synthase geneVST1in papaya provides increased resistance against diseases caused byPhytophthora palmicora. Planta, 2004, 220(2): 241–250.
[20]Giorcelli A, Sparvoli F, Mattivi F,et al.Expression of the stilbene synthase (StSy) gene from grapevine in transgenic white poplar results in high accumulation of the antioxidant resveratrol glucosides. Transgenic Res, 2004, 13(3): 203–214.
[21]Hüsken A, Baumert A, Milkowski C,et al.Resveratrol glucoside (Piceid) synthesis in seeds of transgenic oilseed rape (Brassica napusL.). Theor Appl Genet,2005, 111(8): 1553–1562.
[22]Liu S, Hu Y, Wang X, et al. High content of resveratrol in lettuce transformed with a stilbene synthase gene ofParthenocissus henryana. J Agric Food Chem, 2006, 54 (21): 8082–8085.
[23]Richter A, Jacobsen HJ, de Kathen A, et al.Transgenic peas (Pisum sativum) expressing polygalacturonase inhibiting protein from raspberry (Rubus idaeus) and stilbene synthase from grape (Vitis vinifera). Plant Cell Rep,2006,25(11): 1166–1173.
[24]Schwekendiek A, Spring O, Heyerick A, et al.Constitutive expression of a grapevine stilbene synthase gene in transgenic hop (Humulus lupulusL.) yields resveratrol and its derivatives in substantial quantities. J Agric Food Chem,2007,55(17): 7002–7009.
[25]Hanhineva K, Kokko H, Siljanen H,et al.Stilbene synthase gene transfer caused alterations in the phenylpropanoid metabolism of transgenic strawberry (Fragaria × ananassa). J Exp Bot,2009, 60(7): 2093–2106.
[26]Pan LP, Yu SL, Chen CJ,et al. Cloning a peanut resveratrol synthase gene and its expression in purple sweet potato. Plant Cell Rep, 2012, 31(1):121–131.
[27]Hu XP, Shang WJ, Cai WQ, et al. Transgenic plants ofBrassica campestriswith resveratrol synthase gene. J Agr Biotechnol, 2006, 14(2):231–234 (in Chinese).
胡小平, 商文静, 蔡文启, 等. 芪合酶基因转化小白菜的研究. 农业生物技术学报, 2006, 14(2):231–234.
[28]Lin M, Cao L, Guo SH, et al. Transformation of resveratrol synthase (RS) gene of grape into carrot and screening of its transgenic plants with high content of resveratral. J Agr Biotechnol, 2007,15(6): 987–991 (in Chinese).
林明, 曹蕾, 郭世辉, 等. 白藜芦醇合成酶(RS)基因转化胡萝卜及高白藜芦醇转基因胡萝卜株系筛选. 农业生物技术学报, 2007, 15(6): 987–991.
[29]Bi C, Li Z, Liu Q, et al. Determination of resveratrol in transgenic tobacco leaves by UV spectrophotometry. Shandong Agric Sci, 2011, 1:93–96 (in Chinese).
毕琮, 李臻, 刘倩, 等. 紫外分光光度法测定转基因烟草叶片中白藜芦醇的含量. 山东农业科学, 2011, 1: 93–96.
[30]Li HQ, Liu X, Wang QG, et al. Construction of biosafe vectors of resveratrol synthase gene and rice genetic transformation. Acta Agric Breali-Sin,2011, 26(2): 114–118 (in Chinese).
李海青, 柳絮, 王庆国, 等. 生物安全性白藜芦醇合成酶表达载体的构建及水稻遗传转化. 华北农学报, 2011, 26(2): 114–118.
[31]Fischer R, Budde I, Hain R. Stilbene synthase gene expression causes changes in flower colour and male sterility in tobacco. Plant J, 1997, 11(3):489–498.
[32]Fan CH, Pu N, Wang XP, et al.Agrobacterium-mediated genetic transformation of grapevine (Vitis viniferaL.) with a novel stilbene synthase gene from Chinese wildVitis pseudoreticulata. Plant Cell Tiss Organ Cult, 2008,92(2): 197–206.
[33]Lo C, Le Blanc JC, Yu CK, et al. Detection,characterization, and quantification of resveratrol glycosides in transgenicArabidopsisover-expressing a sorghum stilbene synthase gene by liquid chromatography/tandem mass spectrometry. Rapid Commun Mass Spectrom,2007, 21(24): 4101–4108.
[34]Hammerbacher A, Ralph SG, Bohlmann J, et al.Biosynthesis of the major tetrahydroxystilbenes in spruce, astringin and isorhapontin, proceeds via resveratrol and is enhanced by fungal infection.Plant Physiol, 2011, 157(2): 876–890.
[35]Xu Y, Xu TF, Zhao XC, et al. Co-expression ofVpROMTgene from Chinese wildVitis pseudoreticulatawithVpSTSin tobacco plants and its effects on the accumulation of pterostilbene.Protoplasma, 2012, 249(3): 819–833.
[36]Rimando AM, Pan Z, Polashock JJ, et al. In planta production of the highly potent resveratrol analogue pterostilbene via stilbene synthase and O-methyltransferase co-expression. Plant Biotechnol J, 2012, 10(3): 269–283.
[37]Stark-Lorenzen P, Nelke B, Hänßler G, et al.Transfer of a grapevine stilbene synthase gene to rice (Oryza sativaL.). Plant Cell Rep, 1997,16(10): 668–673.
[38]Li HQ. Genetic engineering to develop resistant(blast, stripe) transgenic rice[D]. Jinan: Shandong Normal University, 2011 (in Chinese).
李海青. 基因工程培育抗病(稻瘟病、条纹叶枯病)转基因水稻[D]. 济南: 山东师范大学, 2011.
[39]Coutos-Thévenot P, Poinssot B, Bonomelli A, et al.In vitro tolerance toBotrytis cinereaof grapevine 41B rootstock in transgenic plants expressing the stilbene synthaseVst1gene under the control of a pathogen-inducible PR 10 promoter. J Exp Bot,2001, 52(358): 901–910.
[40]Morelli R, Das S, Bertelli A,et al.The introduction of stilbene synthase gene enhances the natural antiradical activity ofLycopersicon esculentummill. Mol Cell Biochem, 2006, 282(1/2): 65–73.
[41]D’Introno A, Paradiso A, Scoditti E, et al.Antioxidant and anti-inflammatory properties of tomato fruits synthesizing different amounts of stilbenes. Plant Biotechnol J, 2009, 7(5): 422–429.
[42]Gonzalez Ureňa A, Orea JM, Montero C, et al.Improving postharvest resistance in fruits by external application of trans-resveratrol. J Agric Food Chem, 2003, 51(1): 82–89.
[43]Pareek A, Sopory SK, Bohnert HJ, et al. Abiotic Stress Adaptation in Plants. 1st ed. Berlin: Springer Press, 2010: 91–102.
[44]Zhang J, Wang J, Tian LP. Advance in research on effect of enhanced UV-B radiation on plants. Chin Agric Sci Bull, 2009, 25(22): 104–108 (in Chinese).
张静,王进,田丽萍. 紫外线(UV-B)辐射增强对植物生长的研究进展. 中国农学通报, 2009,25(22): 104–108.
[45]Tang K, Zhan JC, Yang HR,et al. Changes of resveratrol and antioxidant enzymes during UV-induced plant defense response in peanut seedlings. J Plant Physiol, 2010, 167(2): 95–102.
[46]Liang QX, Cao GQ, Su MJ, et al. Research progress on plant leaf senescence. Chin Agric Sci Bull, 2006, 8(22): 282–285 (in Chinese).
梁秋霞, 曹刚强, 苏明杰, 等. 植物叶片衰老研究进展. 中国农学通报, 2006, 22(8): 282–285.
[47]Höfig KP, Möller R, Donaldson L, et al. Towards male sterility inPinus radiata– a stilbene synthase approach to genetically engineer nuclear male sterility. Plant Biotechnol J, 2006, 4(3): 333–343.
[48]Ingrosso I, Bonsegna S, De Domenico S, et al.Over-expression of a grape stilbene synthase gene in tomato induces parthenocarpy and causes abnormal pollen development. Plant Physiol Biochem, 2011, 49(10): 1092–1099.
[49]Becker JV, Armstrong GO, van der Merwe MJ,et al.Metabolic engineering ofSaccharomyces cerevisiaefor the synthesis of the wine-related antioxidant resveratrol. FEMS Yeast Res, 2003, 4(1): 79–85.
[50]Watts KT, Lee PC, Schmidt-Dannert C.Biosynthesis of plant-specific stilbene polyketides in metabolically engineeredEscherichia coli. BMC Biotechnol,2006, 6: 22–34.
[51]Jeandet P, Delaunois B, Aziz A,et al.Metabolic engineering of yeast and plants for the production of the biologically active hydroxystilbene, resveratrol. J Biomed Biotechnol, 2012, 2012: 579089.
[52]Sydor T, Schaffer S, Boles E. Considerable increase in resveratrol production by recombinant industrial yeast strains with use of rich medium.Appl Environ Microbiol, 2010, 76(10): 3361–3363.
[53]Lim CG, Fowler ZL, Hueller T, et al. High-yield resveratrol production in engineeredEscherichia coli. Appl Environ Microbiol, 2011, 77(10):3451–3460.
[54]Beekwilder J, Wolswinkel R, Jonker H, et al.Production of resveratrol in recombinant microorganisms. Appl Environ Microbiol, 2006,72(8): 5670–5672.
[55]Shin SY, Jung SM, Kim MD, et al. Production of resveratrol from tyrosine in metabolically engineeredSaccharomyces cerevisiae. Enzyme Microb Technol, 2012, 51(4): 211–216.
[56]Trantas E, Panopoulos N, Ververidis F. Metabolic engineering of the complete pathway leading to heterologous biosynthesis of varius flavonoids and stilbenoids inSaccharomyces cerevisiae. Metab Eng, 2009, 11(6): 355–366.

