引起猪腹泻的病毒分离鉴定
林庆燕,陈书琨,孙 洁,唐金明,2,陈 兵,卢体康,刘建利,廖立珊,曾少灵,祁振强,阮周曦,吕建强,杨俊兴,曹琛福,张彩虹,花群义,秦智锋*
(1.深圳出入境检验检疫局,广东深圳518045;2.华南农业大学,广东广州510642;3.深圳市宝舜泰生物医药股份有限公司,广东深圳518001)
猪腹泻是现代规模集约化养猪场的一种常见的多因素性疾病。在猪的疾病中,出现腹泻症状的占35%~40%左右,尤其是仔猪,发病率更高,给养猪业造成重大经济损失[1-2]。猪腹泻性疾病致病因素复杂,猪只发病症状极为相似,临床上很难诊断。引起猪腹泻性疾病的病原体主要包括病毒,如猪流行性腹泻病毒、猪传染性胃肠炎病毒、猪轮状病毒A、猪圆环病毒、高致病性蓝耳病病毒;细菌,如致病性大肠埃希菌、巴氏杆菌、沙门菌、痢疾杆菌、产气荚膜梭菌、葡萄球菌;寄生虫,如附红细胞体、弓形体、螺旋体等;其他因素,如饲料发霉变质引起霉菌毒素中毒等。自从2010年12月以来,我国华东、华南、华北等部分地区出现以仔猪腹泻为主要特征的疾病,导致仔猪死亡增加,给养殖户造成了巨大的经济损失,对生猪养殖构成了很大的危害。2013 年,猪流行性腹泻病毒已蔓延美国13个州,造成了严重的经济损失[1-3]。
为了对猪的主要病毒性腹泻病进行研究,我们自2011年开始,连续3年对华南等地引起猪腹泻的主要病毒进行了分离鉴定,并进行了流行病学调查。
1 材料与方法
1.1 材料
1.1.1 病料和细胞系 从华南、江苏等地9个猪场采集发生腹泻、濒临死亡仔猪的小肠及内容物、粪便、哺乳母猪的乳汁等临床样品共38 份。Vero-76传代细胞系、猴肾传代细胞系(MA-104),由深圳出入境检验检疫局动植物检验检疫技术中心动检实验室保存。
1.1.2 试剂与仪器 DMEM 营养液,Gibco公司产品;胰蛋白酶(Trypsin),Invitrogen公司产品;猪胰酶(porcine pancreatin),Sigma公司产品;鸡IgY 纯化试剂盒,Thermo 公司产品;TGEV/PEDV/Rotavirus三重实时荧光定量RT-PCR检测试剂盒,Life tec公司产品;Qiagen Viral RNA Mini Kit,Qiagen公司产品;ABI 7500HT荧光定量PCR仪,Qiagen EZ1advanced全自动核酸抽提工作站。
1.2 方法
1.2.1 样品的采集与处理
1.2.1.1 样品的采集 2011年,从华南地区3 个猪场采集具有腹泻临床症状的仔猪小肠内容物、粪便、哺乳母猪的乳汁样品12份;2012年从江苏2个猪场采集粪便临床样品11份;2013年从深圳、广州等4个猪场采集发生腹泻、濒临死亡仔猪的小肠及内容物、粪便,哺乳母猪的乳汁等临床样品15份。
1.2.1.2 样品的处理 取小肠内容物、乳汁和粪便样品,用生理盐水制成1∶10 的悬浮液,于4 ℃4 000r/min离心20 min,小心移去上层乳脂,取上清液经0.22μm 微孔滤膜过滤,收集滤液至少10 mL,分装编号,置-80 ℃保存。
1.2.2 样品的检测与鉴定 将各编号的38份滤液于Qiagen EZ1advanced全自动核酸抽提工作站抽提核酸后,按照TGEV/PEDV/Rotavirus三重实时荧光定量RT-PCR检测试剂盒说明书于ABI 7500HT 荧光定量PCR 仪进行检测,分析检测结果。
1.2.3 PEDV 分离与传代 按常规方法复苏Vero-76细胞和MA-104传代细胞系,将细胞培养至单层时,每种细胞系分别接种编号为2011-PEDV-1、2012-PEDV-1和2013-PEDV-6的病毒滤液各1份,每瓶接种病料滤液1mL。接种病料滤液后的细胞37 ℃吸附1h,其间轻摇2次。吸附结束后,在Vero-76细胞培养瓶中,加入含有20μg/mL 胰酶、10 μg/mL猪胰酶和20 mL/L 胎牛血清的DMEM 维持液,37 ℃培养72h,作为一个传代周期。传代前,将上一次的细胞培养物反复冻融3次,按上述方法进行盲传,显微镜观察细胞病变,同时用TGEV/PEDV/Rotavirus三重实时荧光定量RT-PCR检测试剂盒检测。传至第3代后,以后传代时只加入含有10μg/mL 胰酶和20mL/L 胎牛血清的DMEM维持液,37 ℃培养72h,作为一个传代周期。
1.2.4 PEDV 卵黄抗体的制备与纯化 将2013-PEDV-6的第3 代细胞培养液经超速离心后,按照常规方法采用5点法免疫注射蛋鸡3次,收集高免蛋黄液。将高免蛋黄液采用水稀释法和硫酸铵沉淀法进行粗提,再使用“鸡IgY 纯化试剂盒”进行纯化,得到高纯度的IgY 抗体。
1.2.5 PRoVA 的分离纯化 将1.2.4中制备和纯化获得的抗PEDV 高免卵黄抗体,与2011年混合感染的PEDV 和PRoVA 的样品编号为2011-PEDV+PRoVA-1的MA-104细胞培养液,按照1∶1的比例混合。放置于37 ℃中和30 min。再于MA-104细胞系上进行传代。显微镜观察细胞病变,同时用TGEV/PEDV/Rotavirus三重实时荧光定量RT-PCR检测试剂盒检测。再将传代培养液继续与PEDV 高免卵黄抗体反复中和、传代和检测,直至TGEV/PEDV/Rotavirus三重实时荧光定量RTPCR检测试剂盒检测时PEDV 检测结果为阴性。
2 结果
2.1 多重实时荧光定量RT-PCR检测结果
3年从9 个猪场38 份临床样品采用TGEV/PEDV/Rotavirus三重实时荧光定量RT-PCR检测试剂盒进行多重检测。2011年12份样品共检测到PEDV 和PRoVA 混合感染阳性样品2 份(编号:2011-PEDV+PRoVA-1 和2011-PEDV+PRoVA-2),只有PEDV 感染阳性样品4份。选取PEDV 和PRoVA 的Ct 值均最低的编号为2011-PEDV+PRoVA-1的小肠内容物样品作为研究对象,荧光定量RT-PCR 扩增图见图1。2012年11份样品共检测到PEDV、TGEV 和PRoVA 混合感染阳性样品6份,只有PEDV 感染阳性样品3份。选取母猪乳汁样品中Ct值均最低的编号为2012-PEDV+PRoVA+TGEV-3 的临床样品作为研究对象,荧光定量RT-PCR 扩增图见图2。2013 年15 份样品仅检测到PEDV 感染,且PEDV 均为阳性,无混合感染其他2种病毒。选取仔猪小肠内容物样品中Ct值最低编号为2013-PEDV-6的临床样品作为研究对象(荧光定量PCR 扩增图略)。对9个猪场的3年猪腹泻病毒性疾病流行病学调查表明,2011年—2013年主要是以PEDV 流行为主,各年份腹泻病毒统计见图3。
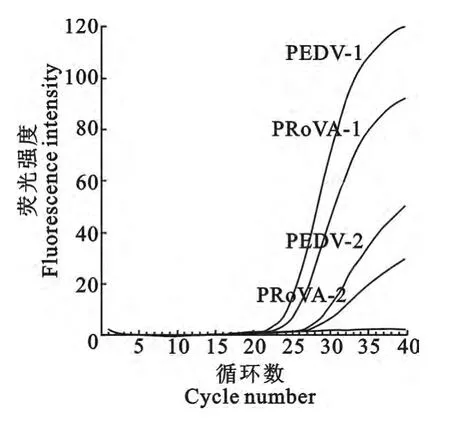
图1 2011年2份样品检测为PEDV 和PRoVA混合感染的样品检测结果Fig.1 Two samples were positive for PEDV&PRoVA in 2011
2.2 PEDV的细胞分离与传代结果
样品在Vero-76 传代细胞系连传,通过在前3代传代细胞培养液中加入胰蛋白酶和猪胰酶,后续传代中只加入胰蛋白酶的方式,成功实现了PEDV在Vero-76细胞上的连续传代,且在第8 代出现了细胞病变(CPE)(图4)。各代细胞培养上清液进行TGEV/PEDV/Rotavirus三重实时荧光定量RTPCR检测,均可检测出PEDV,且Ct值随着传代次数的增加而减少,表明病毒滴度随着传代次数的增加而增加。
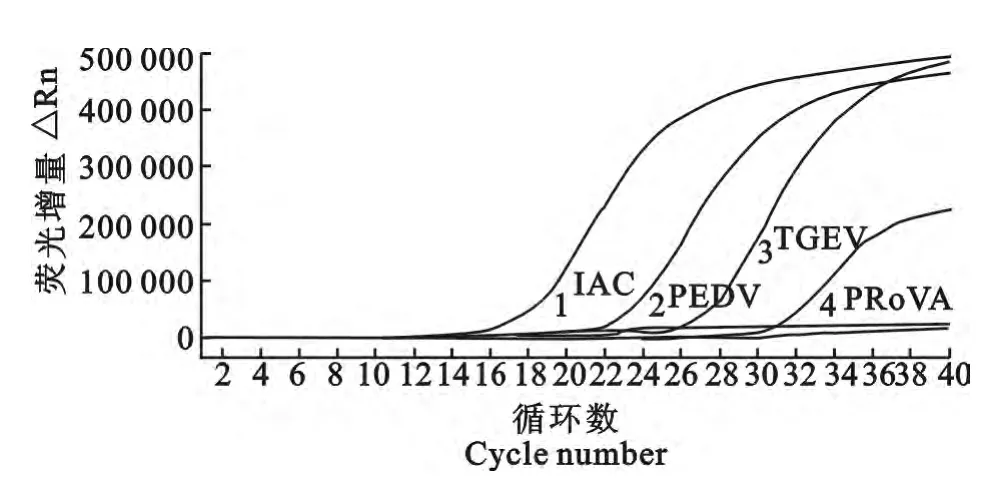
图2 2012年编号为2012-PEDV+PRoVA+TGEV-3母猪乳汁样品检测为PEDV、TGEV 和PRoVA 混合感染Fig.2 Sow milk sample(2012-PEDV+PRoVA+TGEV-3)was positive for PEDV,TGEV&PRoVA in 2012
2.3 PRoVA 分离与纯化结果
2011-PEDV+PRoVA-1 接种MA-104 细胞系后,第1代即出现细胞病变(图5)。经TGEV/PED V/Rotavirus三重实时荧光定量RT-PCR检测,结果PEDV 和PRoVA 均为阳性。通过用2013-PEDV-6制备的高免血清,连续中和3 代,于MA-104混合感染的2011-PEDV+PRoVA-1细胞培养液,在第4代再次进行TGEV/PEDV/Rotavirus三重实时荧光定量RT-PCR检测,结果只有PRoVA为阳性,PEDV 检测结果为阴性,表明成功分离纯化出PRoVA,编号为2011-PRoVA-1。
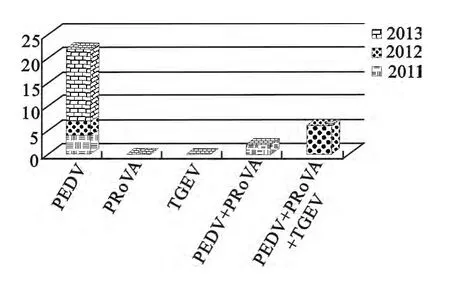
图3 2011年—2013年猪3种腹泻性病毒检测统计结果Fig.3 Statistical results of PEDV,TGEV&PRoVA among 2011-2013
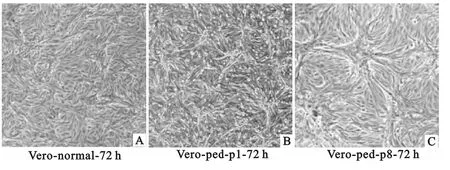
图4 Vero-76正常传代细胞、接种PEDV 后第1代和出现CPE后的第8代细胞培养结果Fig.4 CPE of 8th passage and 1st of passage with PEDV and normal Vero-76cell line
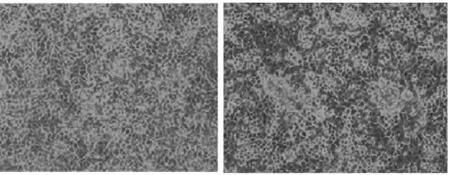
图5 MA-104正常传代细胞、接种2011-PEDV+PRoVA-1毒株后第1代出现CPE Fig.5 CPE of 1st of passage with 2011-PEDV+PRoVA-1strain and normal MA-104cell line
3 讨论
3.1 猪腹泻性疾病流行病学分析
自2011年开始,猪腹泻性疾病在我国出现大规模流行,并有愈演愈烈的趋势。在2011年采集的12份样品中,检测到有PEDV 感染或者PEDV 与PRoVA 混合感染的共有6份,其他样品检测结果3种病毒均为阴性。但不能排除剩余的6份样品中有其他病毒、细菌或者寄生虫。美国对2013年猪场猪腹泻性疾病的普查结果显示,猪场中有轮状病毒C感染存在[4-5]。也有研究认为,从患有腹泻性疾病的猪的临床样品中分离到产肠毒素大肠埃希菌K88、K99、987P等,也有检测到猪博卡病毒的[6-7]。在2012年11 份样品中,共检测到PEDV、TGEV 和PRoVA 混合感染阳性样品6份。可能在2011年出现猪腹泻疫情后,各养殖猪场加大了猪腹泻性疾病的防控,添加或使用抗菌药物预防细菌性和寄生虫性腹泻,使用一些腹泻病毒的疫苗,尤其是PEDV 活苗、TGEV活苗和PRoVA活苗来加大病毒性腹泻疫病的控制,但效果不佳。在我们检测到的3 种病毒中,TGEV和PRoVA可能来自疫苗毒,需要进一步测序确定。PEDV 分离株的S蛋白基因测序初步表明,与传统的PEDV毒株差异较大,估计是发生了较大的变异所致。2013年,15份样品中全部只分离到PEDV,并没有分离到其他病毒,估计是猪场发现使用疫苗效果不理想后,暂时停止使用活苗进行免疫,所以只分离到了PEDV。这3 年引起猪腹泻性疾病的主要病原体应该是PEDV 的变异株,而检测到的TGEV 和PRoVA,可能是疫苗株,并不引发猪腹泻。值得注意的是,在2012年和2013年,均采集了哺乳母猪的奶汁进行3种腹泻性病毒的检测,在母猪奶汁中发现大量的PEDV 存在,荧光定量RTPCR 的Ct值有时小于小猪小肠内容物的Ct值,表明母猪奶汁中PEDV 的含量高于发病仔猪小肠中病毒含量。这与猪场反映刚出生的仔猪吃完母猪奶汁后即出现腹泻的现象一致。尽管母猪不发病,建议有腹泻病例的猪场,暂时停止喂饲刚出生的仔猪。流行病学调查表明,这次多个地区发生和流行仔猪腹泻性疾病,主要病原是猪流行性腹泻病毒。其次是传染性胃肠炎病毒,也有猪轮状病毒病、Kobu病毒等,部分养殖场还有致病性大肠埃希菌和沙门菌继发感染[8-9]。
3.2 PEDV 和PRoVA 的分离培养
PEDV 和PRoVA 均可在MA-104细胞系、PK-15细胞系上生长,但需要经过胰酶处理[10]。本研究由于没有单独分离到PRoVA,所以采用中和方法中和PEDV,成功分离纯化到PRoVA。PRoVA 接种约48h后出现细胞病变(CPE),细胞肿胀变圆、折光性增强,颗粒物质增多;随着培养时间的延长,细胞固缩、隆起、脱落,细胞间隙变大,到72h时细胞大量脱落(70%以上),瓶壁上的细胞拉成网状。
由于PEDV 具有细胞毒性,很难在细胞上进行连续传代[4]。本研究分离PEDV 时,采用了Vero-76细胞系,刚开始只加入了胰蛋白酶,连续盲传3代,显微镜下观察每代细胞培养状况,发现PEDV 接种细胞后,第1、2、3代均不出现细胞病变。但在第4代传代培养后,发现出现病毒丢失现象,实时荧光定量RT-PCR检测结果为阴性。后来采取在第1代~3代添加大量胰蛋白酶,同时再添加了一定浓度的猪胰酶,成功实现了PEDV 在Vero细胞上的连续传代。但在4代~8代的每次传代后,细胞培养液中病毒的滴度开始下降,实时荧光定量RT-PCR 的Ct值增加。在传至第8代后出现了细胞病变(cell pathogenic effect,CPE),细胞培养上清液中PEDV 的实时荧光定量RT-PCR检测时Ct值逐步降低,表明自第8代出现CPE病变后,细胞培养液中的病毒滴度在不断增加。
为了分离纯化猪轮状病毒A,用2013年分离到的PEDV 毒株制备卵黄抗体,纯化抗体后中和2011年混合感染PEDV 和PRoVA 的MA-104细胞培养液,再于MA-104细胞系上进行传代。通过不断地中和传代,经多重实时荧光定量RT-PCR检测,在第5代MA-104细胞培养液中只检测到PRoVA,没有检测到PEDV,表明纯化得到PRoVA。
通过本项目的研究,分离获得了猪流行性腹泻病毒和猪轮状病毒A,并成功实现了细胞传代,为疫苗的研发奠定了基础。
[1]杨汉春.2013年猪病流行情况与2014年流行趋势及防控对策[J].猪业科学,2014(2):42-43.
[2]张海明,田 野,王艳丽,等,猪流行性腹泻病毒流行病学调查综述[J].猪业科学,2014(3):90-91.
[3]杨丽梅,马 力,徐倩倩,等,我国猪病毒性腹泻的诊断与流行病学调查研究概况[J].动物医学进展,2014,35(2):115-119.
[4]Kim S,Kim I,Pyo H,et al.Multiolex real-time RT-PCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J].Virol Meth,2007,146(1-2):172-177.
[5]Amimo J O,Vlasova A N,Saif L J.Prevalence and genetic heterogeneity of porcine group C rotaviruses in nursing and weaned piglets in Ohio,USA and identification of a potential new VP4genotype[J].Vet Microbiol,2013,164:27-38.
[6]焦 洋,姜 焱,王凯民,等.猪传染性胃肠炎病毒、猪流行性腹泻病毒和猪博卡病毒多重PCR检测方法的建立[J].动物医学进展,2013,34(8):71-75.
[7]魏海芳,王鸿忠.青海省部分地区PEDV、TGEV 和RV 感染情况调查与分析[J].动物医学进展,2013,34(9):133-136.
[8]张 志,李 岚,董雅琴,等.猪流行性腹泻病毒PCR检测及其M 基因的遗传变异分析[J].动物医学进展,2013,34(8):13-18.
[9]甘海霞,梁 晟,韦显凯,等.2011年广西猪群猪流行性腹泻和猪传染性胃肠炎调查[J].动物医学进展,2012,33(6):125-127.
[10]尹宝英,吴旭锦,熊忙利.猪流行性腹泻诊断方法研究进展[J].动物医学进展,2013,33(12):121-124.

