单增李斯特菌inlB基因缺失株的构建及其生物学特性
魏 丽,邓兴梅,蒋建军,剡根强,马 勋,王鹏雁
(石河子大学动物科技学院,新疆石河子832003)
单增李斯特菌(Listeria monocytogenes,LM)为革兰阳性短杆菌,引起人和动物的李氏杆菌病。它可穿越人和动物肠屏障、血胎屏障及血脑屏障,在临床上引起脑膜炎、脑膜脑炎、败血症及孕畜(妇)流产等疾病,感染后临床表现为脑膜脑炎、败血症和流产等症状[1],被世界卫生组织(WHO)列为四大食源性致病菌之一[2-3]。
LM 为兼性胞内寄生菌,可黏附、侵袭宿主细胞,并具有在胞内增殖的特性,InlB为其所特有的内化素,由inlA、B 基因 编码,inlB 基因全长为1 893 bp,其中编码InlB 的最大开放阅读框为750bp[4],包含630个氨基酸。其结构从N 端到C 端分别为信号肽序列、LRR 重复区、IR 重复区、B 重复区和GW 重复区[5]。GW 可介导InlB与细胞脂磷壁酸的相互作用,LRR 和B重复区也参与InlB与靶细胞的相互作用[6],如肝细胞生长因子受体(Met)在LRR的凹陷部与InlB结合等。LM 建立感染的前提是通过InlA、InlB 和p60 蛋白等的黏附作用进入宿主细胞[7],即其导致感染性疾病症状的严重程度部分上依赖于内化素蛋白入侵上皮细胞的能力[8]。内皮细胞是构成血脑屏障的主要结构,病原体侵入毛细血管内皮细胞可能是其穿越血脑屏障的一种重要方式,如大肠埃希菌(引起细菌性脑炎型)通过血脑屏障侵入中枢神经系统。LM90菌株是新疆致绵羊脑炎分离株,感染导致的中枢神经系统症状较为明显,本研究通过同源重组构建inlB 基因缺失株(LM90-△inlB),对缺失株的生物学特性进行研究,为探讨LM 的毒力因子InlB在致病力和穿越血脑屏障过程中的具体作用及机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒 新疆致绵羊脑炎分离株单增李斯特菌LM90,由石河子大学动物科技学院预防兽医学实验室分离、鉴定并保存,血清型为4b 型;pKSV7穿梭质粒,浙江大学动物科学学院分子微生物与食品安全实验室馈赠;pMD19-T,宝生物工程(大连)有限公司产品。
1.1.2 主要试剂Taqplus DNA 聚合酶、dNTP Mix,上海东盛公司产品;pfuTaq酶,康为公司产品;DNA 回收试剂盒,诺维森公司产品;质粒提取试剂盒,天根公司产品;限制性内切酶(EcoR Ⅰ、HindⅢ),宝生物工程(大连)有限公司产品;青霉素G、氨卡青霉素和氯霉素、溶菌酶,Promega 公司产品;BHI培养基,BD 公司产品;鼠脑微血管内皮细胞(MBMEC),广州吉妮欧生物科技有限公司产品;高糖DMEM,Hyclone公司产品;FBS,Gibco 公司产品。
1.1.3 实验动物 8 周龄健康昆明系小鼠由石河子大学实验动物中心提供。
1.1.4 引物 表1为本试验中用到引物,由北京华大基因公司合成。其中,90-inlB-a、90-inlB-b用于扩增上游同源臂;90-inlB-c、90-inlB-d用于扩增下游同源臂;90-inlB-JC-a、90-inlB-JC-b 用于缺失株的鉴定;hly-1、hly-2用于4b血清型LM 特异性鉴定。
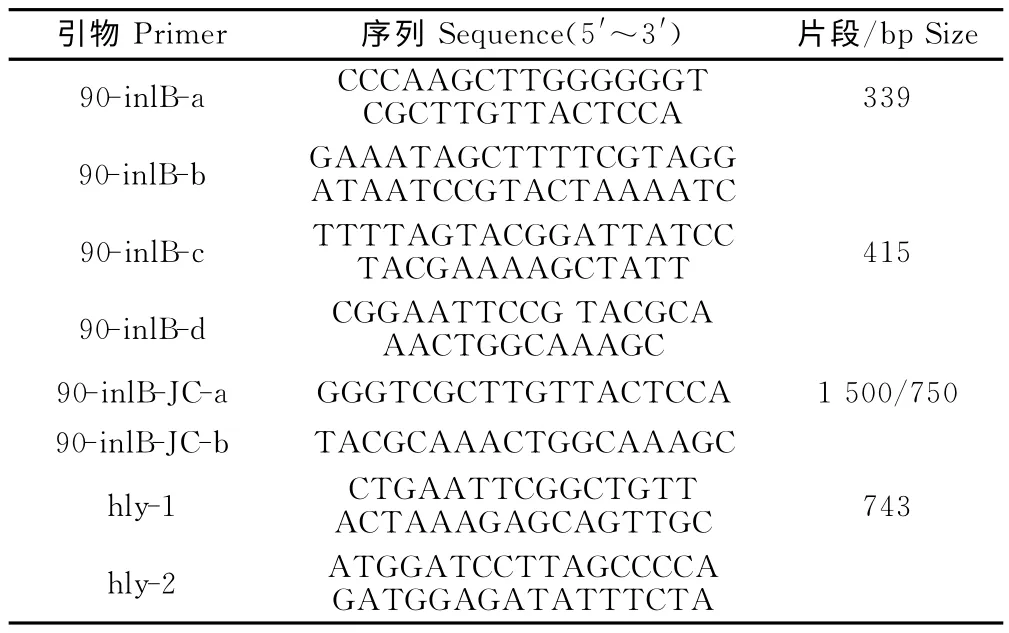
表1 PCR 引物及扩增片段大小Table 1 PCR primers and sizes of products
1.2 方法
1.2.1 inlB基因缺失株LM90-△inlB的构建
1.2.1.1 inlB 基因缺失片段的获得和穿梭重组质粒的构建 煮沸法提取LM90的基因组DNA,以其为模板,用高保真pfu酶及引物90-inlB-a和90-inlB-b扩增得到inlB上游同源臂,用引物90-inlB-c和90-inlB-d扩增得到inlB 下游同源臂。再以上下臂为模板进行第一步融合后,用引物90-inlB-a 和90-inlB-d通过基因重叠延伸PCR 的方法获得inlB 目的基因缺失盒△inlB。
胶回收△inlB 后连接到pMD19-T,命名为T-△inlB,然后转化入大肠埃希菌DH 5α 中。菌液PCR 筛选阳性克隆,并提取T-△inlB 质粒进行酶切。鉴定后,送华大基因测序验证。将验证正确的T-△inlB重组质粒,用EcoR Ⅰ和Hind Ⅲ双酶切后,回收△inlB 目的片段,同时用EcoR Ⅰ和HindⅢ双酶切穿梭质粒pKSV7,最后用T4 连接酶将△inlB片段和酶切后的pKSV7载体片段连接,即将△inlB 亚克隆于pKSV7,获得重组的穿梭质粒pKSV7-△inlB。
1.2.1.2 感受态细胞的制备 参照文献[10]单增李斯特菌感受态细胞制备方法进行。
1.2.1.3 电转化和同源重组 将构建好的穿梭质粒pKSV7-△inlB通过电转的方法(2.5kV,5 ms)转入LM90感受态细胞中,30 ℃培养48h后,筛选并获得阳性克隆。将阳性克隆在41 ℃和10μg/mL氯霉素的双重压力下进行传代培养,约18代后,将末代细菌培养物划线接种到氯霉素抗性平板上,41℃过夜培养,挑取单个菌落。用90-inlB-JC-a和90-inlB-JC-b引物进行PCR 扩增,筛选出不含inlB 基因的氯霉素抗性的缺失株。再将其置于30 ℃无氯霉素抗性BHI培养基传28 代左右后铺板(无抗BHI),30℃过夜,进行抗氯霉素和不抗氯霉素筛选。获得无氯霉素抗性的缺失株,即确认为LM90-△inlB缺失株。
1.2.1.4 缺失株LM90-△inlB 的鉴定及遗传稳定性测定 用检测引物90-inlB-JC-a和90-inlB-JC-b进行PCR 扩增鉴定,亲本株预期片段为1 500bp,缺失株预期扩增片段为750bp;同时将该菌接种于氯霉素抗性和非抗性BHI中,进行确定是否不含氯霉素抗性。将上述得到的重组缺失菌株在无氯霉素37℃条件下传代培养20代,同时用菌液PCR 进行鉴定,以检测重组株LM90-△inlB 是否发生重组不完全,并确定重组菌具有遗传稳定性。
1.2.2 LM90 和LM90-△inlB 的LD50测定将LM90和LM90-△inlB均于37℃,180r/min摇床培养至OD 595≈0.40时,分别离心收集细菌,用PBS清洗2遍后再将细菌悬浮液进行梯度稀释。将试验小鼠随机分为5 组,每组5只,进行腹腔注射,接种量0.2 mL/只;对照组腹腔注射灭菌PBS,0.2 mL/只。连续观察10d,用寇氏法计算LD50。
1.2.3 LM90 和LM90-△inlB 小鼠肝、脾、脑细菌计数 将试验小鼠分成两组,每组8只。将LM90和LM90-△inlB,37 ℃,180r/min 摇床培养16h至OD595≈0.3,腹腔注射,接种量为0.2 mL/只。注射菌液后分别在24、48、72h时各取2只,在无菌条件下摘取肝、脾、脑,研磨均匀后,梯度稀释,然后涂布至BHI固体培养基上37 ℃培养24h,进行细菌计数。同时将组织直接接种于BHI液体进行培养,用于PCR检测。
1.2.4 亲本株LM90和缺失株LM90-△inlB 耐酸耐碱生长曲线测定 分别挑取LM90 和LM90-△inlB单个菌落于BHI过夜培养(约16h)至稳定期OD595≈0.4,取100μL 至5mL BHI(不同pH)培养基做50 倍稀释。每孔加入200μL 菌液至96孔板,设3 个平行。置酶标仪中,OD595 连续读数12h。
1.2.5 溶血试验 LM90亲本株与缺失株分别在兔全血或绵羊全血BHI琼脂平板上划线培养观察其溶血特性。
1.2.6 MBMEC黏附、侵袭和增殖试验
1.2.6.1 对MBMEC 黏附测定 于12 孔板中传代培养鼠脑微血管内皮细胞(MBMEC),37 ℃、体积分数为5%的CO2,至单层细胞为80%(细胞的密度为5×105/mL)左右,将过夜培养的LM90和LM90-△inlB稀释为约107,每孔0.5mL。置于细胞培养箱中培养1h后,用PBS洗2遍,加入1 mL/L 的TritonX-100裂解15min。裂解后10倍系列稀释,BHI固体培养基上,37 ℃条件下培养24h,进行细菌平板计数。
1.2.6.2 对MBMEC 侵袭测定 用以上相同方法感染细胞1h,PBS洗2遍,更换为100μg/mL 庆大霉素的DMEM 培养液以杀死胞外细菌。1h 后经PBS清洗2遍,按上述方法裂解细胞,BHI平板法培养计数。
1.2.6.3 在MBMEC 中增殖测定 按1.2.6.2方法,再向各孔中加入1mL含10μg/mL庆大霉素的DMEM 培养液,放于细胞培养箱中培养。以加入含100μg/mL庆大霉素的DMEM 培养液为时间起点(t=0),分别在t=2、4、6、8、12、24h,共6个时间点吸出培养液,用PBS洗2遍,裂解,计数。每次每组不少于3个平行,该试验要重复3次,最后取平均值。
2 结果
2.1 inlB基因缺失片段的融合
PCR扩增后用10g/L琼脂糖凝胶电泳,分别获得长度为339bp和415bp的特异性上、下臂片段,与预期结果一致(图1)。重叠延伸PCR,电泳得到长为754bp的片段,与预期结果一致(图2)。测序和双酶切结果表明,成功缺失了inlB基因(图3)。
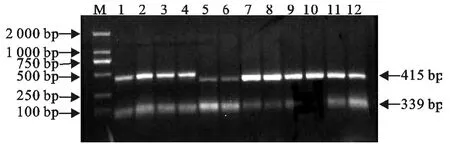
图1 上下游同源臂扩增结果Fig.1 The upstream and downstream homologous arms amplified by PCR
2.2 重组穿梭质粒pKSV-△inlB鉴定
PCR 及双酶切鉴定结果表明,重组穿梭质粒pKSV-△inlB构建成功(图4)。
2.3 缺失株LM90-△inlB的鉴定
电转后得到的阳性转化子同时可扩增出约750 bp和1 500bp的片段;41 ℃和氯霉素抗性传代后筛选出只有1条750bp的片段,且有氯霉素抗性,再30 ℃传代28 代后,可获得无氯霉素抗性和不含inlB基因(即只有1条750bp片段)的细菌,表明已经成功构建了LM-△inlB缺失株(图5)。
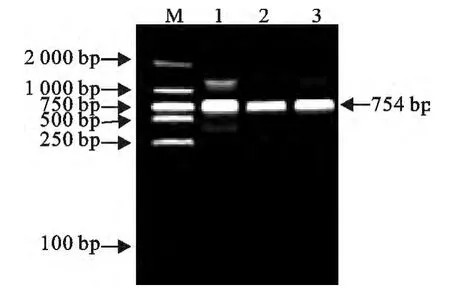
图2 重叠延伸PCR 扩增结果Fig.2 Overlap extention PCR amplification products of homologous arms
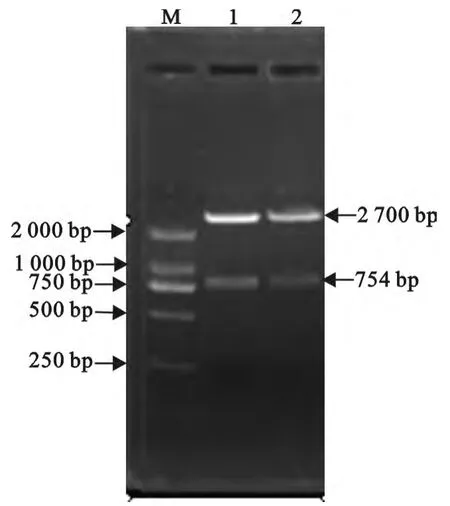
图3 pMD19-T-△inlB双酶切鉴定Fig.3 Identification of pMD19-T-△inlB by double enzyme digestion
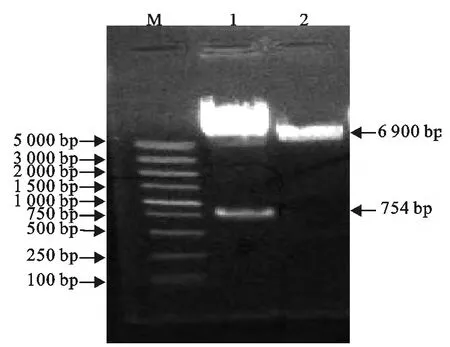
图4 pKSV7质粒双酶切鉴定Fig.4 Identification of pKSV7-△inlB by double enzyme digestion
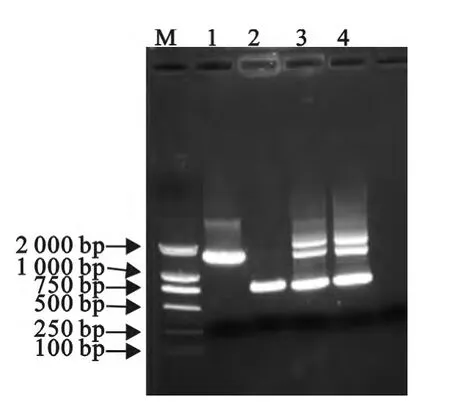
图5 重组菌PCR鉴定Fig.5 Identification of recombinant bacteria by PCR
2.4 LM90和LM90-△inlB LD50的测定
LM90的LD50约为105.96CFU ;LM90-△inlB的LD50约为107.3CFU(表2)。结果表明,inlB基因的缺失使得LM的毒力明显下降(P<0.05),提示InlB因子对LM 毒力具有重要的调控作用。
2.5 小鼠肝脏、脾脏和脑的细菌计数
2组小鼠分别接种LM90、LM90-△inlB 后观察,发现小鼠有明显的精神萎靡,双眼微闭,结膜潮红和分泌物,活动迟缓等现象。病理剖检发现,接种LM90 的小鼠的肝脏和脾脏明显肿大,而接种LM90-△inlB的小鼠的肝脏和脾脏有肿大但不如接种亲本株的明显。通过对两组小鼠肝脏、脾脏和脑的细菌平板计数结果分析,接种LM90的小鼠在攻毒后24、48、72h 时肝脏载菌量高于接种LM90-△inlB组,但差异不显著(P>0.05)。脾脏载菌量两组间在各个时间点差异不明显,且攻毒后24h的脾脏载菌量高于48h和72h 的载菌量。脑中没有检出细菌。同时PCR检测,可以从肝脏和脾脏中扩增出大小为743bp的特异性片段,在脑中没有扩增出相应片段(图6~图8)。
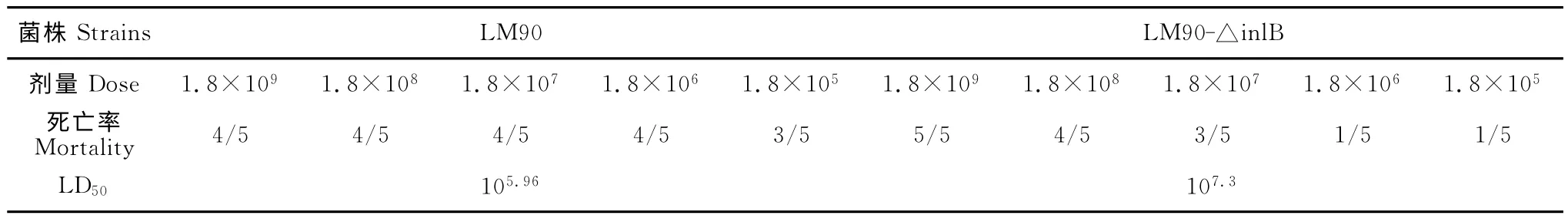
表2 LM90 和L90-△inlB 对小鼠LD50的测定结果Table 2 LD50of LM90and LM90-△inlB in mice
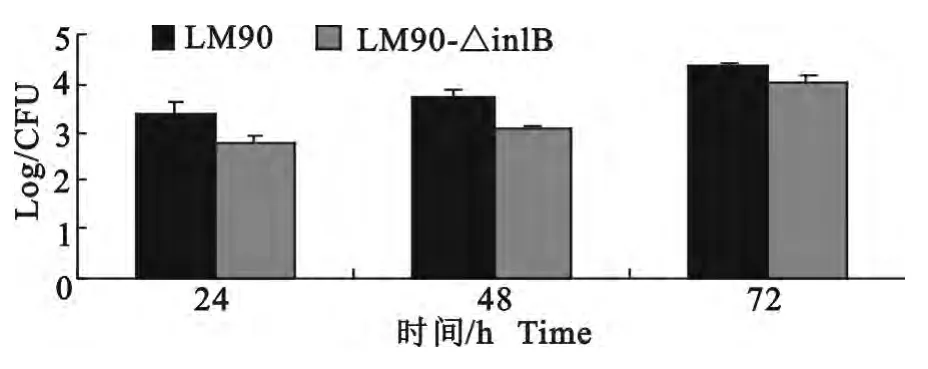
图6 肝脏细菌计数Fig.6 The bacterial count of liver
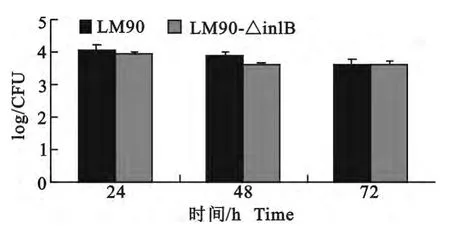
图7 脾脏细菌计数Fig.7 The bacterial count of speen
2.6 LM90和LM90-△inlB体外耐酸耐碱试验
pH=3时不生长,pH=5时两株菌生长状态基本相同,在pH=7时6h后差异显著(P<0.05),pH=9时4h后差异显著(P<0.05),即inlB缺失株耐酸性没有改变,而耐碱能力强于亲本株(图9)。
2.7 溶血试验
亲本株与缺失株无论在兔全血或绵羊全血BHI琼脂平板上均呈β溶血,说明对细菌的溶血特性没有影响。
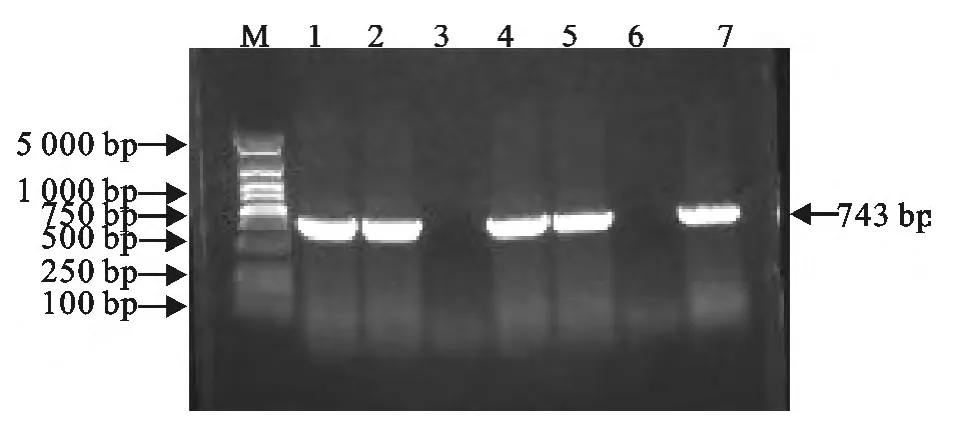
图8 小鼠感染后组织脏器细菌扩增产物Fig.8 LM products amplified by PCR in tissues of infected mice
2.8 对鼠脑微血管内皮细胞的黏附、侵袭及在其内增殖的测定结果
LM90和LM90-△inlB对鼠脑微血管内皮细胞的黏附率有差异,但差异不显著(图10);而对MB-MEC的侵袭率则LM90(0.014 8%)显著高于LM90-△inlB(0.009 183%)(P<0.05)(图11);细菌胞内增殖试验中,则在每个时间段LM90-△inlB菌量显著低于LM90(P<0.01),其CFU 相差一个数量级,但在胞内增殖趋势大致相同(图12)。
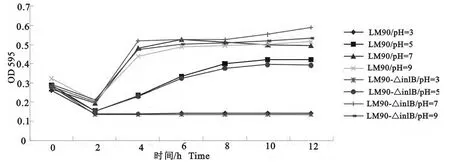
图9 LM90和LM90-△inlB在不同pH 的BHI培养基中生长特性Fig.9 Growth characteristics of LM90and LM90-△inlB on BHI culture medium with different pH
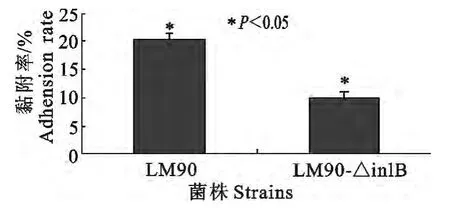
图10 LM90和LM90-△inlB对MBMEC黏附率Fig.10 Adhension of LM90and LM90-△inlB with MBMEC
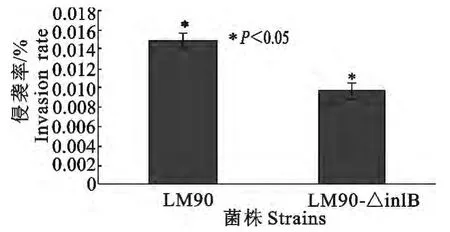
图11 LM90和LM90-△inlB对MBMEC侵袭率Fig.11 Invasion rates of LM90and LM90-△inlB to MBMEC
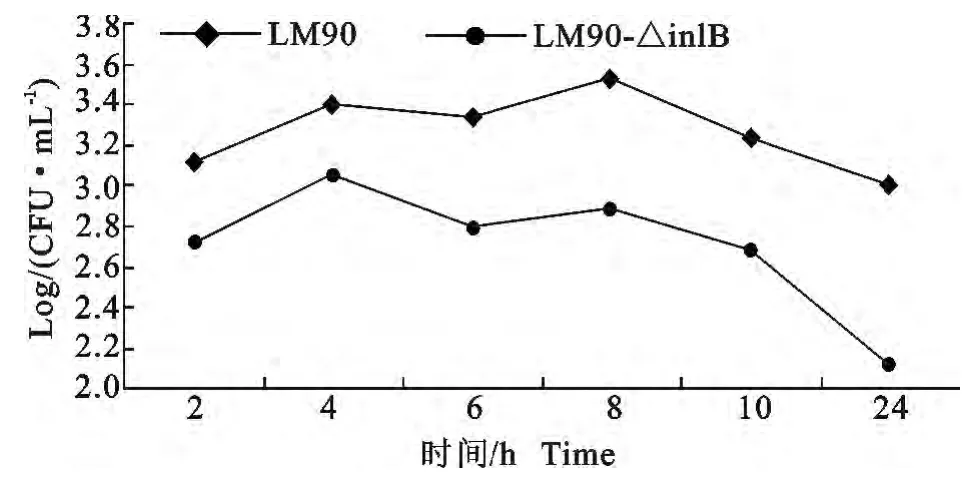
图12 LM90和LM90-△inlB在MBMEC内不同时间段增殖Fig.12 The intracellular growth of LM90and LM90-△inlB in MBMEC at different time
3 讨论
本试验应用重叠延伸PCR(SOE-PCR)技术和同源重组原理,通过电转化法,成功构建LM90菌株inlB基因缺失株,试验过程中,为确保电转电压(溶剂离子浓度为最小),质粒洗脱和HEPES液的配置需用无菌去离子水(R=1.8Ω),且HEPES液pH=7;加入溶菌酶作用20min,洗脱后细菌明显减少,需浓缩后分装,以保证感受态细胞的浓度;电转化时,LM 感受态细胞最好是现配现用,超过5 个月则不可用。电转阳性突变株在41℃和氯霉素双重压力下传代过程中,极易出现重组不完全,所以需用检测引物多次检测,确保为基因已缺失的单菌落才可进行质粒丢失,避免回复重组,一般传18代左右,会出现只有一条短带,而无长带。由于重组质粒丢失不完全可能会出现缺失株的毒力反强,所以在30℃传代中,需多次传代并反复铺板,挑菌,筛选,才可确定无氯霉素抗性。
对LM90-△inlB 进行生物学特性研究时,其LD50比LM90高出1个数量级以上,即缺失inlB 后LM 毒力明显下降,与文献报道inl基因缺失可使LM 对小鼠的LD50明显增加相符[10],从而进一步证实了inlB在LM 致病力中有重要作用。单纯研究一株菌缺失株(或亲本株)的耐酸耐碱性,说明临床绵羊脑炎分离株LM90耐碱不耐酸,则佐证LM90与标准株具有相同的特性[11]。在肝脾载菌试验中,肝脏LM90载菌量高于LM90-△inlB,而脾脏两株菌载菌量在各时间点相近,推测可能由于inlB在肝、脾脏有不同受体Met和C1q 所致[12]。LM90-△inlB对MBMEC 侵袭率与胞内增殖都显著低于野生株,表明InlB 在LM 侵袭MBMEC 中发挥重要作用。本试验结果与Bergmann等缺失inlB将完全不能侵袭HBMEC的结论存在差异,推测可能是由于LM内化素与宿主细胞相互作用的受体不同所致[13-14]。
本研究成功构建了新疆致绵羊脑炎分离株LM90的inlB 基因缺失株LM90-△inlB,并对缺失株的LD50、细菌在小鼠体内增殖、体外生长、溶血性及对鼠脑微血管内皮细胞的侵袭、黏附及在MB-MEC中的增殖试验等生物学特性进行了研究,在一定程度上证明了inlB 对LM 毒力有一定的调节作用,为阐明LM 毒力因子的致病机理提供了科学依据。
[1]陆承平.兽医微生物学[M].3版.北京:中国农业出版社,2001:303-3051.
[2]Allerberger F,Wagner M.Listeriosis:a resurgent foodborne infection[J].Clin Microbiol Infect,2010,16(1):16-23.
[3]Cabanes D,Dehoux P,Dussurget O,et al.Surface proteins and the pathogenic potential ofListeria monocytogenes[J].Trends Microbiol,2002,10(5):238-245.
[4]Gaillard J L,Berche P,Frehel C,et al.Entry ofL.monocytogenesinto cells is mediated by internalin,a repeat protein reminiscent of surface antigens from Gram-positive cocci[J].Cell,1991,65(7):1127-1141.
[5]Pizarro Cerda J,Kuhbacher A,Cossart P.Entry ofListeria monocytogenesin mammalian epithelial cells:an updated view[J].Cold Spring Harbor Perspect Med,2012,2(11).pii:a010009.doi:10.1101/cshperspect.a010009.
[6]Linden S K,Bierne H,Sabet C,et al.Listeria monocytogenesinternalins bind to the human intestinal mucin MUC2[J].Arch Microbiol,2008,190(1):101-104.
[7]Vazquez Boland J A,Dominguez Bernal G,Gonzalez Zorn B,et al.Pathogenicity islands and virulence evolution inListeria[J].Microbes Infect,2001,3(7):571-584.
[8]Cossart P,Pizarro Cerda J,Lecuit M.Invasion of mammalian cells byListeria monocytogenes:functional mimicry to subvert cellular functions[J].Trends Cell Biol,2003,13(1):23-31.
[9]蒋建军.缺失inlC2突变株增强单核细胞增多症李斯特菌对上皮细胞的内化作用的研究[D].新疆石河子:石河子大学,2011.
[10]殷月兰,朱国强,耿士忠,等.产单核细胞李斯特菌actA/plcB缺失株的构建及其生物学特性[J].微生物学报,2008,48(3):299-303.
[11]刘瑞田.李氏杆菌对理化因素的抵抗力与其致病性的关系[J].肉品卫生,1994(9):12.
[12]冯莹颖,张 强,黄兰红,等.InlA 和InlB 介导单核细胞增生李斯特菌入侵宿主细胞分子机制的研究进展[J].微生物学通报,2009,36(12):1894-1900.
[13]崔焕忠,乔立桥,王义冲.单核细胞增生性李斯特菌的主要毒力因子及其致病机理[J].中国畜牧兽医,2010(1):128-133.
[14]Cabanes D,Dehoux P,Dussurget O,et al.Surface proteins and the pathogenic potential ofListeria monocytogenes[J].Trends Microbiol,2002,10:238-245.

