流感病毒感染雪貂的标准化操作程序建立
张 涛,徐 娟,杨凤梅,秦晓峰,程根宏,和占龙*
(1.中国医学科学院/北京协和医学院基础医学研究所系统医学中心,北京100005;2.中国医学科学院/北京协和医学院医学生物学研究所,云南昆明650118)
流行性感冒(简称流感)是由流感病毒(Influenza virus,IFV)引起的一种急性呼吸道传染病,严重危害人类健康和生命[1-4]。动物实验在流感病毒研究中是非常重要的一个环节,选择合适的动物模型及正确规范的操作对于病毒实验研究结果的科学性和准确性尤为关键[5-7]。
雪貂(ferret)是目前最为敏感的IFV 感染动物模型,很容易感染人流感病毒,形成与人类相似的流感症状,经过鼻内接种感染后会出现体温升高,并出现如打喷嚏、流涕、活动度降低等呼吸道症状。能够检测相关临床参数,如温度,脉搏,呼吸频率,获得相对大量的血清用于血清学和抗原特性研究。目前已广泛用于流感病毒机制、传播和疫苗评价等多方面研究[8-10]。国内目前有建立雪貂流感病毒模型的研究,但对于雪貂的具体实验操作尚无报道[11-12]。我们通过实验过程中获得的经验并结合相关文献报道对雪貂在流感研究中的常规操作进行探索性研究,探讨建立标准饲养操作程序,为研究提供规范的操作方法,保证获得客观准确的试验结果。
1 材料
1.1 动物
雪貂,来源于有动物饲养繁殖许可证单位,年龄6月龄~8月龄,体重在800g~1 200g。性别选择无固定要求,尽量选择同性别雪貂。注意:①需有供应商提供流感病毒抗体阴性(如H1N1,H3N2和B型流感病毒等)检测报告,或者试验单位对提供动物进行相应检测达到实验要求;②购买的雪貂需进行7d~15d隔离观察,进行体温的测量和相关流感病毒抗体的检测,满足试验标准方可开展实验研究。
1.2 仪器和设备
昆明动物生物安全二级实验室,由中国医学科学院医学生物学研究所提供;生物安全柜,USA Thermo公司产品;独立通风负压(温度20 ℃,湿度50%~60%,压差10Pa~15Pa)生物隔离笼具,苏州冯氏实验动物设备有限公司产品;电子天平,Germany Sartorius公司产品;电子体温计,Japan Omron公司产品。
研究中人员防护严格按照国家农业部和卫生部颁布的病原微生物实验操作规范执行。
2 实验程序
2.1 雪貂的抓取和固定
操作者一只手抓住雪貂的颈背部,将其四肢悬空进行固定(图1),另一只手托住雪貂的臀部和四肢(图2),大多数雪貂在这种保定姿势下会比较放松和配合,另一名操作者可轻抚雪貂腹部和背部,降低雪貂的紧张情绪。雪貂具有锋利的牙齿,如果没有正确的抓取和有效的防护,能够对操作者带来一定危险,用厚皮革、纺纶或金属网手套操作进行保护和防止受到动物的攻击。
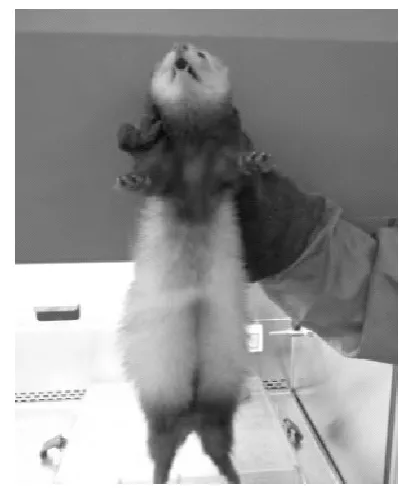
图1 雪貂的固定和抓取Fig.1 Holding and grabing of ferret

图2 雪貂的抓取和麻醉Fig.2 The grabing and anesthesia of ferret
2.2 雪貂的麻醉
麻醉剂的配方和用量如表1所示[13],使用配制的麻醉剂为舒泰50和速眠新Ⅱ,将舒泰50和速眠新Ⅱ按照1∶5 的体积比进行混合,每只雪貂使用0.05mL/kg~0.08mL/kg体重的麻醉剂量。操作者按照上述方式抓取雪貂将其仰卧,麻醉人员用700mL/L酒精在雪貂大腿内侧(麻醉注射区域见图2)消毒,将麻醉剂注入到大腿肌肉组织中。每只雪貂注射0.08 mL 麻醉剂,观察雪貂眼睛活动、四肢的松弛来确定是否完全麻醉。为了避免交叉感染,每次需操作和麻醉1只雪貂。注意:①雪貂取血或处死时需进行深度麻醉,采取注射麻醉方法,保证对雪貂的操作具有足够的时间,同时需严格控制麻醉剂量,尽量减少过度麻醉对雪貂和试验验带来的影响;②麻醉剂需要专人负责管理,提前配制好足够使用的麻醉剂,麻醉操作至少需要2 人~3 人配合进行。经验:①由于个体差异,同体重雪貂在该剂量下也出现耐受情况,如雪貂仍未麻醉,适当增加麻醉剂,等待2min~3 min即可;②研究统计显示雪貂在该剂量下维持麻醉时间约为45min~90min,该剂量能保证对雪貂有效的麻醉,同时不会产生过度麻醉导致雪貂长时间不能苏醒。
2.3 雪貂的采血和血清分离
对雪貂使用前腔静脉采血,一次采血不能超过10%的动物血液量[13]。在研究中我们采用易操作、成功率较高的心脏采血(图3)。将雪貂按上述方式抓取和麻醉,仰卧平放在生物安全柜内的操作盘中,使用电推剪将雪貂从脖子下沿胸骨剃剪干净,用手探明心脏搏动最强部位,通常在胸骨左缘的正中,位于倒数第二、三肋骨中间。采血部位用700 mL/L酒精擦拭消毒,使用1 mL 一次性注射器垂直缓慢刺入心脏,缓慢拔针并回抽,直到血开始填充注射器,收集所需血量后,拔出针头,使用消毒脱脂棉轻压注射部位止血。小心将血液转移到血清分离管,室温静止30min以上,10 000r/min离心5min,分离血清转至另一干净离心管中,-20 ℃保存。经验:①实际操作显示雪貂前腔静脉血管较细,颈部皮肤较疏松,针头容易滑落,没有经过大量练习操作前腔静脉采血不易成功,由于雪貂较贵,一般实验室难以大量练习;②研究显示雪貂每周一次心脏采血0.5 mL~0.6mL,连续采血不超过2月,对雪貂健康状况和体征指标无明显影响。

表1 麻醉剂配方和用量Table 1 The formulation and dosage of anesthetics
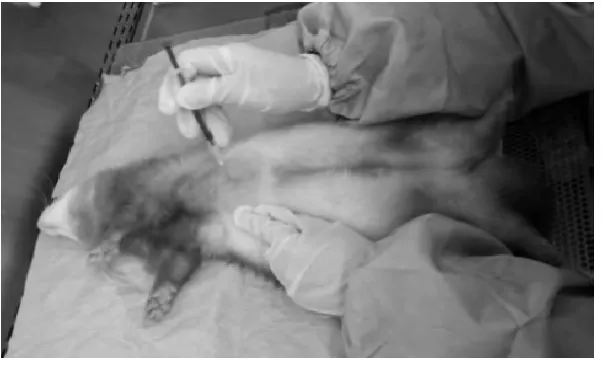
图3 雪貂的心脏采血Fig.3 Heart blood collection in ferret
2.4 雪貂的接种和鼻洗液收集
雪貂在清醒状态能够通过打喷嚏排斥接种,雪貂在轻度麻醉后鼻内接种,病毒能够完全被摄入[13]。在我们的研究中提前准备所需的足够病毒量(通常准备1个~2 个额外的剂量),将病毒液放在冰袋或碎冰上,使其保持低温状态。使用1 mL移液器吸取500μL病毒液,将雪貂按上述方式固定和麻醉,将一侧鼻孔向上,使用移液器缓慢逐滴滴入鼻腔接种250μL 病毒液,借助雪貂的呼吸,病毒可以快速的被完全被吸入,更换另一侧鼻孔接种250 μL病毒液(图4)。研究显示,雪貂单侧鼻腔接种500μL 病毒液,也能够完全吸入。雪貂鼻洗液收集过程中,使用1.5 mL 离心管,每管提前准备好0.5mL~1mL含5 000单位双抗/mL pH7.2的无菌PBS,将雪貂固定好,头下尾上,头部侧置,鼻孔下方放置无菌平皿(图5),将洗液缓慢从一个鼻孔注入,洗液会顺着鼻腔或从另一个鼻孔流出,平皿收集。收集的鼻洗液尽快放置于-80 ℃冰箱保存,待检测。由于雪貂对于鼻部刺激较为敏感,接种和鼻洗液收集时头部需要较好的固定。经验:一般最终收集的鼻洗液体积为洗液体积的70%~80%,需提前准备实验需要的相应体积洗脱液。

图4 雪貂的鼻内接种Fig.4 Intranasal inoculation in ferret
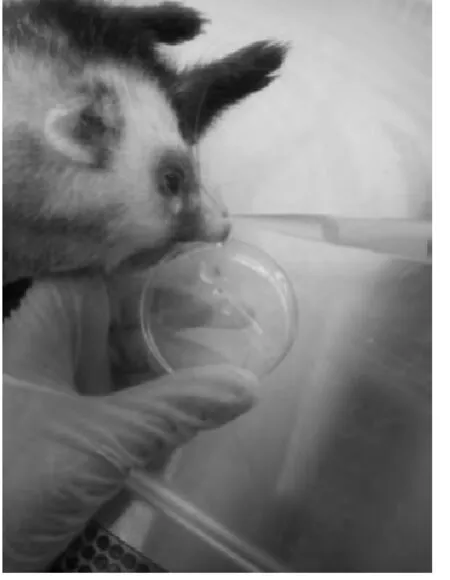
图5 雪貂鼻洗液收集Fig.5 Nasal wash collection in ferret
2.5 雪貂的体温体重测量和临床症状观察
雪貂体温体重的测量均在生物安全柜内进行,由于动物体温和体重在1d内存在一定的波动,需要在每天的同一时刻进行测量。体重的测量时将雪貂从笼具内取出放于电子秤上保持读数静止3s以上进行记录(精确度0.01kg)。我们对于不同组别体重记录结果显示季节性H1N1亚型流感病毒的感染对于雪貂体重的影响并不明显(P>0.05)。
雪貂体温测量时通过雪貂皮下植入芯片,利用芯片读数读取动物体温数值[13]。在我们的实验中,将甘油润滑后的电子体温计插入雪貂直肠,保持体温计读数5s~10s无变化进行记录(图6)。经验:①使用电子体温计检测操作简便快捷、数值稳定、记录准确,对雪貂无影响;②结果显示,雪貂接种流感病毒后1d~2d体温会升高,随后恢复正常。雪貂的正常温度范围是37.8 ℃~40 ℃,平均温度是38.8 ℃。
雪貂感染流感病毒后的临床症状评价标准在国际上使用较多的是表2,主要观察雪貂鼻部症状和活动能力[13-14],在试验中,通过在体重体温测量时近距离观察鼻部症状及在笼具内长时间观察活动度。经验:①根据我们的观察和多数文献报道显示,季节性流感病毒感染雪貂后,多数雪貂的临床症状并不明显[14],我们从鼻部症状观察多数雪貂感染后会出现鼻镜干燥,不断用舌头舔鼻现象,部分雪貂观察到流涕,较少的能够观察到打喷嚏。由于雪貂本身特性致其鼻部抽吸及活跃度指标使其不易观察和判断;②在研究中,我们认为雪貂鼻镜干燥和使用舌头舔鼻频率也能够作为流感病毒感染症状之一,纳入临床症状评价体系。

图6 雪貂的体温测量Fig.6 Temperature measurement in ferret
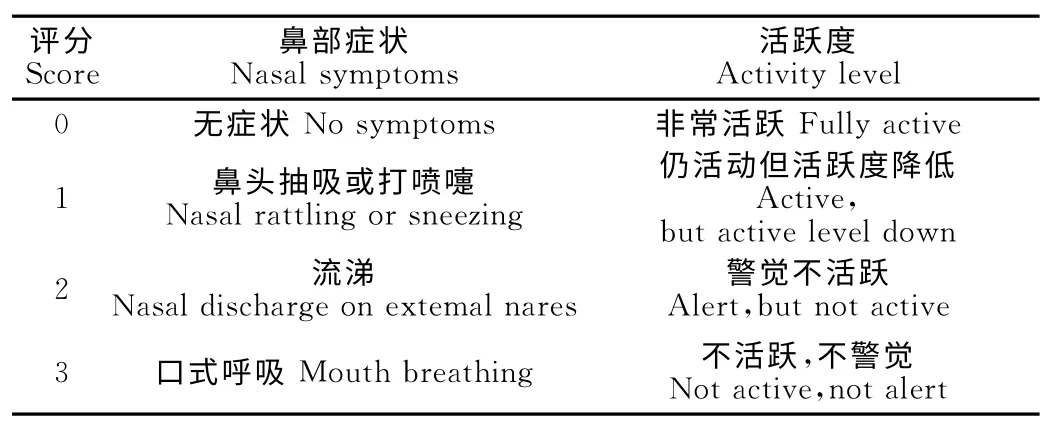
表2 雪貂感染后临床评分标准Table 2 Clinical sign scoring standrd in ferret
2.6 雪貂的处死和组织收集
雪貂在剖检、取样前必需执行安乐死。雪貂首先需被注射麻醉后,通过心脏穿刺注射安乐死EuthanasiaⅢ溶液(每毫升包含的活性成分为390mg戊巴比妥钠和50 mg苯妥英钠)[13]。在安乐死前,麻醉后的雪貂可以通过心脏穿刺收集大量血液。我们在研究中使用0.4mL 剂量麻药注射雪貂大腿肌肉,雪貂1min~2min内迅速深度麻醉,使用20mL或50 mL 注射器,心脏穿刺大量采血50 mL~60mL(图2)。研究显示,雪貂注射相应剂量麻醉剂后,1min~2min内雪貂能够迅速死亡,不需再注射安乐死溶液。正确收集雪貂的组织样本对于分析非常重要,需使用单独的器械收集不同组织样品,不同动物/组织之间用酒精消毒(将要收集的组织所需要器具放在含700 mL/L 酒精烧杯中消毒,每个组织单独放入一个烧杯中)。用无菌纱布轻拭檫净血液和组织,将采集组织放入预先称重和标记清晰的收集管内并尽快冻存。对于雪貂组织先收集理论上病毒含量低的组织,如脑、心、肝脾肾组织在肺和鼻甲骨之前进行,使高病毒含量器官造成的污染降低到最小。我们的研究主要检测肺部和鼻甲骨病毒含量,文献显示鼻甲骨病毒含量多高于肺部,因此先收集肺部组织[13]。700 mL/L 酒精将胸部区域消毒,用剪刀将肋部皮肤切除,干净剪刀剪开胸部,镊子夹起使其远离胸腔(图7,图8)。打开胸腔,用剪刀和干净镊子移除肺部和心脏将其放在干净的平皿上。使用手术剪切除部分左下或右下肺叶,放入预先称重和标记的收集管中,放入-80 ℃冻存待用。鼻甲骨收集按照文献[13]进行操作,使用解剖刀切除鼻子顶部软骨和软组织,将刮匙插入每一个鼻孔,挖出鼻甲放入标记好的15mL 试管中,尽快冻存于-80℃待用。其他组织的收集也需避免样本间的交叉污染及器具的消毒。如果组织需要固定进行病理学研究,采集的样本应小于1cm 厚,以便有足够的福尔马林渗透。组织放入固定液之前用PBS轻轻漂洗或用纱布轻拭除净多余的血,固定剂的量至少是采集组织体积(V/V)的15 倍~20倍,室温放置1 周后方可进行试验。注意:①我们在研究中操作的原则是尽量避免交叉污染,按病毒滴度从低到高进行收集。先收集阴性对照组雪貂,依次收集高滴度感染组雪貂;②用于病毒滴度和组织病理学试验样本需来自同一动物。

图7 雪貂的胸腔剖检Fig.7 The anatomy of thoracic cavity of ferret

图8 雪貂的胸腔打开Fig.8 Opening the thoracic cavity of ferret
3 讨论
作为流感病毒研究常用的动物模型,雪貂和小鼠相比体型较大,易于监测体温、脉搏和呼吸频率,感染病毒能够出现和人类似的流涕、咳嗽等临床症状,在观察和检测上具有较大的优势[15-19],已广泛用于流感病毒传播、致病机理、疫苗开发和药物评价的各个方面[20-22]。虽然国外对流感病毒的雪貂试验操作有详细的报道,但实际操作和观察中仍有许多需要注意的方面。国内相关的研究报道较少,且主要集中在模型制备上[11-12],没有涉及雪貂麻醉、采血和剖检及样品收集等详细操作。由于雪貂对病毒易感,且价格昂贵、体型较大,进一步加大了后续研究者的试验难度。本研究针对其他报道中没有涉及但对试验结果具有重要影响的环节,如在麻醉剂选择、剂量和麻醉后苏醒时间、不同途径采血方式的比较及对雪貂影响、感染后临床症状观察及如何剖检和收集样品方面进行详细介绍并结合实际经验提出可行的操作方案,对于其他研究者具有重要的指导和参考价值。此外,在流感病毒的雪貂试验中如何有效的避免感染是一个非常关键的问题。由于雪貂较大且易感,在不同动物之间,及对环境和操作人员容易造成感染,因此操作人员必须进行正确规范的操作,尽量减少污染和感染的危险,确保人员的安全和研究结果的客观准确。此外,操作者需要在工作中提高避免感染和污染的意识,对于试验细节需要在工作中综合考虑,如清理粪便、更换饮水饲料等饲喂工作以及体温、体重测量,采血和剖检等试验操作时均应首先处理空白对照组,其次为低剂量感染组,最后是高剂量感染组。尽量避免饮水,饲料以及器材等带来相互污染的可能。同时不同剂量组间和组内个体间也需要充分的消毒,包括笼具和仪器的消毒,也包括操作人员自身的消毒。总之,按照本研究报道的操作步骤,提前设计并充分考虑影响试验的关键环节和因素,能够有效降低在试验的误差和污染,在获得客观、准确的试验结果的同时有效提高研究的效率。
[1]Hu X,Liu D,Wang M,et al.Clade 2.3.2avian influenza virus(H5N1),Qinghai Lake region,China,2009-2010[J].Emerg Infect Dis,2011,17(3):560.
[2]Xiong C,Zhang Z,Jiang Q,et al.Evolutionary characteristics of A/Hangzhou/1/2013 and source of avian influenza virus H7N9subtype in China[J].Clin Infect Dis,2013,57(4):622-624.
[3]Killian M,Swenson S,Vincent A,et al.Simultaneous infection of pigs and people with triple-reassortant swine influenza virus H1N1at a US county fair[J].Zoon Public Health,2013,60(3):196-201.
[4]Gao R,Cao B,Hu Y,et al.Human infection with a novel avian-origin influenza A (H7N9)virus[J].New Engl J Med,2013,368(20):1888-1897.
[5]Zhu H,Wang D,Kelvin D,et al.Infectivity,transmission,and pathology of human-isolated H7N9influenza virus in fer-rets and pigs[J].Science,2013,341(6142):183-186.
[6]Belser J A,Gustin K M,Pearce M B,et al.Pathogenesis and transmission of avian influenza A(H7N9)virus in ferrets and mice[J].Nature,2013,501(7468):556-559.
[7]常 爽,郑晓一,杨松涛,等.虎源高致病性禽流感病毒H5N1在实验小鼠体内分布与含量测定[J].动物医学进展,2006,27(5):56-59.
[8]Banner D,Kelvin A A.The current state of H5N1vaccines and the use of the ferret model for influenza therapeutic and prophylactic development[J].J Infect Develop Count,2012,6(6):465-469.
[9]Munster V J,de Wit E,van den Brand J M,et al.Pathogenesis and transmission of swine-origin 2009A(H1N1)influenza virus in ferrets[J].Science,2009,325(5939):481-483.
[10]Bodewes R,Kreijtz J,Geelhoed Mieras M,et al.Vaccination against seasonal influenza A/H3N2virus reduces the induction of heterosubtypic immunity against influenza A/H5N1virus infection in ferrets[J].J Virol,2011,85(6):2695-2702.
[11]鲍琳琳,占玲俊,邓 巍,等.建立H5N1流感病毒感染雪貂动物模型[J].中国比较医学杂志,2011,21(9):40-44.
[12]鲍琳琳,占玲俊,邓 巍,等.雪貂感染流感病毒H3N2动物模型的建立[J].中国比较医学杂志,2011,21(8):5-9.
[13]Matsuoka Y,Lamirande E W,Subbarao K.The ferret model for influenza[J].Curr Protoc Microbiol,2009,15(12):1-29.
[14]Huang S S,Banner D,Fang Y,et al.Comparative analyses of pandemic H1N1and seasonal H1N1,H3N2,and influenza B infections depict distinct clinical pictures in ferrets[J].PLoS One,2011,6(11):e27512.
[15]Maher J A,DeStefano J.The ferret:an animal model to study influenza virus[J].Lab Animal,2004,33(9):50-53.
[16]Herfst S,Schrauwen E J,Linster M,et al.Airborne transmission of influenza A/H5N1virus between ferrets[J].Science,2012,336(6088):1534-1541.
[17]Belser J A,Katz J M,Tumpey T M.The ferret as a model organism to study influenza A virus infection[J].Dis Mod Mechan,2011,4(5):575-579.
[18]Gustin K M,Belser J A,Wadford D A,et al.Influenza virus aerosol exposure and analytical system for ferrets[J].Proceed Nat Acad Scien,2011,108(20):8432-8437.
[19]Lakdawala S S,Shih A R,Jayaraman A,et al.Receptor specificity does not affect replication or virulence of the 2009pandemic H1N1influenza virus in mice and ferrets[J].Virology,2013,446(1):349-356.
[20]Pearce M B,Belser J A,Houser K V,et al.Efficacy of seasonal live attenuated influenza vaccine against virus replication and transmission of a pandemic 2009 H1N1virus in ferrets[J].Vaccine,2011,29(16):2887-2894.
[21]Imai M,Watanabe T,Hatta M,et al.Experimental adaptation of an influenza H5HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1virus in ferrets[J].Nature,2012,486(7403):420-428.
[22]Hamouda T,Sutcliffe J A,Ciotti S,et al.Intranasal immunization of ferrets with commercial trivalent influenza vaccines formulated in a nanoemulsion-based adjuvant[J].Clin Vac Immunol,2011,18(7):1167-1175.

