线栓法与改良三氯化铁法致大鼠大脑中动脉闭塞模型的对比研究
包玉龙,朱竟赫,范英兰,刘 禾,宋达夫,李显华,赵 磊
(辽宁省中医药研究院,辽宁沈阳110034)
大脑中动脉是人类缺血性中风的多发部位、因其侧支循环不丰富,所以普遍认为大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型是局灶性脑缺血的标准动物模型[1]。脑栓塞动物模型成功与否关键在于脑栓塞部位与范围,病理生理过程尽可能模拟人的发病过程。为了适应对脑血栓溶栓治疗研究的需要,近年来国内外学者建立了线栓法[2]、三氯化铁法[3]、自体血栓法[4]等多种栓塞性大脑中动脉闭塞(MCAO)模型。每种方法均有各自的优缺点,例如自体血栓法形成的脑血栓模型,虽较接近临床[5],但由于形成的血栓弥散、不固定,所以动物的脑缺血程度和行为表现差异较大[6]。三氯化铁法形成的脑血栓模型制造方法简单、可靠、重复性好,且此模型还能反映溶栓药的药效,但其不足之处是动物的颧弓被去除,影响动物进食,若长期观察还需改进[7]。线栓法形成的脑血栓模型虽然拔线后可实现再灌注,但需要一定的手术技巧,同时对插线的直径、插入的深度要求较为严格,在操作中常出现动物脑出血或蛛网膜下腔出血等情况[8]。作者在实践操作中对三氯化铁所致大脑中动脉闭塞模型做了进一步的改良,现将该方法与线栓法造模进行对比研究,旨在探索一种更符合人类脑梗死生理病理过程的,便于操作且比较稳定的MCAO模型。
1 材料与方法
1.1 材料
1.1.1 受试动物 雄性SD 大鼠,体重250g~300g,由辽宁长生生物技术有限公司提供,许可证号:SCXY(辽)2010-0001。
1.1.2 试验环境 辽宁省中医药研究院实验动物中心。环境合格证:SYXK(辽)2007-0010。温度:20℃~23℃。湿度:50%~60%。饲料,由北京科澳协力饲料有限公司提供。合格证号:SCXY(京)2009-0012。
1.1.3 试剂 TTC(2,3,5-三苯基氯化四氮唑),国药集团化学试剂有限公司(批号:F20110613);甲醛,沈阳市新华试剂厂(批号:20110701);戊巴比妥钠,SERVA 进口分装,上海行知化工厂生产,(批号:921019);磷酸缓冲液,北京中杉金桥生物技术有限公司。
1.1.4 仪器 CD-200动物颅骨钻,成都泰盟科技有限公司;微量进样器,上海高鸽工贸有限公司,规格10 μL,产品标准号Q/SUUA01-2003 沪 制01130034号;BI-2000医学图像分析系统,成都泰盟科技有限公司;直径0.185mm 尼龙线由北京上州屋提供;有机硅胶由道康宁由机硅胶有限公司生产。
1.2 方法
1.2.1 改良的三氯化铁造模方法 取40只健康SD大鼠,腹腔注射戊巴比妥钠45mg/kg麻醉。参考文献方法[3,9]在左眼外眦到左外耳道连线的中点处切开皮肤约2cm,沿颧弓下缘依次切断咬肌和颞肌,分离切除下颌骨冠状突,暴露鳞状骨的大部分,用动物颅骨钻在颧骨和鳞状骨前联合前内2mm 处钻孔开颅,暴露一段大脑中动脉,使用微量进样器吸入500g/L三氯化铁溶液5μL,滴注在大脑中动脉表面,然后逐层缝合肌肉、皮肤。术中及术后麻醉清醒前用烤灯维持动物肛温37.0℃±0.5℃,动物苏醒后放回鼠笼。
1.2.2 线栓法造模方法 取40只健康SD 大鼠,腹腔注射戊巴比妥钠45 mg/kg麻醉后,参考文献方法[2,10-11]将大鼠仰卧固定,剪除颈部毛发并用碘酊及酒精消毒。取颈正中切口,钝性分离右侧胸锁乳突肌与胸骨舌肌之间的肌间隙,暴露颈总动脉(common carotid artery,CCA)和迷走神经,用眼科弯镊挑出颈总动脉(CCA)穿线备用、然后找到颈外动脉(external carotid artery,ECA)、颈内动脉(internal carotid artery,ICA),结扎ECA 及CCA 近端,在CCA 近分叉处剪一小口,将一头端涂有硅胶且线栓头端直径为0.3 mm 的尼龙线线栓经CCA 插入ICA 约18 mm~22 mm 达大脑中动脉(MCA)入口处,此时线栓正好封锁大脑中动脉开口,阻断了大脑中动脉的血流。用丝线固定栓子在CCA 内,缝合切口并保持大鼠体温。
1.2.3 假手术对照组 另取40只大鼠,作为假手术组,手术过程同改良三氯化铁模型组,但注入5μL生理盐水。
1.2.4 观察指标
1.2.4.1 行为指标 为观察动物行为障碍的程度,各组取10只大鼠在手术造模后不同时间(4、8、24、48 h)对动物行为进行评分,评分标准系参考文献[12]的方法并加以改良,计分标准如下:
行为1:提鼠尾观察前肢屈曲情况,如双前肢对称向地面计为0分,如手术对侧前肢出现腕屈曲计为1分,肘屈曲计为2分,肩内旋计为3分,既有腕屈曲和/或肘屈曲,又有肩内旋者,计为4分。
行为2:将动物置于平地面上,分别推双肩向对侧移动,检查阻力。如双侧阻力对等且有力,计为0分,如向手术对侧推动时阻力下降者,根据下降程度不同分为轻、中、重三度,分别计为1,2和3分。
行为3:将动物双前肢置于一金属网上,观察双前肢的肌张力。双前肢肌张力对等且有力者及为0分。同样根据手术对侧肌张力下降程度不同计为1,2和3分。
行为4:动物有不停地向一侧转圈者,计为1分。根据标准评分,满分为11分。分数越高表示动物行为障碍越严重。
1.2.4.2 对大鼠脑缺血面积的影响 各组取10只大鼠在手术造模后24h将大鼠断头处死,迅速取出全脑,去除嗅球、小脑和低位脑干,置于冰盐水中15min,平均冠状切4刀成5片2mm 厚脑片,迅速将脑片置于20g/L氯四氮唑(TTC)磷酸缓冲溶液中[13],37℃避光温孵染色30min,其间每隔7min~8min翻动一次[14-15],染色后正常脑组织呈红色,梗塞缺血组织呈白色,温孵完毕后用中性甲醛固定(固定时间在24h以内为宜),充分固定后用扫描仪扫描双侧脑片,输入计算机,利用医学图像分析系统计算脑片梗塞缺血面积,求出每鼠5片脑片总梗塞缺血面积占脑片总面积的百分比。
1.2.4.3 对大鼠脑指数、脑含水量的影响 各组取10只大鼠在手术造模后24h将大鼠断头迅速剥离出全脑称湿重,计算脑指数(脑指数=脑湿重×100/体重);再将大鼠全脑置于110℃烘箱烘干,24h后称干重,计算脑含水量(脑含水量=(脑湿重-脑干重)/脑湿重×100%)。
1.2.4.4 病理观察 各组取10只大鼠在手术造模后24h将大鼠断头处死,迅速剥离出全脑,将大脑置于40mL/L多聚甲醛溶液中固定后取脑常规石蜡包埋、切片、HE染色后观察组织形态学改变。
1.2.4.5 统计分析 应用SPSS统计软件对各项指标进行统计分析。神经功能缺损评分、组织含水量的比较用方差分析,梗死体积t检验。
2 结果
2.1 对大鼠脑血栓后行为状态的影响
手术麻醉的大鼠清醒后一般活动状态较差,皮毛凌乱无光泽,四肢蜷缩,喜卧,采食饮水量减少、体重下降、腹泻或稀便等;同时有偏瘫样症状出现,主要表现为不同程度的手术对侧前肢内收,肩内旋,肌张力降低,推右肩向对侧移动,抵抗阻力降低,甚至有些动物还出现不停地向一侧转圈现象。从表1可以看出,线栓模型组和改良模型组大鼠术后4、8、24h的行为评分维持在高峰阶段,48h后行为有所恢复。线栓模型组和改良模型组大鼠术后4、8、24、48h的行为评分均高于假手术组,差异极显著(P<0.01);改良模型组大鼠术后4、8、24、48h的行为评分均高于线栓模型组,差异显著(P<0.05)(表1)。
2.2 对大鼠脑指数、脑含水量、脑缺血面积的影响
线栓模型组和改良模型组大鼠的脑含水量、脑缺血面积均高于假手术组,差异极显著(P<0.01);改良模型组大鼠的脑含水量、脑缺血面积均高于线栓模型组,差异显著(P<0.05)(表2)。
2.3 病理检查
线栓模型组和改良三氯化铁模型组大鼠病灶侧脑表面苍白、无光,显微镜下可见线栓模型组和改良三氯化铁模型组的大鼠脑片有明显的神经元坏死,大多数胶质细胞死亡,梗死边界清楚,其周围组织明显水肿,并发出血者梗死范围大且可看到脑表面的出血灶,亦发现随手术后时间的延长,缺血软化灶范围和 深度有所增加,假手术组检查脑片均为正常。

表1 对大鼠脑血栓后行为的影响Table 1 Effect on behavior after cerebral thrombosis in rats
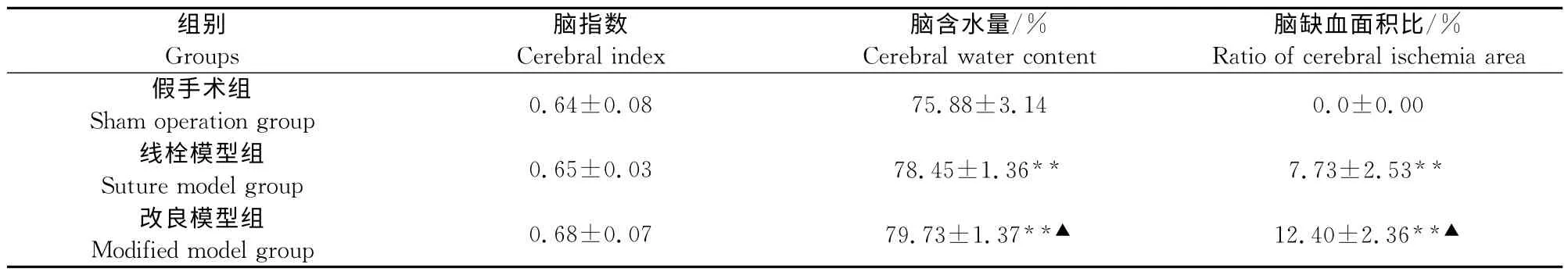
表2 手术对大鼠脑指数、脑含水量、脑缺血面积的影响Table 2 Effects of operation on cerebral index,cerebral water conent and cerebral ischemia area in rats
3 讨论
在本试验中,大鼠在血栓形成后4、8、24h时,行为改变维持在高峰阶段,48h后逐渐恢复;但病理检查发现随时间的延长,缺血软化灶范围和深度有所增加,出现了行为变化与病理改变不相平行的现象,这种现象以往也有学者[16]报道,认为可能是由于脑血供侧枝循环丰富,建立了代偿功能所致。
线栓法造模的优点是不需要开颅,属于相对非侵入的方法,缺点是需要一定的手术技巧,在操作中常出现动物死亡率高、脑出血或蛛网膜下腔出血、梗死等情况。也有学者报道老龄大鼠因血管脆性大等原因更不适合线栓法造模[17]。由于改良三氯化铁模型组使用微量进样器滴注三氯化铁,所以开颅钻孔比较小,损伤较少,同时因为不需要像原始造模那样使滤纸片停滞30min,使操作时间明显缩短;同时仍保留有大脑中动脉,可进行血管观察,较接近于临床,该模型还可以利用TTC 染色技术直观地观察脑梗塞程度;并且改良三氯化铁法制造模型的成功率、稳定的梗死范围、脑水肿程度重、梗死体积等方面都明显优于线栓组,使该模型推广成为可能。可以说改良三氯化铁模型为临床脑缺血性中风发病机制和防治研究提供了一种简便有效的手段。
[1]常丽英,张新江,张苏明.用于溶栓研究的血栓栓塞性脑梗死动物模型[J].国外医学:脑血管疾病分册,2001,9(4):229-231.
[2]Longa E Z,Weinstein P R,Carlson S,et a1.Revesible middle cerebral artery occlusion without eraniotorny in rates[J].Stoke,1989,20:84-91.
[3]Tamura A,Graham D I,Mcculloch J,et al.Focal cerebral ischemia in the rat[J].Cereb Blood flow Metab,1981,1(1):53-60.
[4]Zhang Z,Zhang R L,Jiang Q,et al.A new rat mdoel of thorm-Botic focal cerebral ischemia[J].J Cereb Blood Flow Metab,1997,17:123-135.
[5]孙文昊,陈会生.啮齿类动物脑缺血模型的回顾与研究进展[J].中国脑血栓管病杂志,2013,10(8):432-435.
[6]包玉龙,范英兰,朱竞赫,等.三氯化铁法致大鼠大脑中动脉闭塞模型的改良研究[J].中华中医药学刊,2013,31(12):2754-2756.
[7]包玉龙,杜佳林,张 宏,等.大鼠脑血栓动物模型研究进展[J].实验动物科学,2009,26(6):50-52.
[8]尧雪洲,解宇环,许 轫,等.实验动物脑血栓模型建模方法及评价[J].实验动物科学,2013,30(1):61-63.
[9]刘 瑜,董小黎.血栓动物模型的建立[J].首都医科大学学报,2002,23(3):277-280.
[10]谢 婷,赵 琰,屈会化,等.一种新的线栓法制备大鼠大脑中动脉缺血模型方法[J].实验动物与比较医学,2008,28(2):80-84.
[11]闫 换.大鼠线栓法大脑中动脉闭塞模型改进的实验研究[D].江苏苏州:苏州大学,2011.
[12]Bederson J B,Pitts L H,Tsuji M,et al.Rat middle cerebral artery occlusion:evaluation of the model and development of a neurologic examination[J].Stroke 1986,17:472.
[13]李红云,赵 丽,宿 希,等.胡黄连苷Ⅱ治疗脑缺血/再灌注损伤剂量和时间窗的初步探讨[J].中国药理学通报,2012,28(4):549-553.
[14]Lundy E F,Solic B S,Frank R S,et al.Morphometric evaluation of brain infarcts in rats and gerbils[J].Pharmacd Methods,1986,16:201.
[15]闫 换、董万利.木犀草素对大鼠脑缺血再灌注损伤的保护作用[J].神经疾病与精神卫生,2011,11(1):19-21.
[16]刘小光,徐理纳.一种能评价溶栓和抗栓药的大鼠大脑中动脉血栓模型[J].药学学报,1995,30(9):62-66.
[17]常丽英,张新江,张苏明.老龄大鼠线栓和自体血栓性大脑中动脉闭塞模型的比较研究[J].中国老年学杂志,2002,22(3):134-136.

