二甲基亚砜对猪精液冷冻保存效果研究
马 丽,李青旺,吴民耀*
(1.陕西师范大学生命科学学院,陕西西安710119;2.西北农林科技大学动物科技学院,陕西杨凌712100)
猪精液冷冻技术是指用干冰(-79℃)、液氮(-196℃)等作为冷源,将精液经过稀释、平衡等特殊处理后,保存在极低温度下,抑制其新陈代谢,一旦升温后精子能够复苏,又不失去受精能力[1]。在猪精液冷冻保存研究中发现,冷冻保护剂在精液冷冻保存过程中,对精子的冷冻效果至关重要[2]。自从人们发现甘油对精子具有冷冻保护作用后,家畜精液冷冻技术得到迅速发展[3]。卵黄与甘油是猪精液冷冻保存最常用的抗冻剂,卵黄是保护精子抵抗冷休克最有效的抗冻剂[4],一般甘油使用的最终浓度通常是30mL/L,由于较高浓度的甘油具有潜在的化学与渗透毒性作用[5],因此有必要寻找比甘油毒性更低的抗冻剂。
二甲基亚砜(DMSO)作为一种含硫的有机化合物,是一种非质子极性溶剂,并且毒性极低,被称为“万能溶媒”和“万能药”,它作为药物辅助治疗剂、细胞冷冻保护剂、生物膜融合剂和膜渗透剂,已被广泛应用于生物、化学和药学领域,这些应用大部分都与DMSO 具有增加生物膜通透性的能力密切相关[6]。有报道称不同类型的细胞使用DMSO 作冷冻保护剂所得到细胞存活率差异很大[7-11]。研究人员MilioriniA B等[12],Penaranda D S等[13],He S等[14]认为二甲基亚砜在鱼类精子冷冻保存中有好的效果。SiWei[15]等认为二甲基亚砜在稀有动物和地方品种中的精子冷冻保存中起到较好效果。但二甲基亚砜作为冷冻保护剂在猪精液冷冻方面却报道较少。本研究用二甲基亚砜(DMSO)替代甘油,与3 mL/L的甘油作对比,以冻后精子活率、畸形率、顶体完整率和质膜完整率作为评价指标,确定DMSO 最适添加量。同时,研究DMSO 与甘油不同配伍(4∶1、3∶2、3∶1、1∶1和2∶3)的混合冷冻保护剂,对猪精液冷冻保存的效果的影响,旨在筛选出最佳配伍,为生产实践提供参数。
1 材料与方法
1.1 材料
1.1.1 主要仪器与药品 电子分析天平(HANGPING,FA2004N);高速冷冻离心机(联想科技有限公司,Allegra 64R);双筒光学显微镜(XSZ-G);超净水机(联想科技有限公司,CluvFB273101);17℃恒温箱(XMT-A7000);程序冷冻仪(CL-8800);电热干燥箱(科伟101-3AB);0.25 mL 卡苏冻精管(STO);4℃冰箱(海尔,BCD-186YH);DMSO(西安试剂厂);甘油(成都化学试剂厂);姬姆萨染料(南京生兴生物技术有限公司)。
1.1.2 稀释液及溶液配制 配制常温保存BTS:准确称取葡萄糖3.7g,EDTA 0.125g,柠檬酸三钠0.6g,碳酸氢钠0.125g,氯化钾0.007 5g,青霉素钠0.06g,硫酸链霉素0.1g,加双蒸水至100mL,调pH 至7.25。
TCG 冷冻基础液:准确称取葡萄糖1.1g,柠檬酸1.48g,Tris 2.42g,青霉素钠0.06g,硫酸链霉素0.1g,加双蒸水至100mL,调pH 至6.21。
冷冻稀释液:在80 mL TCG 冷冻基础液中加入20mL新鲜卵黄,搅拌均匀,即为Ⅰ液。再按试验要求添加适当体积分数的甘油和DMA 配成Ⅱ液。
果糖-柠檬酸钠低渗液:果糖0.675 6g,柠檬酸三钠0.367 6g,加蒸馏水至50mL。
姬姆萨染剂:取姬姆萨染料(南京生兴生物技术有限公司)0.59g;甲醇(西安三浦精细化工厂)35 mL。先将染料置于甘油中60℃水浴2h,使其溶解,然后加入60 ℃预热的甲醛,混合后置棕色瓶内放置备用。
1.2 方法
1.2.1 采精 本试验所用精液采自武功县三佳种猪场,选择1.5岁~2 岁体格健壮、性欲旺盛的10头种公猪。用手握法采精,选择中段浓厚部分精液,经4层消毒纱布过滤除去胶状物,在37℃条件下用显微镜进行常规品质检测,选择无异味、色泽为乳白色、精子形态正常、活率在0.8以上且形态学完整率大于900mL/L 的精液用于试验,装在经过37℃预热的保温瓶中并在1h之内送回实验室。
1.2.2 精液冷冻与处理 将合格的精液运回实验室后,用10mL离心管等量分装,离心(37℃,1 600 r/min,5min),弃上清,加入等量预热的BTS,经12层~15层纱布包裹后,在17℃恒温箱中平衡3h,同时,将Ⅰ液在冷 冻离心 机 中 离 心(17℃,2 000 r/min,15min)。将平衡处理过的精液用10mL 离心管分装,在高速冷冻离心机内离心(17℃,2 400 r/min,3min),弃上清,加入等温离心过Ⅰ液(1∶1稀释),用12~15层纱布包裹后置于4℃冰箱中平衡2h,将离心后的精液,与等温Ⅰ液等量混合并轻轻摇匀,用毛巾包裹后放入4℃冰箱,静置2h。同时,将Ⅱ液和最终所用容器(10mL 离心管)也放入4℃冰箱,进行以下两个试验:①将加入Ⅰ液并在4℃冰箱中平衡2h后的精液均匀分为11份,分别加入等温的Ⅱ液(1∶1稀释,调整精子密度为1.0×109个/mL),并使甘油最终添加量为30 mL/L,作为对照组;DMSO 最终添加量分别为40、50、60、70、80mL/L,此外,将DMSO 和甘油配伍(4∶1,3∶1,3∶2,1∶1和2∶3)成最终浓度为3%的混合冷冻保护剂,并分别记作A、B、C、D 和E 组,一并作为试验组,4℃冰箱平衡2h。静置后,对精液进行冻前镜检,并记录。本试验采用细管冷冻。用专用注射器将精液吸入0.25mL细管内(法国进口),快速封管,置于程序冷冻仪中以1℃/min 的速率从4℃缓慢降至-6℃,迅速移至液氮上方3cm 处,熏蒸15min,将细管放入液氮中保存。
1.2.3 解冻后精液品质检测
1.2.3.1 精子活率 将细管冻精取出后立即放入37℃的水浴中解冻30s,收集于试管内,然后用等温的解冻液(95%BTS常温保存液+5%相应的Ⅰ液)孵育5 min,取10μL 精液于载玻片上,盖上盖玻片,在400×显微镜下评价精子活率(直线运动精子百分率)。每次至少检测200个精子,重复10次。
1.2.3.2 畸形率 凡精子头、颈和尾任一部位发生畸形的精子均计为畸形精子。每次至少检测200个精子,重复10次,畸形率=(畸形精子数/计数精子总数)×100%。
1.2.3.3 精子质膜完整率 精子质膜完整率采用周佳勃等2005年报道的方法,以果糖-柠檬酸钠低渗液进行低渗肿胀检测(HOST)。将解冻的精液用低渗液稀释,调整精子密度为1×106个/mL,37℃孵育30min,取20μL 精液悬液滴于血细胞计数板上,在400×显微镜下观察,计算弯尾精子百分率,每次至少检测200个精子,重复10次。
1.2.3.4 顶体完整率 顶体完整率采用苏昀等1999年的报道方法,取解冻后的精液5μL 滴于载玻片上,涂片后自然风干,甲醇固定3min~5min。配好的染色液用磷酸缓冲液稀释10倍~20倍。固定好的涂片用染液浸染5 min;染好的涂片用蒸馏水冲洗晾干,用油镜每次至少检测200个精子,重复10次。
根据顶体外形和损伤情况将精子顶体分为四种类型:Ⅰ型:顶体完整,精子外型正常,着色均匀,顶体边缘整齐。Ⅱ型:顶体轻微肿胀,质膜(顶体膜)疏松膨大。Ⅲ型:顶体破坏,精子质膜严重膨胀破损,着色浅,边缘不整齐。Ⅳ型:顶体全部脱落,精子核裸露。
Ⅰ、Ⅱ型视为顶体完整;Ⅲ型、Ⅳ型视为顶体不完整。精子顶体完整率计算公式如下:精子顶体完整率=顶体完整精子数/计数精子总数×100%
1.2.4 统计分析采用IBM-SPSS 19.0软件One-way ANOVA 进行方差分析和LSD 多重比较分析,数据以Mean±SEM 表示。
2 结果
2.1 不同DMSO及混合冷冻保护剂的添加量对解冻后精子活率和畸形率的影响
DMSO 各添加组、混合冷冻保护剂各添加组及对照组冻前活率差异不显著(P>0.05)。30mL/L甘油对照组的冻后活率最高,显著高于DMSO 添加组和混合冷冻保护 剂各 添加组(P<0.05),60 mL/L DMSO 添加组的冻后活率均显著高于40、50、70、80mL/L DMSO 添加组(P<0.05),畸形率显著低于40、50、70、80mL/L DMSO 添加组(P<0.05),且40、50、70、80mL/L DMSO 添加组间冻后活率和畸形率差异不显著(P>0.05)。B 组的冻后活率显著高于A、C、D、E 组和DMSO 各添加组(P<0.05),畸形率显著低于40、50、70、80mL/L DMSO 添加组、C、D、E 和对照组(P<0.05),但与60 mL/L DMSO、A 组间差异不显著(P>0.05)。A组的冻后活率显著高于40、50、70、80mL/L DMSO添加组、D 组、E组,但与60mL/L DMSO 添加组、C组间差异不显著(P>0.05)。D组、E 组与40、50、70、80mL/L DMSO 添加组间冻后活率差异不显著(P>0.05),且D组、E组、40、50、60、70、80 mL/L DMA 添加组及对照组间畸形率差异不显著(P>0.05)。这表明DMSO 添加组的活率虽然不及30 mL/L甘油对照组,但畸形率比对照组低且差异不显著(P>0.05),这可能是由于甘油比DMSO 的毒性大。B组的冻后活率显著高于DMSO 各添加组,且畸形率显著低于DMSO 添加组及对照组,这表明按一定比例混合甘油和二甲基亚砜能有效减少畸形率(表1)。
2.2 不同DMSO及混合冷冻保护剂的添加量对解冻后精子顶体完整率和质膜完整率的影响
由表2知,60mL/L DMSO 添加组的顶体完整率和质膜完整率均显著高40、50、70、80mL/L DMSO 添加组及30 mL/L 甘油添加组(P<0.05)。40、50、60、70、80mL/L DMSO 添加组和30mL/L甘油添加组间顶体完整率和质膜完整率均差异不显著(P>0.05)。B 组的顶体完整率和质膜完整率均显著高于40、50、70、80 mL/L DMSO 添加组、A组、C 组、D 组、E 组和3%甘油添加组,但与60 mL/L DMSO 添加组间顶体完整率和质膜完整率均差异不显著(P>0.05)。40、50、70、80 mL/L DMSO 添加组、A组、C组和D组间顶体完整率 和质膜完整率均差异不显著(P>0.05),但与E 组的顶体完整率差异显著(P<0.05),质膜完整率差异不显著(P>0.05)。这说明DMSO 添加组较30 mL/L甘油对照组能显著提高冻后精子的顶体完整率和质膜完整率,且混合冷冻保护剂对精子的顶体和质膜均有较好的保护作用。
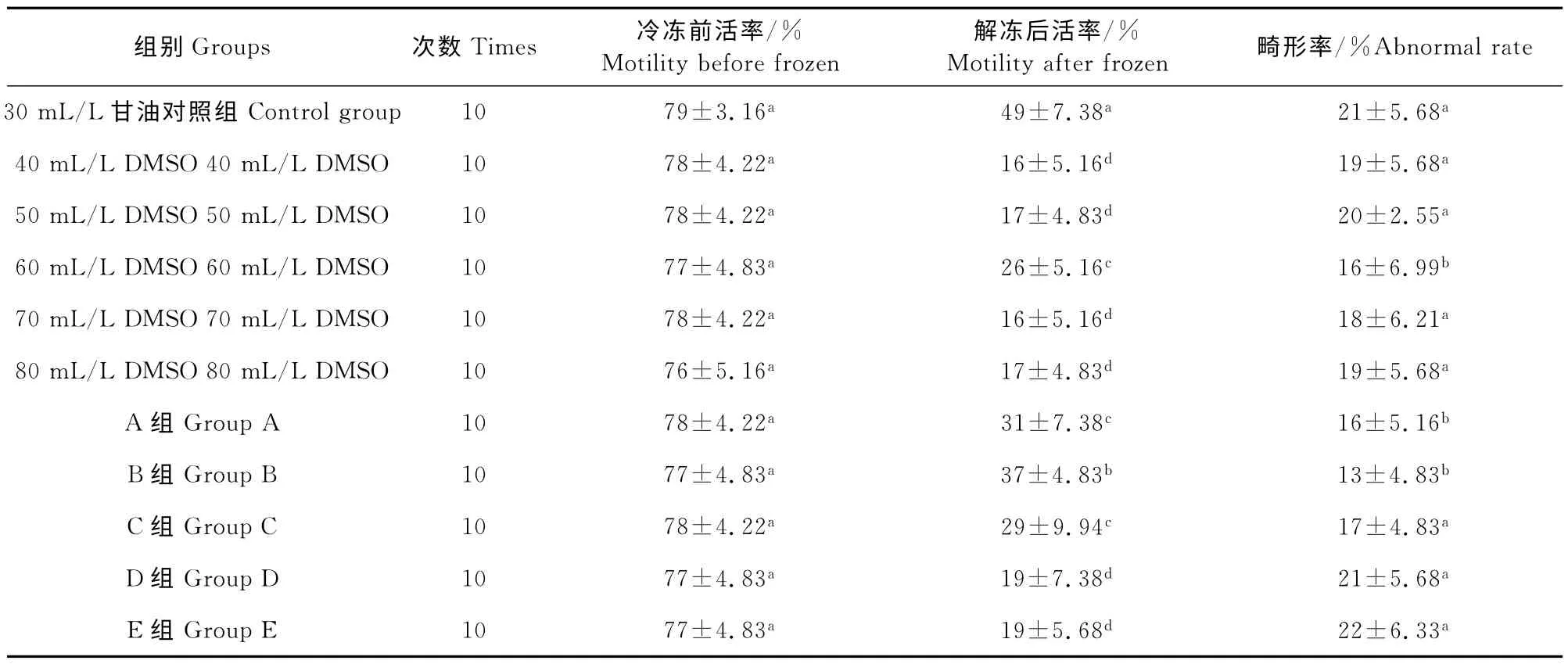
表1 不同DMSO及混合冷冻保护剂的添加量对解冻后精子活率和畸形率的影响Table 1 The effects of different addition of DMSO and mixed cryoprotectants on frozen-thawed sperm motility and sperm abnormal rate
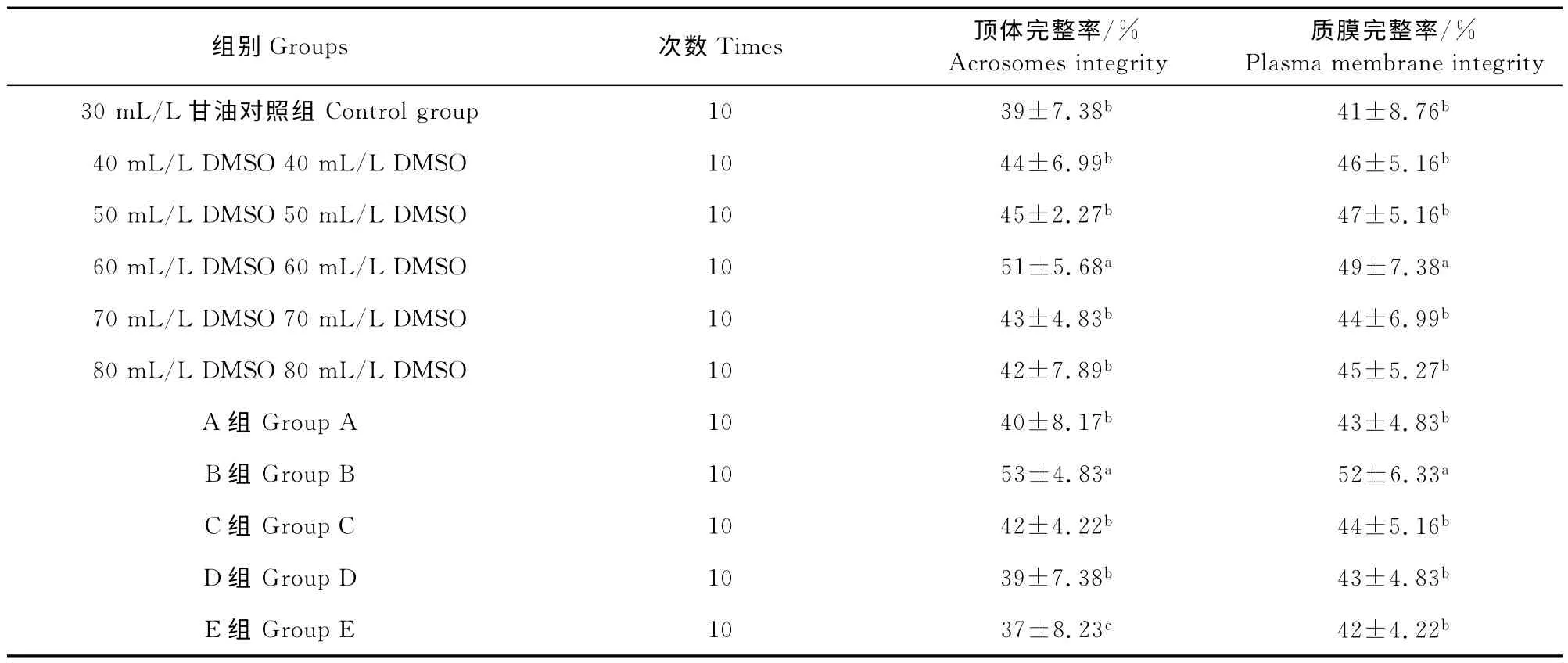
表2 不同DMSO及混合冷冻保护剂的添加量对解冻后精子顶体完整率和质膜完整率的影响Table 2 The effects of different addition of DMSO and mixed cryoprotectants on frozen-thawed sperm acrosomes integrity and plasma membrane integrity
3 讨论
3.1 精子保存温度对其品质影响
猪精子对低温打击和冷冻非常敏感,在冷冻-解冻过程中,冰晶对精子细胞结构的机械性损伤和精子细胞脱水引起的溶液性损伤是导致精子损伤的两个主要因素。冷冻时,细胞内外形成冰晶造成冷冻的物理损伤,损伤的程度最终由降温速率和冷冻的最终温度来决定。然而,细胞内形成冰晶是不可避免的,关键看所形成的冰晶的大小和数量,只有大冰晶可以造成精细胞的物理性损伤,如果仅维持在微晶状态,细胞就不会受到损伤。猪精子在迅速冷却时易失去活率,尤其是在精液采集后迅速冷却至15℃,以及至5℃和0℃,易发生冷休克。精子抗冷休克的能力受精子膜上胆固醇和磷脂的比例、烃链的饱和程度、蛋白质和磷脂的比例等的影响。因为猪精子膜磷脂酰胆碱的含量较低,精子膜上胆固醇/磷脂的比例较低,且胆固醇的分布量外膜大于内膜,使得内膜对冷休克特别敏感。所以,猪精子冷冻解冻后更容易表现出精子活率丧失,精子膜选择通透性降低,顶体膜损伤等问题。
3.2 精子冷冻保护剂作用及机理
自波尔等报告了甘油对细胞冷冻保存有利后,甘油一直被广泛用来作为冷冻保存细胞的方法,包括哺乳动物的精子。甘油作为冷冻保护剂,具有渗透性导致膜脂和蛋白的重排,促进了细胞膜的流动性和离子通透性,也使ATP 的消耗增加,甘油能在较低温度下使细胞更少的脱水,因此提高了冷冻保存细胞的活率。但是,甘油稀释液也导致精子渗透性的损伤及其毒副作用,甘油改变了精子双层膜结构,破坏了精子顶体完整性及蛋白质和糖蛋白的凝结结合。虽然甘油有一些副作用,但甘油仍然被普遍使用于精液冷冻保存中,自洛夫洛克等首次报道二甲基亚矾(DMSO)在红细胞冷冻保护中优于甘油,DMSO 单独或与其他冷冻保护剂组合被广泛用作冷冻保护剂。但在猪精液冷冻保存中,还少有人报道。
二甲基亚砜和甘油均为渗透性冷冻保护剂,但它们的冷冻保护机理却不尽相同。二甲基亚矾由于其分子量较低,它在细胞中能快速进行渗透,因此使精子快速脱水减少细胞内结冰。DMSO 可以渗透到细胞内,在细胞内外产生一定的摩尔浓度,使细胞内水分不会过分外渗,避免细胞过分脱水皱缩。DMSO 还是羟自由基的清除剂,而羟自由基是一个极其活泼的氧化剂,可由超氧阴离子和过氧化氢经Haber-weiss或Fenton 反应生成,对细胞损害严重。而甘油属于醇类化合物,含有3个羟基,每个甘油分子可从水分子中结合6个氢,在猪精液冷冻过程中,甘油的最适添加量一般为30 mL/L。因为高添加量的甘油对精子细胞具有潜在的毒性作用,而且甘油的羟自由基可能会在分子内或分子间结合,这样就导致溶液黏滞性增加,不利于甘油与水分子的结合。
3.3 精子冷冻复合保护剂效果
本试验用DMSO 完全代替甘油,结果表明DMSO 冻后活率不及甘油,可能高浓度DMSO 有较强的毒副作用,但畸形率、顶体完整率和质膜完整率在猪精液冷冻保存方面优于30mL/L 甘油,且最适合添加量为60mL/L;可见不同的保护剂各有优势所在。在混合冷冻保护剂方面,750mL/L 甘油与250 mL/L二甲基亚砜的配伍,取得了在冻后活率上优于DMSO 添加组的效果,且畸形率、顶体完整率和质膜完整率优于30 mL/L 甘油对照组,所以750 mL/L甘油与250mL/L 二甲基亚砜的配伍成最终浓度为30mL/L 的混合冷冻保护剂在猪精液冷冻保存上取得较好的效果。二甲基亚砜虽然可以降低精子畸形率,提高顶体/质膜完整率,但其解冻后精子活率有所下降,在生产实践中只要掌握好加了保护剂授精液用量,不会影响家畜正常受孕,还需要进一步在今后大量生产实践中观察和验证。二甲基亚砜对猪精液冷冻保护的机制还不太清楚,也有待进一步研究。弄清冷冻过程中精子内部物质发生的变化,探讨影响精子冷冻后存活的内外因素,以期能够筛选出更有效的精液保存方法。
[1]胡建宏.猪精液冷冻保存研究进展[D].陕西杨凌:西北农林科技大学动物科技学院,2006:167.
[2]王春伟,高 璞,苏泽智,等.冷冻保护剂对猪精液的冷冻保护作用[J].家畜生态学报,2013,34(7):88-90.
[3]KumarS,Millar JD ,Waston PF.The effect of cooling rate 0n the survival of cryopreserved bull,ram and boar spermatozoa:a comparison of two eontrolledrate cooling machines[J].Cryobiology,2003,46:246-253.
[4]Bergeron A,Manjunath P.New insights towards understanding the mechanisms of sperm protection by egg yolk and milk[J].Mol Reprod Dev,2006,73:1338-1344.
[5]Grobfeld R,Sieg B,Struckmann C,et al.New aspects of boar semen freezing strategies[J].Theriogenology,2008,70:1225-1233.
[6]方志聪,戚 智.二甲基亚砜对生物膜的作用机理[J].生物物理学报,2012,28(8):638-643.
[7]Lin H D,Bongso,A,Gauthaman,K ,et al.Human wharton's jelly stem cell conditioned medium enhances freeze-thaw survival and expansion of cryopreserved CD34+cells[J].Stem Cell Rev Repo,2013,9(2):172-183.
[8]Nakanishi K ,Deuchi K ,Kuwano K.Cryopreservation of four valuable strains of microalgae,including viability and characteristics during 15years of cryostorage[J].J Appl Phycol,2012,24(6):1381-1385.
[9]袁慧敏,张旭成,王 贺,等.不同冷冻保护剂对黑熊成纤维细胞冷冻效果的影响[J].江苏农业科学,2011(1):242-243.
[10]Naaldijk Y,Staude M,Fedorova V,et al.Effect of different freezing rates during cryopreservation of rat mesenchymal stem cells using combinations of hydroxyethyl starch and dimethylsulfoxide[J].BMC Biotechnol,2012,12(49):1472-6750.
[11]Vaas L A I,Marheine M,Seufert S,et al.Impact of pr-10a overexpression on the cryopreservation success ofSolanum tuberosumsuspension cultures[J].Plant Cell Reports,2012,31(6):1061-1071.
[12]Miliorini A B.A morphological classification proposal for curimba(Prochilodus lineatus)sperm damages after cryopreservation[J].Aqu Res,2011,42(2):177-187.
[13]Penaranda D S.Improvement of European eel sperm cryopr-eservation method by preventing spermatozoa movement activation caused by cryoprotectants[J].Cryobilogy,2009,59(2):119-126.
[14]He S Y.Effects of dimethyl sulfoxide and glycine on cryopreservation induced damage of plasma membranes and mito-chondria to striped bass(Morone saxatilis)sperm[J].Cryobiology,2004,48(3):254-262.
[15]Si Wei.Cryoprotective effect off our penetrating cryoprotectants on rhesus monkey(Macacamulatta)spermatozoa cryopreservation[J].Zool Res,2004,25(1):32-36.

