猪化脓隐秘杆菌的分离鉴定及病原特性研究
张乐宜,蔡汝健,宋长绪
(广东省农业科学院动物卫生研究所 广东省兽医公共卫生公共实验室,广东广州510640)
化脓隐秘杆菌(Acranobacterium pyogenes)又称化脓放线菌(Actinomyces pyogenes)、化脓棒状杆菌(Corynebacterium pyogenes),属于隐秘杆菌属(Arcanobacterium)细菌。该菌最早于1893年从牛的脓汁中分离到,常引起人、牛、羊、猪、林麝发生化脓性感染或败血症等。该菌的致病性主要与它所产生的几种毒力因子有关,目前已发现的化脓隐秘杆菌毒力因子有4 类,分别为化脓隐秘杆菌溶血素(PLO)、胶原结合蛋白(CbpA)、神经氨酸酶(Nan)及菌毛合成蛋白(Fim)[1]。近期研究表明,菌株携带有不同毒力因子对小鼠的致病性不同,其中同时携带PLO 基因和NanP 基因的菌株的致病性要明显强于同时携带其他几种毒力因子的菌株[2]。本研究对2013年7月从广东惠州某猪场发病猪的内脏器官分离到的1株病原菌进行了细菌常规鉴定、16S rRNA 测序分析及毒力因子进行PCR检测。通过对该病原菌的生物学特性、遗传进化关系,毒力因子的携带情况,耐药基因的分布情况,为猪化脓隐秘杆菌的流行病学调查及相关研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株来源 2013年7月广东惠州某猪场保育仔猪出现大规模发病,病猪体温达到41℃,食欲差,消瘦,个别猪只出现不食、咳嗽、喘气等症状。无菌条件下采集心包液、心脏、肺脏、肝脏等病料进行细菌分离鉴定。
1.1.2 试剂及培养基 绵羊鲜血琼脂平板、巧克力平板、营养肉汤、脑-心浸液培养基(BHI)购自广东环凯生物科技有限公司;进口胎牛血清购自北京鼎国昌盛生物科技有限公司;常见药物的药敏纸片购自北京天坛生物制品股份有限公司;细菌生化微量鉴定管购自杭州天和微生物试剂有限公司。细菌基因组DNA 提取试剂盒、2×EXTaq酶等购自上海美吉生物医药科技有限公司;DNA Marker DL 2 000、10×Loading buffer、胶回收试剂盒、质粒提取试剂盒等购自宝生物工程(大连)有限公司。
1.1.3 实验动物 3周龄SPF 级Babl/c小鼠10只,购自南方医科大学实验动物中心。
1.2 方法
1.2.1 引物设计与合成 参考GenBank中已发表的细菌16SrRNA 基因设计一对特异性引物,用于细菌的分子生物学鉴定。依据参考文献[3]合成7对化脓隐秘杆菌毒力基因plo、nanH、nanP、cbpA、fimA、fimC、fimG 的引物。引物由上海捷瑞生物工程有限公司合成,引物序列见表1。

表1 PCR 扩增相关基因的引物序列Table 1 Primer sequences for amplification of relation related genes
1.2.2 细菌的分离培养及纯化 在无菌条件下,用灭菌好的手术用剪刀剪开心脏、肺脏、肝脏,使其暴露新鲜创面,用高压灭菌的棉签或接种环在创面上进行轻轻涂抹,并接种于巧克力平板和绵羊鲜血平板培养基上,37℃培养48h,挑取优势菌落进行革兰染色、镜检。并挑取溶血的可疑小菌落于血平板上进行纯化。
1.2.3 生化试验 将10μL 培养好的含有50 mL/L胎牛血清菌液分别接种到不同的微量生化管,37℃培养48h,观察记录结果。同时参照微生物鉴定系统说明书进行鉴定。
1.2.4 药物敏感性试验 取100μL培养的新鲜菌液用涂布棒轻轻在绵羊鲜血平板培养基上涂布均匀,然后采用琼脂扩散法(KB 法)进行常用抗菌类药物的敏感性试验,37℃恒温培养48h后取出,以抑菌圈直径作为判定指标,判断标准依据美国临床标准委员会(NC-CLS)手册2005版。
1.2.5 分离菌株16SrRNA 及毒力基因的PCR扩增与序列测定 在血平板上挑取单个菌落,接种于含有50 mL/L 胎牛血清的BHI培养基内,37℃培养48h。12 000r/min离心5min,弃上清,收集菌体。然后按照DNA 抽提试剂盒说明书进行提取。以提取的基因组DNA 为模版,进行16 S rRNA 及毒力基因的PCR 扩增与测序。
反应体系均为50μL:2×EXTaq酶25μL,ddH2O 17μL,上、下游引物各2μL,DNA 模版4μL。16SrRNA 反应条件为:94℃5min;94℃30 s,60℃1 min,72℃2 min,35 个循环;72℃延伸7 min。毒力基因的反应条件为:94℃3 min;94℃1min,57℃/60℃1min,72℃2 min,35 个循环;72℃延伸7min。取10μL PCR 产物用12g/L 的琼脂糖凝胶电泳进行跑胶检测,并设DNA Marker做参照。
PCR反应产物根据基因组DNA 凝胶回收试剂盒的操作说明进行,回收产物用12g/L的琼脂糖凝胶进行电泳检测。回收的目的DNA 片段与PCR 2.1TA 克隆载体连接4℃过夜,次日转入E.coliDH5α感受态细胞中,转化子经蓝白斑筛选阳性克隆,提取质粒进行PCR检测,并将筛选到的阳性克隆送上海美吉生物医药科技有限公司进行序列测定。测序结果在GenBank数据库中进行Blast分析比对,用BioEdit及MEGA 4.0软件对相近序列进行同源性分析,构建系统发育树。
2 结果
2.1 细菌的分离培养
病料接种于巧克力平板培养基上37℃培养48h后长出数量较多的相似菌落,将单个菌落在血平板上划线培养后,菌落呈光滑、湿润、半透明的乳白色小菌落,周围呈现明显的界限分明,完全透明的无色β溶血环。涂片染色镜检,可见革兰阳性多形态的杆菌(表2)。
2.2 生化特性
观察并记录不同标签的微量生化培养管内颜色的变化,依照试剂盒内说明书的判定标准,其特性与化脓隐秘杆菌相似,结果初步判定为化脓隐秘杆菌(表3)。
2.3 药敏试验结果
分离株对头孢唑啉、头孢拉定、头孢噻肟、新生霉素、阿莫西林、氨苄西林、万古霉素敏感性最高,对强力霉素、恩诺沙星、阿米卡星、氧氟沙星等呈中度敏感,对链霉素、磺胺异噁唑、四环素、庆大霉素、林可霉素、新诺明、诺氟沙星均耐药。

表2 不同来源的分离菌株Table 2 The isolate strains from different sources

表3 分离菌株生化试验结果Table 3 The results of isolate strain by biochemical reaction
2.4 16SrRNA 的PCR 扩增结果
分离株的16SrRNA 基因的PCR 扩增产物经12g/L的琼脂糖凝胶电泳检测显示,在1 358bp处扩增出一条特异性的条带,与预期大小相符。测序结果在GenBank数据库中进行Blast分析显示,分离株与国内外已发表的分离自牛、野猪、羊等动物的化脓隐秘杆菌16SrRNA 基因同源性均在90%以上(图1)。从建立的进化树中可以看出,本试验的分离株GDHZ 为一个独立分支,但与JQ975947、JQ975944、HM246725 三个独立分支关系较近,而与其他分离株的关系相对稍远。从核苷酸序列同源分析显示,GDHZ株分别与JQ975947(中国新疆)、JQ975944(中国新疆)、HM246725(中国四川)分离自牛和林麝的菌株同源性最高为94.0%~95.0%,其次与NR-027195(美国马里兰州)、HE575404(德国波恩)分离自人和野猪的菌株同源性为91.6%~92.6%。这些结果显示,本次分离株与中国西南地区的分离株关系最近,而与其他地域的分离株的关系相对稍远,说明本次分离的菌株与国外其他分离株之间存在时间和地域上的差异。

图1 16SrRNA 基因PCR 扩增结果Fig.1 The PCR results of 16SrRNA gene
2.5 毒力基因的PCR 扩增结果
4种毒力基因检测结果显示,plo、nanH、fimA 3种毒力基因扩增出了预期的目的片段,测序结果在Blast中比对分析显示,plo(溶血素)基因与日本分离自猪的菌株(登录号AB027461.1)、中国黑龙江分离自牛的菌株(登录号HQ637573.1)、美国分离自牛的菌株(U84782.2)核苷酸同源性为99%,共有2个碱基发生突变。nanH(神经氨酸酶)基因与美国分离自牛的菌株核苷酸同源性为90%,共有62处碱基发生突变,1处碱基发生缺失(图2和图3)。
2.6 动物致病性试验结果
Babl/c小鼠接种分离菌株后,在12h出现2只小鼠出现死亡,其他3只小鼠出现精神委顿、活动减少等临床症状。48h剩余3只小鼠全部死亡,试验对照组精神、食欲均正常,未见死亡。采集病死小鼠的内脏器官用巧克力和绵羊鲜血平板培养基分离细菌后,并进行plo基因PCR 的扩增和测序,证实致病菌为猪化脓隐秘杆菌。
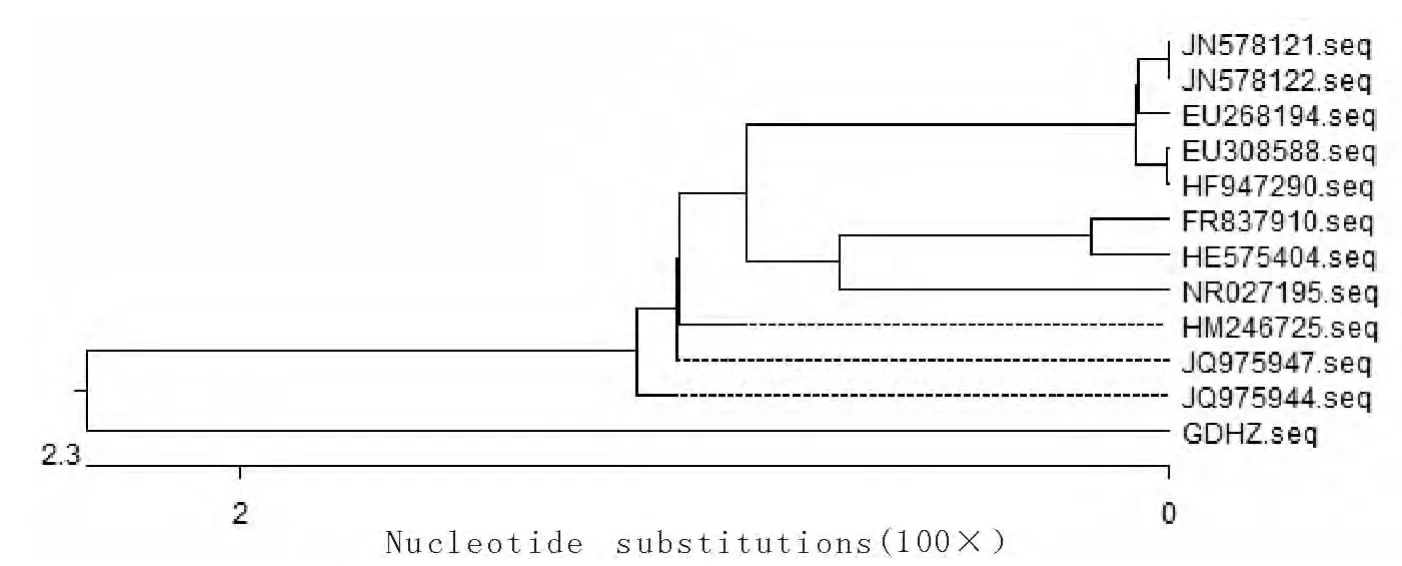
图2 基于16SrRNA 基因核苷酸序列遗传进化树Fig.2 The phylogenetic tree based on the nucleotide sequence of 16SrRNA gene
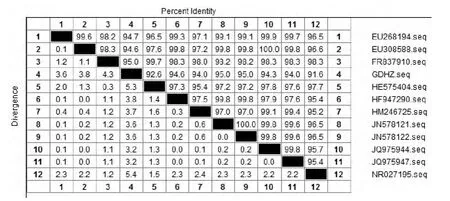
图3 不同分离菌株16SrRNA 基因核苷酸序列同源性分析Fig.3 Analysis on nucleotide sequence homology of 16SrRNA gene from the different isolates
3 讨论
猪化脓隐秘杆菌通常被认为是一种条件致病菌,可以引起牛、羊、猪、野猪、犬等动物发生肺炎、乳房炎、子宫内膜炎、关节炎、外耳炎、膀胱炎及肝脏、肾脏脓肿等疾病。该病菌对牛羊的致病性最强,牛场容易大规模暴发该病。近年来关于牛羊感染化脓隐秘杆菌的报道较多,但对猪感染的报道较少。我国从1999年-2011年报道了发生在河南、河北、湖南、四川等省份由化脓隐秘杆菌引起猪发生以肝、肺化脓性结节,脾出血性肿大、败血症等临床症状的病例[4-5]。曾有报道化脓隐秘杆菌感染人的事件[6]。因此,在目前动物疫病复杂多变的情况下,要提高对该病的防范意识,避免重大突发传染病的发生。
本研究发现化脓隐秘杆菌除了可以在病变的脓性结节、肺脏等分离到该菌,也可以在发生心包炎的心脏中分离到该菌。猪化脓隐秘杆菌的培养过程中,该菌在巧克力平板、绵羊鲜血平板培养基上37℃培养48h长出肉眼可见灰白色菌落,且生长良好。据报道该菌对大环内酯类和四环素类抗生素的耐药性最为严重[7]。药敏试验结果显示该菌对大多数的常用药物具有多重耐药性,PCR检测出耐药基因ermC、tetB等。动物试验发现,经肌肉注射培养菌液后12h小鼠即出现死亡,48h小鼠全部死亡。从病死小鼠体内分离到的细菌,利用PCR 方法扩增plo基因并测序,结果表明为化脓隐秘杆菌,说明该菌株具有较强的致病性。16SrRNA 在细菌种内相当保守,而种间某些区域在一级结构水平上有显著差异。现已将16SrRNA 作为一种细菌分类和鉴定的“金标准”广泛地应用于科学研究[8]。目前大约2 500个种的16SrRNA 全基因序列已经被报道。根据它们的序列同源性,已成功构建了各种属的系统发育树。由于细菌鉴定的传统方法是生化试验,但又存在一定程度的误差,不能快速准确地得出结论且费时费力。遗传进化树分析表明该菌株与分离自不同地区和国家的菌株之间存在一定的遗传进化关系。其中与JQ975947(中国新疆)、JQ975944(中国新疆)、HM246725(中国新疆)三个独立分支关系较近,而与其他国外分离株的关系相对稍远,说明他们之间存在时间和地域上的差异。测序结果表明16SrRNA 基因核苷酸序列与GenBank中已发表的分离自牛、羊、林麝、野猪等动物的猪化脓隐秘杆菌同源性均为90%以上,证实此次分离的菌株为猪化脓隐秘杆菌。

图4 毒力基因的PCR 扩增结果Fig.4 The PCR results of virulence genes

图5 plo基因的PCR 扩增结果Fig.5 The PCR results of plo gene

图6 plo基因序列测定结果Fig.6 Sequencing of the plo gene
化脓隐秘杆菌主要包括四种毒力因子,即溶血素(PLO)、胶原结合蛋白(CbpA)、神经氨酸酶(NanH/P)及菌毛合成蛋白(Fim)。是一种外毒素,能够溶解多种动物的红细胞、免疫细胞,并引起试验动物的皮肤坏死以及动物的死亡。PLO 还呈现出对牛多形核粒细胞和袋鼠肾细胞的细胞毒性效应[9-10]。该毒力因子免疫小鼠具有很好的免疫原性[11]。神经 氨酸酶(neuraminidase,Nan)有2 种,即NanH 和NanP,分 别 由nanH 和nanP 编 码。Nan具有多种毒力作用,能够分解宿主细胞的唾液酸作为碳源,促进其在低养分条件下的生长。降低膜表面黏液的黏滞性,便于细菌潜入深层组织,并可分解蛋白质如IgA,与宿主防御反应有关,同时能够增强细菌对宿主的黏附力、聚集力和感染力。本试验利用PCR 技术扩增出了plo(溶血素)、nanH 两种毒力基因。其中plo基因的核苷酸序列与已发表基因序列同源性为100%;nanH 基因的核苷酸的同源性为89%,其中测定的核苷酸序列中发生3个连续碱基的缺失,并有62处碱基发生了突变,说明该基因的变异导致菌株的致病性发生了变化,其致病力变强。另外,据报道菌毛合成蛋白(Fim)也是化脓隐秘杆菌的一种毒力因子,而且试验中参考Ewa Zastempowska等设计的引物进行相关基因的扩增,其中扩增出了fimA、fimG 基因预期的片段大小,测序结果后Blast分析未在GenBank中找到相似的已发表基因序列,该基因是否与致病有关还有待于进一步研究。
目前对化脓隐秘杆菌毒力因子的研究还不很全面,对某些已发现的毒力因子的作用机理的阐述也还不够明确。特别是本次分离鉴定的菌株与我国新疆、四川分离株亲缘关系最近,但毒力基因核苷酸序列分析显示与黑龙江、日本分离株同源性较高,这两者之间存在什么样的关系目前还不清楚,有待于进一步去证实。我国对化脓隐秘杆菌的致病性、致病机理、流行病学研究还处于起步阶段,毒力因子在感染人和动物机体过程中起到的作用及其免疫原性也有待于进一步深入研究。本研究可为猪化脓隐秘杆菌病的流行病学调查及致病机理和防治研究提供理论依据。
[1]郭文洁,刘明春.化脓隐秘杆菌毒力因子的研究进展[J].中国兽医杂志,2010,46(1):52-53.
[2]徐 凝,张文龙,王君伟.牛化脓隐秘杆菌的分离及其主要毒力基因的PCR鉴定[J].中国兽医科学,2013,43(2):126-130.
[3]Zastempowska E.Genotypic characterization and evaluation of an antibiotic resistance of Trueperella pyogenes(Arcanobacterium pyogenes)isolated from milk of dairy cows with clinical mastitis[J].Vet Microbiol,2012,161(1-2):153-158.
[4]鲁杏华,谈志祥.猪化脓隐秘杆菌的分离与鉴定[J].中国畜牧兽医,2009,36(5):3.
[5]陈 蕾,刘孟良,代洪波.一株猪源化脓隐秘杆菌的分离与鉴定[J].养猪,2011(5):111-112.
[6]Kavitha K,Jayanthi K,Oudeacoumar P,et al.Three cases of Arcanobacterium pyogenes-associated soft tissue infection[J].J Med Microbiol,2010,59(5):736-739.
[7]ZhaoK L.Detection and characterization of antibiotic resistance genes in Arcanobacterium pyogenesstrains from abscesses of forest musk deer[J].J Med Microbiol,2011,60(5):1820-2182.
[8]刘明春,刘耀川,赵敬翠.奶牛子宫内膜炎化脓隐秘杆菌16S rRNA 基因的鉴定与分析[J].中国兽医学报,2009,29(3):343-345.
[9]Pietrocola G,Valtulina V,Speziale P,et al.Functional and structural properties of CbpA,a collagen-binding protein from Arcanobacterium pyogenes[J].Microbiology,2007,153(4):3380-3389.
[10]Carlos E.Arcanobacterium pyogenes Sepsis in Farmer,Brazil[J].Emerg Infect Dis,2009,15(7):1131-1132.
[11]Zhao K,Liu M,Zhang X,et al.in vitro and in vivo expression of virulence genes in Trueperella pyogenes based on a mouse model[J].Vet Microbiol,2013,163(3-4):344-350.

