猪瘟病毒E0蛋白的原核表达及鉴定
郭东光,朱艳平,孙国鹏,岳 峰,贾文科,王 军,2,李 鹏,2,王自浩,王选年*
(1.新乡学院生命科学与技术系生物技术研究中心,河南新乡453003;2.郑州大学,河南郑州450000)
猪瘟(Classical swine fever,CSF)是严重危害我国养猪业的主要传染病之一,是由猪瘟病毒(Classical swine fever virus,CSFV)引起猪的一种急性、发热性、高度接触性传染病[1]。CSFV 基因组为12.3kb的单股正链线性RNA,包含一个开放性阅读框(ORF),编码一个由3 898个氨基酸组成的多聚蛋白。此多聚蛋白经病毒和宿主细胞酶的作用形成4个结构蛋白(C、E0、E1、E2)和8个非结构蛋白(p7、Npro、NS2、NS3、NS4A、NS4B、NS5A、NS5B)[2]。E0、El和E2是CSFV 病毒粒子3 种囊膜糖蛋白,其中E0 和E2 是病毒诱导机体产生中和抗体的2个主要保护性抗原,同时也是病毒吸附、穿入敏感细胞的必需糖蛋白[3]。E0 蛋白由232 个氨基酸残基构成,分子质量约为44ku~50ku,其同源二聚体分子质量为97ku,无疏水的膜锚定结构,能直接从被感染的细胞内分泌到细胞外,为可分泌性蛋白,并可诱导机体产生中和抗体抵抗致死剂量CSFV 的攻击[4]。在CSFV 中编码E0的核酸序列比编码E2的序列相对保守,因此,表达E0 蛋白也可作为CSF 亚单位疫苗的潜在抗原[5]。中和试验表明,E0 与CSFV 的宿主嗜性有关,用针对E0的单克隆抗体可有效阻断CSFV 对易感动物细胞的感染[6]。易感动物感染CSFV 后可产生针对E0、E2和NS2-3的抗体,但针对NS2-3的抗体不能用于疫苗毒和野毒鉴别诊断,只能用E0蛋白的抗体进行鉴别诊断,特别是当疫苗中用E2作为主要免疫原时,就需要标记E0蛋白来进行血清学鉴别是否存在潜在感染[7]。本研究以CSFV E0基因为研究对象,利用大肠埃希菌原核表达系统成功表达并获得了E0重组目的蛋白,通过Western blot验证该蛋白具有良好的反应原性,能用于临床CSF 抗体的检测,为研究CSFV 抗体检测试剂盒奠定了抗原基础。
1 材料与方法
1.1 材料
1.1.1 菌株、载体及工具酶 大肠埃希菌(E.coli)DH5α工程菌、Rostta(DE3)工程菌、质粒pGEX-CSFV全长质粒由河南科技学院动科学院胡建和教授惠赠;原核表达载体pGEX-4T-2由本实验室保存;ExTaqDNA 聚合酶、核酸内切酶BamH I、XhoⅠ,pMD18-T-simple vector systems、T4DNA 连接酶均为TaKaRa公司产品;普通TaqDNA 聚合酶,为北京鼎国公司产品。
1.1.2 主要试剂 质粒小量提取试剂盒,TIANGEN公司产品;琼脂糖凝胶电泳回收试剂盒,OMEGA公司产品;CSFV兔化高免血清由本实验室制备;HRP标记的羊抗兔二抗、AEC显色试剂盒均为北京中杉金桥生物公司产品。
1.2 方法
1.2.1 引物的设计及合成 根据已发表在GenBank CSFV C株序列AF531433.1,设计一对特异性引物用于扩增CSFV E0基因片段,并在其上、下游两端加上BamHⅠ和XhoⅠ限制性内切酶酶切位点,扩增目的片段长度为561bp。该引物由北京鼎国生物技术有限公司合成,其引物设计如下:F:5′-CGGGATCCGCCACAGACGTGGAGCTGAAAG-3′;R:5′-CCCTCGAGTTAACAGTAAGGCGATAGGGCATAAGC -3′。
1.2.2 CSFV E0目的基因的扩增 以pGEX-CSFV全长质粒为模板,ExTaqDNA 聚合酶进行目的基因片段的扩增,取扩增产物于10g/L琼脂糖凝胶电泳检测结果。
1.2.3 重组表达载体的构建及菌液PCR和双酶切鉴定 将纯化后的PCR 产物连接至pMD18-T-simple vector,经鉴定正确后,命名为pMD18-T-simple-E0。双酶切回收目的片段,于16℃水浴中过夜连接至表达载体pGEX-4T-2,经鉴定后命名为pGEX-4T-2-E0。取连接产物转化至E.coliDH5α工程菌后进行菌液PCR鉴定。其检测方法同1.2.2。将上述菌液PCR鉴定的阳性重组子,进行双酶切鉴定。取适量酶切产物在10g/L琼脂糖凝胶中检测结果。
1.2.4 pGEX-4T-2-E0的诱导表达和优化 将测序正确的重组质粒pGEX-4T-2-E0,转化至大肠埃希菌Rostta(DE3),加入IPTG 至终浓度为1.0 mmol/L,分别于37℃、28℃、18℃诱导4h,SDSPAGE检测最佳诱导温度。在确定的最佳诱导温度下按上述方法重新诱导培养4h,分别加入IPTG 浓度为1.0、0.8、0.6、0.2mmol/L,诱导结束后SDSPAGE检测最佳IPTG 浓度。
1.2.5 可溶性分析鉴定 最佳诱导条件进行诱导表达,收集菌体后超声波裂解破碎菌体,分别收集沉淀和上清进行SDS-PAGE检测,确定目的蛋白的表达形式。
1.2.6 表达产物的Western blot鉴定 用半干转转膜仪在电压为25V 条件下转膜45 min。结束后取出PVDF 膜,TBST 洗膜3次,用50g/L 脱脂奶粉4℃封闭过夜;再用TBST 洗膜3次,分别按1∶200和1∶2 000 的比例加入猪瘟兔化高免血清和GST 单抗稀释液于室温反应2h;TBST 洗膜3次,分别按1∶2 000的比例加入HRP羊抗兔二抗和羊抗鼠二抗于室温反应1h;TBST 洗膜3次,AEC 显色试剂盒显色,ddH2O 冲洗终止显色后观察。
1.2.7 目的蛋白的纯化 取适量已裂解包涵体于PE管内,加100μL 2×SDS Loading buffer,再加入等量的包涵体裂解溶液,混合均匀后按常规方法进行电泳,每块胶的上样量为200μL~500μL。电泳结束,取出胶块用0.1mol/L 的KCl染色10min~20min,待银白色的目的条带清晰出现后,切下目的条带,透析,进行水平电泳(120 V,220 mA)2h~4h。电泳结束后,将透析袋放在新鲜的PBS中,低温透析过夜。收集透析袋内的上清,适当离心后即为重组目的蛋白。
2 结果
2.1 目的片段的PCR 扩增结果
取适量PCR 产物于10g/L 的琼脂糖凝胶电泳检测,观察到一条与理论值大小相符的目的条带,约561bp(图1)。

图1 E0基因的PCR 扩增结果Fig.1 PCR results of E0gene
2.2 pGEX-4T-2-E0的菌液PCR 和双酶切鉴定结果
PCR 和双酶切鉴定所挑取菌落,均在561bp处出现了特异性目的条带(图2和图3)。其结果证明成功构建了重组表达载体pGEX-4T-2-E0。
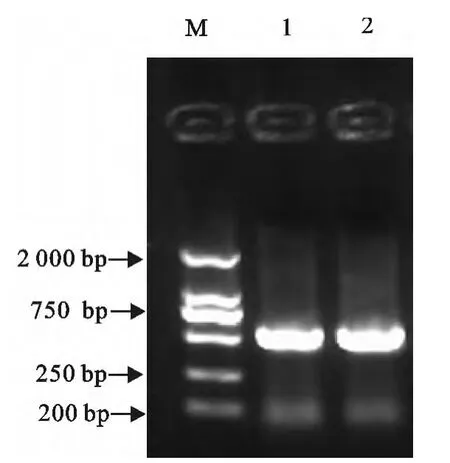
图2 重组表达质粒pGEX-4T-2-E0的菌液PCR鉴定Fig.2 Identification of recombinant expression plasmid pGEX-4T-2-E0by PCR

图3 重组表达质粒pGEX-4T-2-E0的双酶切鉴定Fig.3 Identification of the recombinant expression plasmid pGEX-4T-2-E0by BamHⅠand XhoⅠdigestion
2.3 pGEX-4T-2-E0的诱导和优化结果
分别将37℃、28℃、18℃诱导的样品处理后,SDS-PAGE检测,结果发现pGEX-4T-2-E0在37℃表达(图4)。在此条件下不同的IPTG 浓度诱导4h,结果证明IPTG 浓度在1.0mmol/L 时其表达量相对较高(图5)。其结果表明重组表达菌株在37℃、IPTG 浓度在1.0mmol/L时为其最佳表达条件。

图4 重组表达质粒pGEX-4T-2-E0的不同温浓度诱导结果Fig.4 The induced expression levels of pGEX-4T-2-E0at different temperatures

图5 重组表达质粒pGEX-4T-2-E0在不同IPTG 浓度诱导结果Fig.5 The induced expression levels of pGEX-4T-2-E0at different concentrations
2.4 表达产物的Western blot鉴定结果
Western blot结果显示,重组蛋白均与猪瘟兔化高免血清和GST 标签单抗在46ku左右出现了特异性目的条带(图6),证明所表达的融合蛋白被正确表达且具有良好的抗原性。
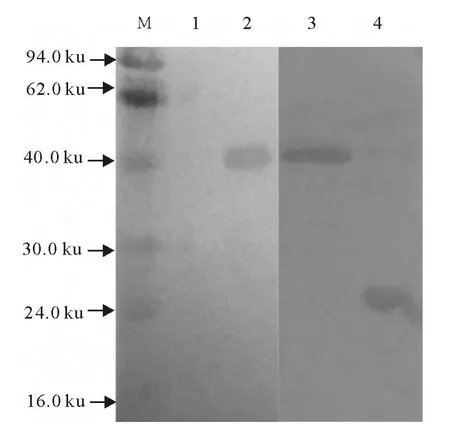
图6 重组蛋白和猪瘟兔化高免血清和GST 标签单抗反应Fig.6 pGEX-4T-2-E0/Rostta(DE3)proteins reacted with CSFV positive serum and GST monoclonal Ab
2.5 表达产物的可溶性分析及目的蛋白的纯化
分别将处理的样品取上清和沉淀进行SDSPAGE检测,结果显示沉淀中含有大量目的蛋白(图7),说明目的蛋白以包涵体形式表达。包涵体经切胶纯化处理后,获得纯较高的目的蛋白(图7),其含量为1.0mg/mL。

图7 SDS-PAGE重组目的蛋白的纯化Fig.7 Analysis of purified recombinant E0proteins by SDS-PAGE
3 讨论
E0 是CSFV 重要结构糖蛋白,参与构成CSFV病毒粒子的外衣壳,介导CSFV 的早期感染,诱导机体产生中和抗体[8]。因此,E0蛋白在标记疫苗的研制和应用上具有重要的血清学鉴别功能,该蛋白对于监测CSFV 的流行情况、疫苗免疫情况及制定免疫程序具有重要的作用[9]。特别是处于抗原表位的191~227氨基酸,也能区分瘟病毒属中的CSFV、BVDV 和BDV,是目前诊断CSFV 抗体的理想抗原[10]。此外,E0 基因具有RNase活性,该活性能够影响宿主细胞中病毒RNA 的复制,并且对感染动物早期的免疫防御有一定的抑制作用[11]。研究显示,E0可降解自身的RNA ,但在猪瘟病毒感染过程中可通过一种特殊的保护机制使自身RNA 与E0的隔离,从而避免对自身的降解。RNase 除降解RNA 外,还具有细胞毒性、抗蠕虫和免疫抑制活性、抗肿瘤、免疫调节等作用[12]。本研究的前期研究表明,在E0蛋白上存在一段多肽序列,该段多肽能有效结合靶细胞,与CSFV 共同竞争被感染细胞中存在的病毒受体,从而有效抑制CSFV 的入侵。本研究为进一步验证该多肽序列在E0蛋白上的功能和作用,顺利得到所需重组目的蛋白,采用了多个原核表达系统进行尝试,针对目的片段我们分别选择了pET-30a(+)、pET32(a)+和pGEX-4T-2,诱导发现E0 蛋白只在原核表载体pGEX-4T-2 中得到表达,并且只有在37℃明显表达。其原因可能与原核表达系统无修饰功能有关,也可能与其N 端部分的疏水碱基序列的影响,不利于蛋白质的起始翻译有关,需要融合标签的引导才能起始E0 蛋白的翻译[13]。国内学者李鹏、陈振海、吴素丽等也表达了该蛋白,但效果均不佳,主要是存在表达量低,不容易纯化等问题[14-16]。本研究为克服以上研究的缺点,分别在表达载体上和表达宿主菌上进行了筛选,最终确定了最佳表达载体为pGEX-4T-2,最佳诱导宿主菌为Rosetta细胞。另外,为克服因表达形式为包涵体不容易纯化的特点,本研究采用切胶回收的纯化方法,其操作简单、方便,并且获得了纯度较高的重组目的蛋白,为后续多肽功能研究和抗体检测打下了很好的抗原基础。
[1]Li Y F,Shen L,Sun Y,et al.Simplified serum neutralization test based on enhanced green fluorescent protein-tagged classical swine fever virus[J].J Clin Microbiol,2013,8(51):2710-2712.
[2]Zhang H,Wang Y H,Cao H W,et al.Phylogenetic analysis of E2genes of classical swine fever virus in China[J].Vet Med,2010,65(4):151-153.
[3]Guo H C,Sun S Q,Sun D H,et al.Viroporin activity and membrane topology of classic swine fever virus p7protein[J].Int J Biochem Cell Biol,2013,45(7):1186-1194.
[4]Hulst M M,Moormann R J.Inhibition of pestivirus infection in cell culture by envelope proteins Erns and E2of classical swine fever virus:Erns and E2interact with different receptors[J].J Gen Virol,1997,78(11):2779-2787.
[5]Wang Y H,Li P H,Zhang M T,et al.Construction of recombinant fowl pox virus expressing E0gene of classical swine fever virus shimen strain and the animal immunity experiment[J].Bing Du Xue Bao,2008,24(1):59-63.
[6]Guo K K,Zhang W M,Zhang,Y M,et al.Construction of a recombinant fowl pox virus expressing the E0/E2proteins of classical swine fever virus and its evaluation in experimental animals[J].Asian J Anim Vet Adv,2011,6(7):654-666.
[7]Sun Y,Liu D F,Wang Y F,et al.Generation and efficacy evaluation of a recombinant adenovirus expressing the E2protein of classical swine fever virus[J].Res Vet Sci,2010,88(1):77-82.
[8]Dong X Y,Yan H C,Tang S Q,et al.Structural glycoproteins of classical swine fever virus:implication for vaccine development[J].Israel J Vet Med,2013,68(2):78-86.
[9]Schroeder S,von Rosen T,Blome S,et al.Evaluation of classical swine fever virus antibody detection assays with an emphasis on the differentiation of infected from vaccinated animals[J].Revue Scientifique Technique,2012,31(3):997-1010.
[10]Xu Y G,Cui L C,Tian C Y,et al.Immunogenicity of recombinant classic swine fever virus CD8+T lymphocyte epitope and porcine parvovirus VP2antigen coexpressed by lactobacillus casei in swine via oral vaccination[J].Clin Vac Immunol,2011,18(11):1979-198.
[11]Wu C W,Chien M S,Liu T Y,et al.Characterization of the monoclonal antibody against classical swine fever virus glycoprotein Erns and its application to an indirect sandwich ELISA[J].Appl Microbiol Biotechnol,2011,92(4):815-821.
[12]Langedi J P,Middel W G,Meloen R H,et al.Enzyme-linked immunosorbent assay using a virustype-specific peptide based on a subdomain of envelope protein E0for serologic diagnosis of pestivirus infections in swine[J].Clin Microbiol,2001,39(3):906-912.
[13]Windisch J M,Schneider R,Stark R,et al.RNase of classical swine fever virus:biochemical characterization and inhibition by virus-neutralizing monoclonal antibodies[J].J Virol,1996,70(1):352-358.
[14]吴素丽,孙惠玲,钱永华.猪瘟病毒E0 蛋白的高效表达及其间接ELISA 检测方法的建立[J].动物医学进展,2009,30(8):13-18.
[15]陈振海,王 琴,范学政,等.猪瘟病毒E0蛋白的原核表达及其间接ELISA 检测方法的建立[J].中国病毒学,2005,20(2):135-139.
[16]李 鹏,张彦明,张 志,等.猪瘟流行毒株E0蛋白的原核表达及其间接ELISA 方法的建立[J].西北农林科技大学学报,2008,36(10):24-28.

