牛病毒性腹泻病毒NS3蛋白的原核表达及鉴定
范 晴,谢芝勋,谢志勤,刘加波,庞耀珊,邓显文,谢丽基,罗思思
(广西兽医研究所,广西南宁530001)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)可引起的牛的致死性腹泻,呼吸及繁殖障碍,是养牛业中较为常见的传染病。临床特征为发热,腹泻,急、慢性黏膜病,白细胞减少,持续性感染与免疫耐受,免疫抑制等,怀孕母牛感染BVDV后,可引起死胎、流产,胚胎畸形或分娩出表面看似正常的持续感染的犊牛[1-2]。目前BVDV的检测方法主要有RT-LAMP,RT-PCR,实时荧光定量PCR等[3-4]。这些方法虽然快速,但只有BVDV牛呈急性腹泻时才可以从排泄物中直接检测到病毒粒子。然而大多数牛感染BVDV是呈持续性感染,不表现临床症状,这些持续感染的犊牛一旦再次接触BVDV相似性抗原就会继发为黏膜病,表现为急性脱水性腹泻,病死率可高达100%,即使不成为黏膜病也终身带毒,持续排毒,是养牛业潜在的危害,可造成重大的经济损失。只有检测BVDV抗体才能真正确诊BVDV持续感染的牛。该病的防控主要依靠检测出这些持续性感染的牛并淘汰,逐步净化牛群[5-6]。由于BVDV仅有一种血清型,因此本研究利用原核表达系统体外表达NS3基因,目的是获得有免疫活性的BVDV NS3囊膜蛋白,制备出具有良好反应原性的抗原,为BVDV野毒感染检测试剂盒的研发奠定基础。
1 材料与方法
1.1 材料
BVDV分离株Oregon CV24冻干毒及标准BVDV阳性血清均购于中国兽药监察所;MDBK 细胞购自武汉中国典型培养物保藏中心;Pet-32a原核表达载体购自Novagen公司,限制性内切酶SalⅠ和NotⅠ、PMD-18T 克隆载体、DNA Marker、T4连接酶购自TaKaRa公司;NC膜购自Invitrogen公司;质粒小量提取试剂盒、反转录试剂盒、凝胶回收试剂盒,反转录试剂盒购自TransGen公司;兔抗牛IgG/辣根酶(HRP)标记购自KPL 公司;蛋白纯化试剂盒购自北京康为公司。
1.2 方法
1.2.1 病毒RNA的提取Oregon CV24毒株参照文献在MDBK细胞上增殖,48h收获病毒,反复冻融3次后,离心取上清,参照Invitrogen公司Trizol说明书抽提病毒RNA,用TransGen公司的cDNA Synthesis SuperMix 进行反转录,置-20℃备用。
1.2.2 引物设计和PCR 扩增 根据GenBank 中的Oregon CV24基因序列(Genbank登录号:0911605.1),利用Primer 5.0软件设计一对特异性引物,扩增NS3基因,扩增的目的片段为1 206bp,引物均由Invitrogen公司合成,下划线部分分别为SalⅠ和NotⅠ酶切位点。NS3 上:5′-GTCGACTTACCAGTATGAACAGGGGAG -3′,NS3 下:5′-GCGGCCGCTGTTGTATGCAAGTTGGATTG-3′。
1.2.3 表达载体的构建 用胶回收试剂盒纯化PCR 产物,连接入PMD-18T 克隆载体,转化入大肠埃希菌DH5α,用PCR 筛选阳性克隆,构建PMD-18T-NS3。抽提PMD-18T-NS3质粒和Pet-32a质粒,两种质粒同时用SalⅠ和NotⅠ双酶切后,把NS3片段与酶切后的pET-32a载体用TaKaRa T4连接酶进行连接,转化大肠埃希菌Transetta(DE3),置37℃培养过夜。次日,挑取单菌落,经PCR鉴定,阳性菌送上海Invitrogen公司测序。将构建的重组质粒pET-32a-NS3,用限制性内切酶SalⅠ和NotⅠ进行双酶切。
1.2.4 重组蛋白的可溶性鉴定 将测序正确的阳性菌液以1∶100的比例接种于50 mL LB+AMP的培养液中,37℃摇床培养至OD600nm 值为0.55~0.65 时,向重组菌中加入IPTG 至终浓度为1 mmol/L进行诱导表达,30℃继续培养8h后收集菌液,10 000r/min离心15min,弃上清,用5mL PBS重悬菌体沉淀,加入溶菌酶(终浓度为100μg/mL),混匀后,置37℃和-70℃之间反复冻融3次,冰浴进行超声波裂解,破碎菌体直至菌液呈清亮,10 000 r/min离心10 min,分别取上清与沉淀进行SDSPAGE电泳,以确定重组蛋白表达产物的表达方式,如果主要的表达产物在上清,则该蛋白为可溶性表达,如果主要的表达产物在沉淀,则该蛋白为包涵体表达。
1.2.5 重组蛋白的纯化 参照康为公司Ni-Agarose His标签蛋白纯化试剂盒(包涵体蛋白)说明书进行纯化。将洗脱蛋白装入已处理过的透析袋里,并把透析袋置于复性缓冲液(1×PBS,1 mmol/L EDTA,尿素,pH 8.0)中,于4℃逐步透析复性,复性缓冲液中尿素浓度不断下降,依次顺序为4.5、3.5、2.5、1.5、0.5、0mol/L,换液间隔时间为10h~12h。透析结束后,收集蛋白进行SDS-PAGE 电泳,确定复性和纯化的效果。
1.2.6 Western blot检测 纯化好的NS3蛋白经SDS-PAGE电泳分离后,用上海Invitrogen 公 司Western blot干转仪,将蛋白条带转到硝酸纤维素膜(NC膜)上,同时设空菌体对照。NC膜用50g/L脱脂奶37℃封闭1h~2h,用PBST洗涤3次;加入1∶100稀释的BVDV 标准阳性血清,37℃孵育1h后,再用PBST洗涤3次;加入1∶1000稀释的辣根过氧化物酶标记羊抗牛IgG,37℃孵育1h,PBST 洗膜3次;最后用DAB显色,观察结果。
2 结果
2.1 重组质粒pET-32a-NS3的鉴定
将构建好的pET-32a-NS3表达载体用PCR鉴定,NS3片段已成功插入载体中(图1)。双酶切鉴定重组质粒,可成功地从pET-32a-NS3中切出NS3片段,大小为1 206bp,空载体pET-32a未切出条带(图2)。重组质粒测序结果显示,NS3 主要抗原区已成功插入pET-32a 载体中,与GenBanK 中的BVDV 核苷酸同源性为91%~100%,氨基酸同源性在94%以上。
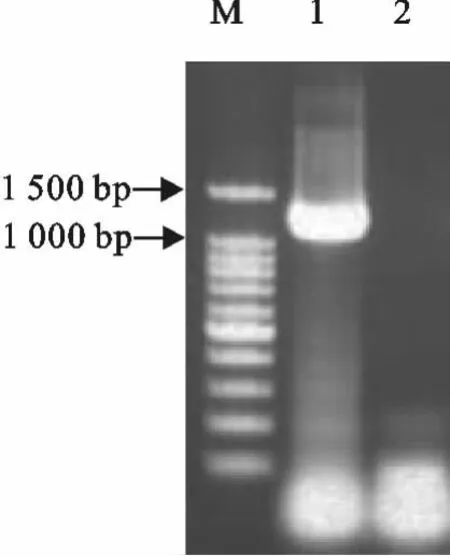
图1 PCR鉴定结果Fig.1 The results of PCR identification

图2 Pet-32a-NS3重组质粒双酶切鉴定Fig.2 Identification of recombinant plasmid Pet-32a-NS3by double enzyme digestion
2.2 重组蛋白的可溶性鉴定
经IPTG 诱导后,重组NS3蛋白得到较好表达,超声波破裂细菌后取上清和沉淀分别进行SDSPAGE,NS3的表达产物主要在沉淀部分,即为包涵体表达形式(图3)。
2.3 重组蛋白纯化结果
经试剂盒纯化后,得到较高浓度与纯度的NS3蛋白。经OD260nm 和OD280nm 检测分析,NS3的浓度分别为2.08mg/mL。通过SDS-PAGE检测重NS3组蛋白的纯度,结果显示,纯化的效果较好,均可得到单一的目的条带,无杂带(图3)。
2.4 Western blot结果
用BVDV 阳性血清进行Western blot检测,结果显示,NC膜上重组NS3蛋白出现清晰的特异性印迹条带,而空菌体对照无特异性条带,表明重组NS3蛋白反应活性较好(图4)。
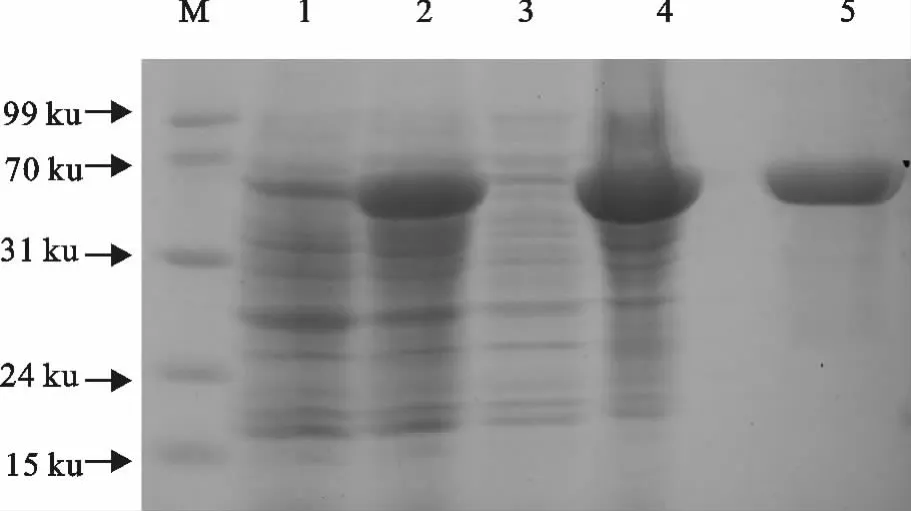
图3 NS3在大肠埃希菌中表达产物的SDS-PAGE检测Fig.3 SDS-PAGE of NS3expression products in E.coli

图4 NS3重组蛋白的Western blot检测结果Fig.4 Western blot detection results of NS3recombinant proteins
3 讨论
据报道BVDV 在我国广泛存在,安徽、江苏、广西省(区)BVDV 感染率为分别为34.2%、8.4%和10%[7]。大部分情况下BVDV 以持续性感染而不发病的形式存在于牛体内,持续排毒成为潜在的感染源。由于BVDV 发病机理及临床特征的复杂性,只有当BVDV 牛呈急性腹泻时才可以从排泄物中直接检测到病毒粒子,因此用RT-PCR、RT-LAMP等一系抗原检测技术容易漏检。BDVD 抗体的检测才能对持续性感染的牛进行确诊,真正监测畜群BVDV 的感染状况。选择NS3 蛋白表达的理由如下:①NS3具有较高的免疫原性,是一种免疫优势蛋白,在病毒感染过程中,免疫系统的CD4+T 细胞主要识别NS3 和E2 两种蛋白,并可诱导免疫细胞产生针对该蛋白的抗体[8]。②核苷酸序列分析表明,NS3编码区不仅在BVDV 各毒株间都较保守,且在不同基因型(BVDV-1和BVDV-2)和生物型(细胞病变型和非细胞病变型)中也是非常保守的[11]。③目前国际上对该病的控制主要依赖BVDV 灭活疫苗,NS3是BVDV 的非结构蛋白,当灭活疫苗刺激机体时,主要产生的针对结构蛋白的抗体,因此对NS3抗体的测定,将有助于区分疫苗免疫和野毒感染[9-11]。利用原核表达系统在体外表达蛋白,可获得高纯度的蛋白,用于ELISA 诊断抗原不仅制备方便,安全,而且特异性好,在动物疫病的诊断上得到广泛应用[12-14]。
本研究制备的BVDV NS3蛋白能与BVDV 阳性血清发生特异性反应且浓度高,适合于下一步大量的制备,为建立BVDV ELISA 检测试剂盒奠定基础,用于区分疫苗免疫和野毒感染。
[1]Givens M D,Marley M S.Immunology of chronic BVDV infections[J].Biologicals,2013,41:26-30.
[2]殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997:645-652.
[3]范 晴,谢芝勋,刘加波,等.牛病毒性腹泻RT-LAMP检测方法的建立[J].生物技术通讯,2010,21(2):248-251.
[4]Youssef B Z.Comparative study between ELISA,immuno-diffusion and cell bound immunoassay techniques for detection of anti-bovine viral diarrhea antibodies in calves of some farms in Alexandria and Behira governorates[J].J Egypt Public Health Assoc,2006,81(1-2):29-41.
[5]Fux R,Wolf G.Transient elimination of circulating bovine viral diarrhoea virus by colostral antibodies in persistently infected calves:apitfall for BVDV-eradication programs[J].Vet Microbiol,2012,161:13-19.
[6]Gates M C,Woolhouse M E,Gunn G J,et al.Relative associations of cattle movements,local spread,and biosecurity with bovine viral diarrhoea virus(BVDV)seropositivity in beef and dairy herds[J].Prev Vet Med,2013,112(3-4):285-295.
[7]邱昌庆,郭慧琛,程淑敏,等.安徽、江苏、广西部分地区水牛牛病毒性腹泻/黏膜病血清学监测[J].中国预防兽医学报,2000,22(6):453-454.
[8]Kuijk H,Franken P,Mars M H,et al.Monitoring of BVDV in a vaccinated herd by testing milk for antibodies to NS3protein[J].Vet Rec,2008,163:482-484.
[9]Rypula K,Ploneczka J K,Bania J,et al.Reduction of prevalence of persistent BVDV infection in cattle herds by long-term vaccination program(preliminary clinical study)[J].Pol J Vet Sci,2013,16:381-383.
[10]Makoschey B,Sonnemans D,Bielsa J M,et al.Evaluation of the induction of NS3specific BVDV antibodies using a commercial inactivated BVDV vaccine in immunization and challenge trials[J].Vaccine,2007,25:6140-6145.
[11]Young N J,Thomas C J,Thompson I,et al.Immune re-sponses to non-structural protein 3(NS3)of bovine viral diarrhoea virus(BVDV)in NS3DNA vaccinated and naturally infected cattle[J].Prev Vet Med,2005,72:115-120.
[12]邓显文,谢芝勋,刘加波,等.肠炎沙门菌fliC 蛋白的表达及ELISA 检测方法的建立[J].动物医学进展,2013,34(6):21-25.
[13]罗思思,谢芝勋,邓显文,等.Ⅰ群禽腺病毒抗体间接hexon-ELISA 检测方法的建立[J].中国兽医科学,2012,42(7):701-707.
[14]Zhixun X,Chunxiang Q,Liji X,et al.Recombinant proteinbased ELISA for detection and differentiation of antibodies against avian reovirus in vaccinated and non-vaccinated chickens[J].J Virol Meth,2010,165:108-111.

