小熊猫IL-17的克隆及原核表达
赵玄多,徐素慧,杨雯昱,高 洋,修云芳,陈玉村,陈德坤*
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.海峡(福州)大熊猫研究交流中心,福建福州350001)
白介素17(IL-17)最早是由Rouvier E 等[1]从鼠活化的T 细胞克隆出的细胞因子,起初被命名为CTLA-8,2年后研究揭示其受体是一种新的细胞因子受体IL-17R,故而CTLA-8被重新命名为IL-17。Lubberts E等[2]的研究结果提示,IL-17可能是一种在免疫反应中发挥重要作用的细胞因子。近年来的大量研究资料显示,IL-17不仅在机体自身免疫疾病中发挥着关键的炎症介导者的作用,通过其介导的炎症反应对机体自身正常组织细胞造成严重的免疫病理损伤,而且该细胞因子也在机体抗病原微生物感染中起着集中地作用,通过其介导的炎性作用募集大量的免疫细胞至炎性部位清除病原微生物[3-6]。
IL-17在机体免疫反应的作用已被许多医学研究人员所关注,其在动物免疫性疾病及抗感染中的作用研究已经有文献报道[7],牛、山羊、大熊猫、鸡和鸭等许多物种的IL-17均被克隆,但小熊猫IL-17的研究未见报道。本研究通过小熊猫IL-17 基因克隆,对其保守序列和特异序列进行了分析,并获得了原核表达蛋白,为进一步探讨其在小熊猫炎症反应中的作用等奠定了基础。
1 材料与方法
1.1 材料
1.1.1 载体和细胞 原核表达载体PET-32a、BL21(DE3)均由西北农林科技大学动物医学院兽医免疫学实验室保存。
1.1.2 主要试剂 TaKaRa rTaqDNAploymerase、限制性内切酶BamH Ⅰ、Hind Ⅲ、T4DNA 连接酶、DNA MarkerⅠ、DNA 标准DL 5 000、RNA 提取试剂盒、AMV Reverse Transcriptase、高分子量蛋白质分子量标准,均购自宝生物工程(大连)有限公司;Blue PlusⅡProtein Marker,购自全式金生物技术有限公司;San Prep柱式DNA 胶回收试剂盒、San Prep柱式DNA 小量抽提试剂盒,购自上海生工生物工程技术服务有限公司。
1.2 方法
1.2.1 cDNA 的合成 采健康小熊猫抗凝血5 mL,用完全1640培养基培养分离到的淋巴细胞,经20μg/mL conA 刺激培养淋巴细胞24h 后,用RNA 提取试剂盒提取淋巴细胞总RNA,并依据说明书AMV Reverse Transcriptase操作反转录合成cDNA。
1.2.2 小熊猫IL-17基因CDS区的克隆依据NCBI 公布的大熊猫IL-17(序列号为:XM-002915419.1)CDS 区序列在primer 5.0 上设计引物如下,F:5′-ATGGCTCCTGTGACAACTT-3′,R:5′-AACACGCGGTACACCGAATT -3′。引 物在南京金斯瑞生物科技公司合成。用r-TaqDNA ploymerase进行扩增,扩增体系为10×PCR buffer 2.5μL,dNTP Mixture(2.5 mmol/L)2μL,rTaqDNA ploymerase 0.25μL,上、下游引物各0.5μL,cDNA 模板1μL,灭菌蒸馏水16.25μL,氯化镁2 μL,总体积25μL。PCR反应条件为:95℃5min;94 ℃50s,53 ℃35s,72 ℃50s,30个循环;72 ℃10min,4 ℃结束反应。预计片段大小为462bp。取全部PCR 产物于10g/L 琼脂凝胶电泳,然后按照DNA 胶回收试剂盒说明书回收PCR 产物,送南京金斯瑞生物科技公司测序。
1.2.3 重组载体的构建与鉴定 依据测序所得的小熊猫IL-17序列(序列号为:KJ461927),用Singal 4.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽,以去掉信号肽的序列为模板设计引物为F:5′-CGCGGATCCGGAATAGCATTTCCACAAAAT -3′(引入BamHⅠ酶切位点),R:5′-CCCAAGCTTTTAAGCCACATGGCGCACAAT-3′(引 入Hind Ⅲ酶 切位点),引物在南京金斯瑞生物科技公司合成。用r-TaqDNAploymerase进行扩增,扩增体系为10×PCR buffer 2.5μL,dNTP Mixture(2.5mmol/L)2μL,r-TaqDNA ploymerase 0.25μL,上、下游引物各0.5 μL,“1.2.2”中PCR回收产物1μL,灭菌蒸馏水16.25 μL,氯化镁2μL,总体积25μL。PCR反应条件为:95℃5min;94℃50s,54 ℃45s,72℃1min,30个循环;72℃10 min,4 ℃结束反应。预计片段大小为393bp。取全部PCR 产物于10g/L琼脂凝胶电泳,然后按照DNA 胶回收试剂盒说明书回收PCR 产物。将胶回收产物和pET-32a用BamH Ⅰ和HindⅢ双酶切,连接,转化至BL-21(DE3)感受态细胞中,从LB/Amp+平板中挑取单克隆,经质粒PCR和双酶切鉴定的阳性菌株测序。
1.2.4 基因诱导表达和蛋白纯化 将表达菌在不同的IPTG 浓度、温度、时间下诱导,取一定量的菌液经12 000r/min离心2min后,用PBS洗涤3次,用1/10体积的PBS 溶解,在冰上超声破碎菌液至澄清(40 W,每次 超声2 min,间隔2s),12 000 r/min离心2min后取上清并用等体积的PBS溶解沉淀,SDS-PAGE观察表达效果,确定IL-17的最佳表达条件。根据最佳表达条件大量诱导菌液,并用镍柱法进行蛋白纯化。
1.2.5 IL-17基因分析 在NCBI上查找其他物种的IL-17基因序列,并用MEGA5.0构建进化树,分析IL-17在进化上与其他物种的亲缘关系。在CBS上分析(http://www.cbs.dtu.dk/services/NetNG-lyc/)N-Gly位点。用Clustal W 比对氨基酸序列与小熊猫IL-17序列的相似性。相关物种的基因序列号如下:牛(NM-001008412.2),鸡(AY744450.1),狗(NM-001165878.1),大熊猫(XM-002915419.1),山羊(NM-001285725.1),豚鼠(JQ315117.1),鼠(U43088.1),马(NM-001143792.1),人(U32659.1),海象(XM-004415641.1),猪(FJ196861.1),狨猴(EF534212)。
2 结 果
2.1 小熊猫IL-17基因的克隆
取cDNA PCR 产物于10g/L 的琼脂凝胶电泳检测,可以观察到一条约500bp的片段,与预测结果相符(图1)。

图1 PCR 扩增IL-17基因Fig.1 PCR amplification of IL-17
2.2 原核重组质粒鉴定
将筛选出的菌落经质粒双酶切和PCR鉴定,均获得了预期的目的条带,表明目的基因已经插入到载体中,成功构建了重组质粒(图2和图3)。

图2 pET32a-IL-17 重组质粒双酶切鉴定Fig.2 Identification of recombinant plasmid pET32a-IL-17 by double enzyme digestion
2.3 重组质粒的诱导表达和蛋白纯化
图3 pET32a-IL-17重组质粒PCR鉴定Fig.3 PCR identification of recombinant plasmid pET32a-IL-17
分别以0.2、0.5、0.7mmol/L 的IPTG 浓度,分别在37℃、35℃、30℃、25℃、20℃、16℃下进行小熊猫IL-17的诱导表达。不同时间段取样进行SDS-PAGE 检测,结果显示,上清中最优表达条为25 ℃、0.5mmol/L IPTG 诱导20h,表达产物在电泳图谱上约为32.2ku。经镍柱法纯化表达产物(图4、图5)。

图4 重组pET32a-IL-17-BL-21上清最适条件下的SDS-PAGE电泳结果Fig.4 SDS-PAGE analysis of supernatants in the best expression of recombinant pET32a-IL-17-BL-21

图5 IL-17 纯化的SDS-PAGE结果Fig.5 SDS-PAGE analysis of purified IL-17protein
2.4 小熊猫IL-17的序列及基因进化分析
用MEGA.5.0分析并建立进化树(图6),发现在进化关系上小熊猫IL-17与大熊猫IL-17最为接近,而与鸡IL-17最为疏远;相似性比较,发现与大熊猫IL-17相似度达到了93.7%,而与鸡IL-17相似性仅为50%(图7)。利用CBS预测器预测N-G和磷酸化位点,发现具有6个保守的半胱氨酸残基和CXC趋化因子结合位点,在NRST 序列的N 上具有糖基化现象(图8)。以上结果表明小熊猫IL-17具有IL-17分子的特异性结构和化学基团修饰,同时与种属相近的物种保持较高的序列相似性。
3 讨 论
作为珍稀野生动物,小熊猫的人工饲养技术并不像大熊猫那样成熟和完善,许多动物园的小熊猫在引进后会因应激导致免疫力下降而死亡一部分,剩余的小熊猫在饲养过程中因感染而陆续发病死亡[8-9]。剖检发现,死亡小熊猫多种脏器呈较为严重的炎性反应特征,这一现象较为普遍[9-11],但其病理学分子机制至今不清楚。IL-17分子的最新研究结果表明,IL-17是众多炎症反应的关键介导者,无论是抗感染免疫炎症反应还是自身免疫病炎症反应,都离不开IL-17的介导[12-13]。适当地调控炎症反应强度不仅有利于机体迅速清除体内的病原微生物,也能减小因炎症反应过强而引起的对自身细胞组织的损伤。与目前临床使用的多种免疫调节药物相比,IL-17分子将有可能成为解决这一问题的突破口。本研究所获得的小熊猫IL-17重组蛋白,将为下一步制备IL-17抗体、人工调控小熊猫免疫反应强度、检测小熊猫体内的免疫炎症反应强度提供新的手段和方法。本研究克隆得到的小熊猫IL-17基
因CDS区由462bp组成,编码的多肽含23个氨基酸组成的信号肽,成熟的IL-17蛋白由130个氨基酸组成。经过对小熊猫IL-17氨基酸分子序列分析发现,它具有6个保守的半胱氨酸残基和和两个保守序列,其中一个含有CXC序列,在NRST 的N 上具有糖基化,在进化关系上与大熊猫最为相近。说明小熊猫IL-17分子的空间构型和生物学活性与其他动物IL-17的基本相似。但是在对于其他物种在84位点保守的脯氨酸(P)和在115位点保守的谷氨酰胺(Q),在小熊猫氨基酸却替换为T 苏氨酸和R精氨酸。通过变换各种试验条件,找出一组最佳的诱导表达条件,在该条件下诱导重组菌可获得小熊猫IL-17的可溶性表达产物。表达产物经镍柱纯化后,SDS-PAGE 显示其分子质量约32ku。上述研究结果为进一步制备相应抗体、研制小熊猫IL-17免疫检测试剂盒、研究小熊猫IL-17原核表达产物免疫活性及其临床应用等工作打下了坚实的基础。
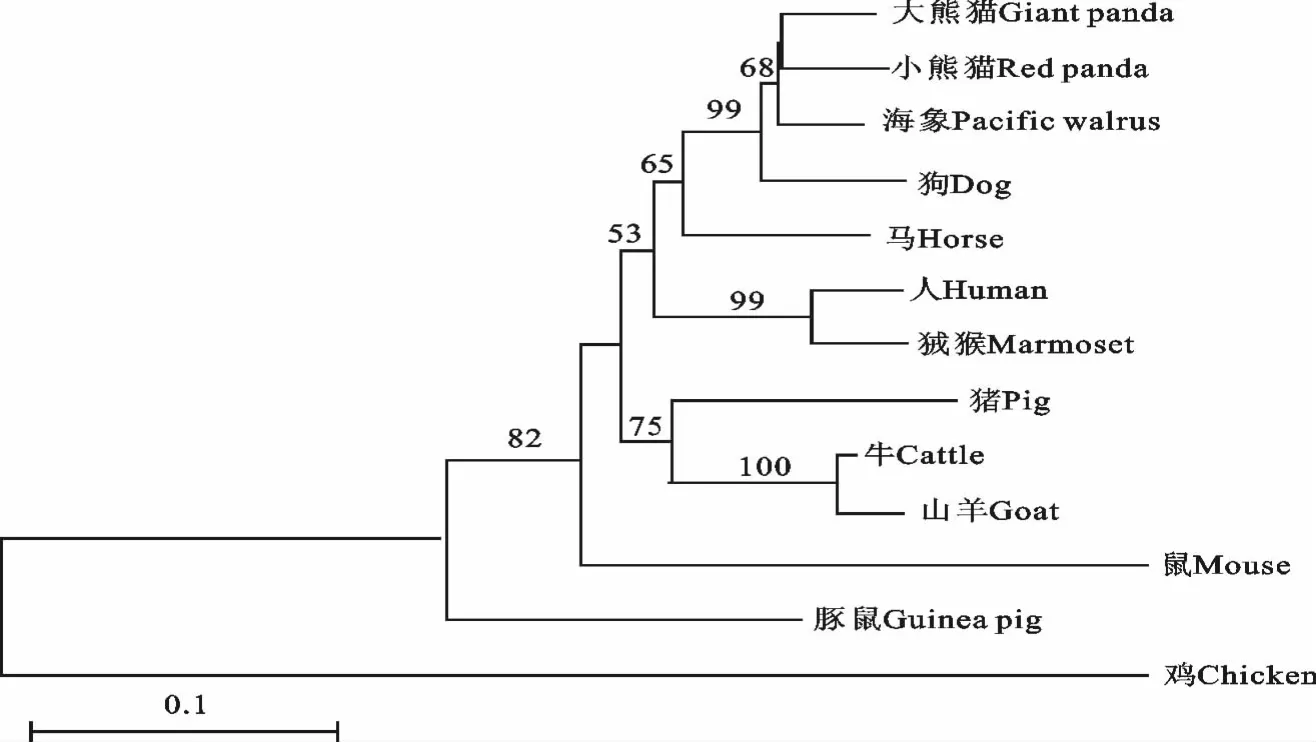
图6 小熊猫IL-17基因进化树Fig.6 Phylogenetic tree of Red panda IL-17gene

图7 小熊猫IL-17基因核苷酸序列同源性分析Fig.7 Homology analysis of IL-17gene nucleotide of Red panda

图8 小熊猫IL-17氨基酸序列分析结果Fig.8 Analysis of IL-17amino acid sequence of Red panda
[1]Rouvier E,Luciani M,Mattei M,et al.CTLA-8,cloned from an activated T cell,bearing AU-rich messenger RNA instability sequences,and homologous to a herpesvirus saimiri gene[J].J Immunol,1993,150:5445-5456.
[2]Lubberts E,Joosten L A,Oppers B,et al.IL-1-independent role of IL-17in synovial inflammation and joint destruction during collagen-induced arthritis[J].J Immunol,2001,167:1004-1013.
[3]Ouyang W,Kolls J K,Zheng Y.The biological functions of T helper 17cell effector cytokines in inflammation[J].Immunity,2008,28:454-467.
[4]Puel A,Cypowyj S,Bustamante J,et al.Chronic mucocutaneous candidiasis in humans with inborn errors of interleukin-17immunity[J].Science,2011,332:65-68.
[5]Wareham A S,Tree J A,Marsh P D,et al.Evidence for a role for interleukin-17,th17cells and iron homeostasis in protective immunity against tuberculosis in cynomolgus macaques[J].PloS One,2014,9:e88149.
[6]Arranz-Valsero I,Schulze U,Contreras-Ruiz L,et al.Involvement of corneal epithelial cells in the Th17response in anin vitrobacterial inflammation model[J].Mol Vision,2013,19:85.
[7]郑玉姝,赵 朴,赵宏坤,等.鸟类,哺乳类及水生动物促炎性白细胞介素的比较[J].动物医学进展,2006(6),27:29-33.
[8]熊 焰,谢幼新.小熊猫犬瘟热病及病原研究[J].四川动物,2000,19(5):13-15.
[9]余星明,王成东,钟顺隆,等.小熊猫绿脓杆菌病的诊断[J].中国兽医科技,2000,30(8):36-37.
[10]何洪彬,夏咸柱.小熊猫犬瘟热病毒感染的诊断[J].中国兽医学报,2000,20(5):447-449.
[11]李呈军,范 欢.小熊猫巴氏杆菌病的诊治[J].中国预防兽医学报,2001,23(1):69-70.
[12]滕素玲,郑世民.Th17细胞及其分化调控机制研究进展[J].动物医学进展,2010,31(9):89-93.
[13]Zúoiga L A,Jain R,Haines C,et al.Th17cell development:from the cradle to the grave[J].Immunol Rev,2013,252:78-88.

