新城疫病毒La Sota株NP、P和L基因表达载体的构建及真核表达
呙会会,刘 垒,周祖涛,李筱雯,金 卉,肖运才*,王贵强
(1.华中农业大学动物医学院,湖北武汉430070;2.湖北省畜禽育种中心,湖北武汉430070)
新城疫(Newcastle disease,ND)被世界动物卫生组织(OIE)列为必须报告的动物疫病,一直以来对养禽业造成的损失十分巨大[1]。从20世纪中叶开始,用新城疫疫苗预防免疫取得了较大的成就[2]。目前以新城疫病毒(NDV)作为疫苗载体正被广泛研究,主要用于动物多价疫苗和人类肿瘤治疗的开发[3-4]。
NDV 是单股负链RNA 病毒,属于副黏病毒科(Paramyxovirinae)、禽腮腺炎病毒属(Avulavirus)。NDV 基因组长约为15 186bp,符合“6碱基原则”[5]。新城疫病毒基因组RNA 共有6个基因,即NP、P、M、F、HN 和L 基因。NP 为核衣壳蛋白;P为磷酸化的核衣壳蛋白;M 为囊膜蛋白;F 为融合蛋白;HN 蛋白具有血凝素和神经氨酸酶活性,介导病毒与细胞的附着;L 蛋白为具有RNA 依赖RNA 聚合酶活性的大分子蛋白。其中NP、P 和L为内部蛋白,三者缺一不可。核衣壳蛋白NP 与病毒的基因组RNA 包装成感染性的核糖核蛋白复合体(RNP),磷蛋白P和大分子蛋白L 形成大聚合酶蛋白,辅助RNP的活性,进行NDV 的转录、翻译和复制[6]。
因此,本研究将NDV 的3个必需的辅助蛋白基因NP、P和L基因克隆到真核表达载体并对其转染细胞进行瞬时表达鉴定。
1 材料与方法
1.1 材料
1.1.1 病毒株与细胞株 新城疫病毒La Sota弱毒株,BHK-21细胞均为本实验保存。
1.1.2 菌株和质粒E.coliDH5α感受态细胞购自北京全式金生物技术有限公司;T 载体psimple-18EcoR V/BAP vector购自宝生物工程(大连)有限公司;真核表达载体pCl-neo Vector购自Promega公司。
1.1.3 试剂 限制性内切酶XhoⅠ、XbaⅠ、SalⅠ、SmalⅠ、NotⅠ、pyrobestTaqPCR 酶、dNTP、primescirpt反转录酶、T4DNA 连接酶等购自宝生物工程(大连)有限公司;质粒小量提取试剂盒购自北京全式金生物技术有限公司;DNA 琼脂糖凝胶回收试剂盒等购自Qiagen 公司;Trizol购自Invitrogen公司;DNA Marker购自广州东盛生物科技有限公司;FuGENE6转染试剂盒购自Roche公司;免疫染色固定液购自碧云天生物技术有限公司;二抗购自北京博奥森生物技术有限公司;其他试剂由本实验室提供。
1.2 方法
1.2.1 病毒增殖及病毒RNA提取 将NDV 尿囊腔接种9日龄~11日龄的鸡胚,每胚0.2mL,37℃孵育7d,收集尿囊液。Trizol法提取其总RNA。
1.2.2 PCR引物设计与合成 根据在GenBank已登陆的新城疫病毒La Sota株基因序列设计下列4对引物,分别扩增NP、P和L基因(表1)。
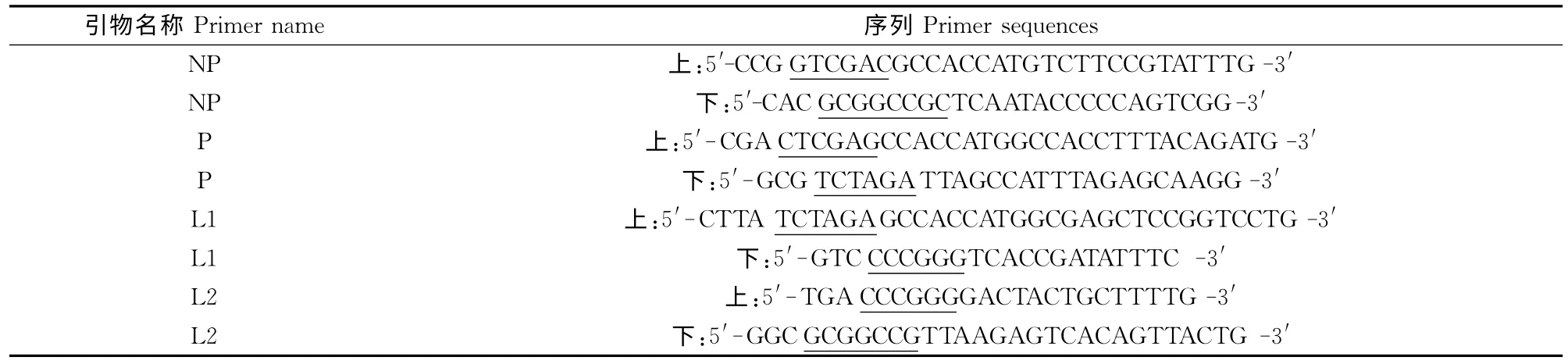
表1 辅助质粒构建所用引物Table 1 Primers used for construction of helper plasmids
所有引物5′端均设计有酶切位点(下划线)和保护碱基,并在上游引物的酶切位点后添加kozak序列GCCACC[7]。引物由南京金斯瑞生物技术有限公司合成。
1.2.3 RT-PCR扩增目的片段 逆转录合成cDNA反应条件为42 ℃1h,72 ℃15min。NP、P、L1、L2目的基因PCR反应的条件,除延伸的时间不同(每1 min/kb),其他均相同。即NP扩增条件:95 ℃5min;94℃30s,54.4 ℃30s,72 ℃2min,20个循环;72℃10min。
1.2.4 NP,P和L克隆 用DNA 凝胶回收试剂盒回收PCR 产物后与psimple-18EcoR V/BAP vector 16℃连接8h以上或过夜。连接产物转化大肠埃希菌DH5α,37℃培养过夜,挑菌落到4mL LB培养基中,37℃摇床培养12h后,经PCR 方法和小提质粒酶切鉴定,鉴定阳性质粒,送上海生工生物工程技术服务有限公司测序验证。
亚克隆及鉴定:将克隆在T载的NP目的基因和真核表达载体pCl-neo分别用SalⅠ,NotⅠ进行双酶切后回收纯化,将两者连接转化,挑菌,用PCR 和酶切鉴定,阳性克隆命名为pCl-NP。同理,将克隆在T载的P目的基因和真核表达载体pCl-neo分别用XhoⅠ、XbaⅠ进行双酶切后回收纯化,将两者连接转化,挑菌,用PCR和酶切鉴定,阳性克隆命名为pCl-P。将pClneo、L2目的片段用SmalⅠ、NotⅠ双酶切,回收连接转化,挑选阳性菌,提质粒,命名为pCl-L2。继而PCR L1,回收,再用SalⅠ、SmalⅠ双酶切,用相同的双酶切pCl-L2,回收连接转化,挑选阳性菌,提质粒,命名为pCl-L。
1.2.5 NP、P和L分别在BHK-21细胞中的瞬时表达 分别将质粒pCl-NP、pCl-P、pCl-L的转染液(100 μL opti-MEM+5μL 转染试剂+2μg 质粒)转染BHK-21细胞,并用不含有外来DNA 片段的空质粒pCl-neo转染细胞作为阴性对照。
1.2.5.1 RT-PCR检测NP、P、L和空载体在BHK-21细胞中的表达 转染72h 后裂解细胞,参考RNeasy Mini Kit操作说明,分别从细胞中提取总RNA,RT-PCR检测各目的基因表达。
1.2.5.2 Western blot检测蛋白的表达 转染72h后裂解细胞,加入2×loading buffer后煮沸10min。SDS-PAGE电泳后电转到硝酸纤维素膜上,5g/L BSA 4℃封闭过夜,洗涤后加入1∶100的NDV 阳性血清室温摇摆孵育2.5h,洗涤后用1∶2 000HRP标记的羊抗鸡IgG 二抗摇摆孵育1h,洗涤后DAB显色。
1.2.5.3 间接免疫荧光检测蛋白的表达 将转染56 h后的细胞,PBS洗3遍,用免疫染色固定液固定细胞,用PBS洗涤3次,每次5min。加入10g/L BSA室温摇床封闭60min,PBS洗涤3次,每次10min。加入1∶20的NDV 阳性血清4 ℃过夜,洗涤后用1∶200FITC标记的羊抗鸡荧光二抗摇摆孵育1h,洗涤后用荧光显微镜观察结果。
2 结果
2.1 PCR的扩增和重组质粒的构建与鉴定
Trizol法提取新城疫病毒鸡胚尿囊液的总RNA,进行RT-PCR反应,扩增产物经琼脂糖凝胶上电泳,在约1.5、1.2、3.0、4.0kb左右的位置各有一条电泳带,表明已分别成功扩增出NP、P和L1、L2基因。
PCR 产物回收纯化后,与psimple-18EcoR V/BAP vector连接克隆,测序。将连于T载阳性重组质粒分别双酶切,电泳分离目的基因,切胶回收纯化,然后将目的基因分别与pCl-neo真核表达载体连接,转化,挑菌培养,提取质粒酶切、质粒PCR。结果表明,3种目的基因均成功亚克隆到真核表达载体pCl-neo上(图1~图3)。
2.2 RT-PCR检测NP、P和L在细胞中的表达
裂解瞬时转染后的细胞,pCl-NP、pCl-P、pCl-L分别提RNA,用DnaseI消化。RT-PCR,分别扩增出pCl-NP、pCl-P、pCl-L目的片段。由于pCl-L 目的片段的全长为6 614bp,RT-PCR扩增出如此长片段有一定的难度。根据pCl-L全长设计引物,扩增pCl-L中部分序列,大小为750bp的片段。故pCl-L的RTPCR验证方法为扩增pCl-L中一段大小为750bp的片段(图4~图6)。

图1 重组质粒pCl-NP酶切鉴定Fig.1 Identification of recombinant plasmid pCl-NP by restriction enzyme digestion
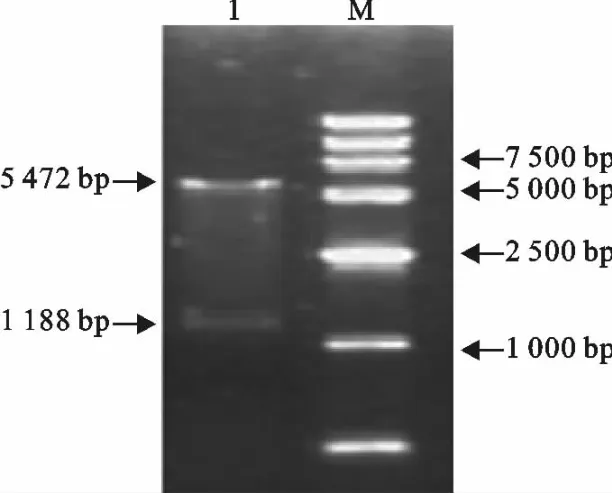
图2 重组质粒pCl-P酶切鉴定Fig.2 Identification of recombinant plasmid pCl-P by restriction enzyme digestion

图3 重组质粒pCl-L酶切鉴定Fig.3 Identification of recombinant plasmid pCl-P by restriction enzyme digestion

图4 RT-PCR检测NP基因在BHK-21细胞中的表达Fig.4 RT-PCR detection of the expression of NP gene in BHK-21cells

图5 RT-PCR检测P基因在BHK-21细胞中的表达Fig.5 RT-PCR detection of the expression of P gene in BHK-21cells

图6 RT-PCR检测L基因在BHK-21细胞中的表达Fig.6 RT-PCR detection of the expression of L gene in BHK-21cells
2.3 Western blot检测NP、P、L在细胞中的表达
Western blot检测NP、P、L在两种细胞中的表达:在pCl-NP、pCl-P,pCl-L 转染的细胞中,分别可见大约54、44、250ku大小的特异性条带;由此可证明重组质粒pCl-NP、pCl-P、pCl-L 可在BHK-21细胞中有效表达(图7)。
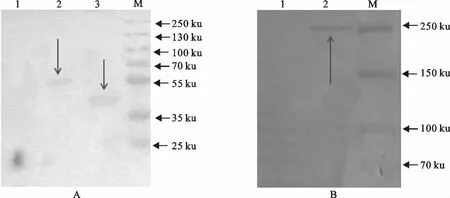
图7 Western blot检测NP、P、L在BHK-21中的表达Fig.7 Western blot analysis of expression of NP,P and L proteins in BHK-2lcells
2.4 间接免疫荧光检测NP、P、L在细胞中的表达
3个重组质粒转染后,NP、P 和L 基因均能够表达并且与新城疫阳性血清发生免疫发应,荧光显微镜下可以观察到黄绿色荧光(图8)。pCI-neo空载体转染BHK-21细胞,反应后未见荧光。单独的空细胞也未见荧光。
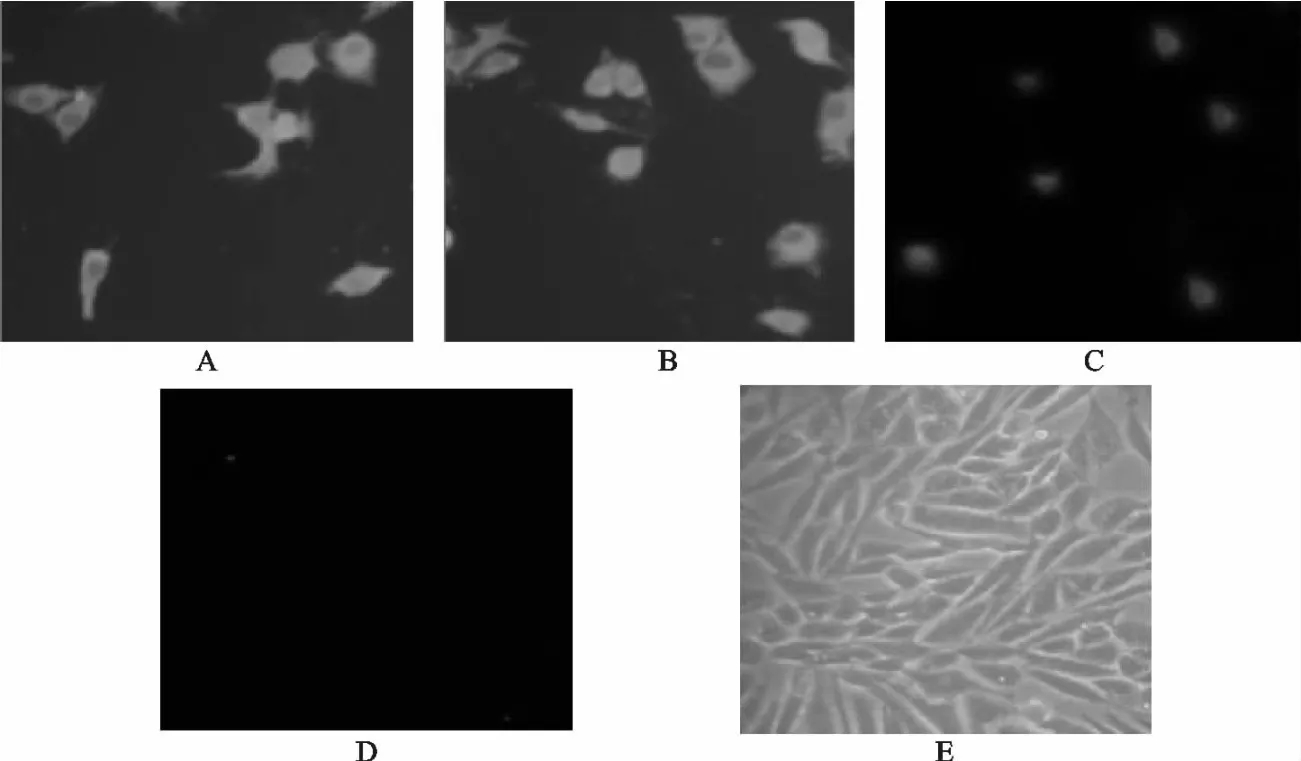
图8 间接免疫荧光检测NP、P、L在BHK-21中的表达Fig.8 Indirect immunofluorescence analysis of expression of NP,P and L proteins in BHK-2lcells
3 讨 论
反向遗传操作技术是近年分子病毒学研究领域中倍受瞩目的一门新型技术,是在体外通过构建RNA 病毒的感染性分子克隆[8]。将病毒基因组RNA 逆转录成cDNA,在DNA 分子水平上对其进行突变、缺失和外源基因插入等各种体外人工修饰和改造,由病毒基因组cDNA 和各种辅助蛋白来组装新的RNA 病毒的一项研究技术,也叫全长感染性cDNA 克隆技术,又常被称为“病毒拯救”[9]。
对新城疫病毒“拯救”的应用主要集中在两个方面:一是研究新城疫病毒的基因复制与表达调控机理[10],如新城疫病毒溶瘤特性的应用[11]。新城疫病毒的溶瘤特性使得新城疫病毒可作为癌症治疗的备选方案[12]。二是将新城疫病毒作为病毒载体构建新型的疫苗[13-14],以新城疫病毒为载体的狂犬病疫苗[15]和禽流感疫苗[16]已经取得了一定的成就。
本研究成功构建和鉴定了新城疫病毒NP、P、L 3种辅助质粒,是NDV 的反向遗传操作系统中不可或缺的。在设计目的基因引物时,5′端即起始密码子前引入Kozak序列GCCACC,以此来增强目的蛋白的表达。在扩增目的片段时,采用高保真DNA聚合酶扩增,将扩增循环次数减少,尽可能保证碱基不突变,测序的同源性达到99%,氨基酸序列同源性达到100%。检测重组质粒NP、P和L 采用转染细胞瞬时表达的方法。鉴定蛋白质表达转染选用的BHK-21细胞,此细胞适合多种病毒生长繁殖和拯救,为NDV 能在表达T7 RNA 聚合酶的细胞系BSR-T7细胞中进行拯救奠定物质基础。
重组新城疫病毒将为研究新城疫病毒的基因复制与表达调控机理和新城疫病毒作为病毒载体构建新城疫传染性支气管炎新型二联疫苗奠定了基础。
[1]殷 震,刘景华.动物病毒学[M].北京:科学出版社,1997:97.
[2]Gilad E.Newcastle disease vaccines[J].Elsevier,1998,16(2):343-366.
[3]Ramp K.Coexpression of avian influenza virus H5and N1by recombinant Newcastle disease virus and the impact on immune response in chickens[J].Avian Dis,2011,55(3):413-421.
[4]Wei D,Sun N,Nan G,et al.Construction of recombinant Newcastle disease virus Italian strain for oncolytic virotherapy of tumors[J].Human Gene Therapy,2012,14(2):700-710.
[5]Peeters B P H,Gruijt huijsen Y K,De Leeuw O S,et al.Genome replication of Newcastle disease virus:involvement of the rule-of-six[J].Arch Virol,2000,145:1829-1845.
[6]Grdzelishvili V Z,Smallwood S,Tower D,et al.A single amino acid change in the L-polymerase protein of vesicular sto-matitis virus completely abolishes viral mRNA cap methylation[J].J Virol,2005,79(12):7327-7337.
[7]Kozak M.At least six nucleotides preceding the AUG initiator codon enhance translation in mammalian cells[J].J Mol Biol,1987,196:947-950.
[8]戴灼华.遗传学[M].北京:高等教育出版社,2008:107.
[9]Takeshi K.An improved reverse genetics system for mammalian orthoreoviruses[J].Virology,2011,398:194-200.
[10]Mahon P J,Mirza A M.Role of the two sialic acid binding sites on the newcastle disease virus HN protein in triggering the interaction with the F protein required for the promotion of fusion[J].J Virol,2011,85(22):12079-12082.
[11]Mansour M.Oncolytic specificity of Newcastle disease virus is mediated by selectivity for apoptosis-resistant cells[J].J Virol,2011,85(12):6015-6023.
[12]Zamarin D.Oncolytic Newcastle disease virus for cancer therapy:old challenges and new directions[J].Future Med,2012,7(3):347-367.
[13]Yusibov V.Clinical development of plant-produced recombinant pharmaceuticals:vaccines,antibodies and beyond[J].Human Vaccines,2011,7(3):313-321.
[14]Sunil K.Newcastle disease virus expressing human immunodeficiency virus type 1envelope glycoprotein induces strong mucosal and serum antibody responses in guinea pigs[J].J Virol,2011,85:10529-10541.
[15]Ge J.Newcastle disease virus-vectored rabies vaccine is safe,highly immunogenic,and provides long-lasting protection in dogs and cats[J].J Virol,2011,85(16):8241-8252.
[16]Schroer D.Efficacy of newcastle disease virus recombinant expressing avian influenza virus H6 hemagglutinin against Newcastle disease and low pathogenic avian influenza in chickens and turkeys[J].Avian Dis,2011,55(2):201-211.

