美洲型和欧洲型PRRSV RT-PCR鉴别检测方法的建立
戴光文,谢丽华*,江精华,李 媚,梁 真,苏志毅,严 红
(1.梧州市动物疫病预防控制中心,广西梧州543002;2.梧州市动物卫生监督所,广西梧州543002)
猪繁殖与呼吸综合征(PRRS,又称猪蓝耳病)是由猪繁殖与呼吸综合征病毒(PRRSV)引起的一种急性传染病,以母猪繁殖障碍、仔猪高病死率、发热、蓝耳、呼吸困难为特征。该病于1987年首次在美国报道[1],此后世界各地均有发生。欧美先后分离到病原,分别被鉴定为欧洲型和美洲型两种基因型。我国在1996年首次分离到美洲型PRRSV[2],迄今国内以该型毒株流行为主。2006年在我国南方高热猪群中发现美洲型PRRSV NSP2基因发生缺失变异[3],形成具有高致病性的毒株,对养猪业危害巨大。当前我国猪群同时遭受美洲型PRRSV 高致病性毒株和经典毒株的侵害[4],两种毒株引起的猪群症状和病变几乎相同,难以从临床上进行区分,逐一进行实验室鉴定存在耗时过长、浪费试剂等缺点。本研究旨在建立可以同时检测美洲型PRRSV 高致病性和经典毒株的RT-PCR鉴别方法,并以此开展猪蓝耳病的快速诊断。
1 材料与方法
1.1 材料
1.1.1 主要试剂 总RNA 提取试剂盒和DNA Marker(TIANGEN);M-MLV 逆转录酶、重组核酸酶抑制剂、TaqDNA 聚合酶和dNTP Mix(Invitrogen);核酸染料GelRed(Biotium);猪繁殖与呼吸综合征病毒(Nsp2 1594~1680变异株)RT-PCR检测试剂盒(北京世纪元亨),用于比较试验。
1.1.2 仪器设备 PCR 仪、高速冷冻离心机、凝胶成像系统(珠海黑马公司);电泳仪槽(君意JY600C)、微量移液器(芬兰Beta)、二级生物安全柜(BHC-1300ⅡA2)等。
1.1.3 参照物 变异株TJM-F92、经典株CH-1R活疫苗(每头份不少于105.0TCID50)分别用于PRRSV 两种毒株的阳性对照。猪瘟(细胞源)、猪伪狂犬病(HB-98株)、猪乙型脑炎(SA14-14-2株)、猪传染性腹泻-猪流行性腹泻-轮状病毒三联活疫苗用于特异性试验。
1.1.4 样品来源 10份猪血清(编号X1~X10)采自散养户临床无症状猪,6份猪组织(编号Z1~Z6)为屠宰场猪有病变的肺、脾、淋巴结混样。
1.2 方法
1.2.1 引物设计 根据GenBank 登陆的美洲型PRRSV TJ株(登录号EU860248)、CH-1a株(登录号AY032626)及其他毒株核苷酸全序列,综合利用Primer 5.0和Oligo 6生物软件分析,设计一对可以同时扩增变异毒株和经典毒株NSP2基因的特异性共有引物(位于NSP2不连续缺失90个核苷酸位点两端,上游引物P1:5′-TCCACCAAGAGTTCAACCT-3′,下 游 引 物P2:5′-GACGCAGACAAATCCAGAG-3′),预期扩增基因片段分别为342bp(变异毒株)和432bp(经典毒株)。引物由Invitrogen公司合成。
1.2.2 抽提和RT-PCR 取稀释后的活疫苗或临床样品上清液200μL,按照总RNA 提取试剂盒和逆转录酶说明书提取RNA 和进行RT。对PCR 反应体系进行优化,最终确定为10×PCR buffer 2.5 μL,MgCl2(50mmol/L)0.75μL,上、下游引物(10 μmol/L)和dNTP Mix(10 mmol/L)各0.5μL,DNA 聚合酶(5U/μL)0.2μL,反转录产物1μL,加灭菌水至25μL。PCR反应程序为:95℃预变性5 min;94℃30s,58℃30s,72℃45s,35 个循环;72℃延伸10min。
1.2.3 琼脂糖凝胶电泳 配制新鲜的1×TAE 电泳液和12g/L琼脂糖凝胶(经GelRed染色),每孔加入PCR 产物8μL,电压8V/cm,室温25℃,电泳后拍照。
1.2.4 特异性、敏感性、重复性和比较试验 利用灭菌生理盐水将猪瘟、猪伪狂犬病、猪乙型脑炎、猪传染性腹泻-猪流行性腹泻-轮状病毒等活疫苗稀释后作为待检样品进行RT-PCR 特异性试验。将TJM-F92株、CH-1R 株 活 疫 苗 按 照101、102、103、104、105、106倍连续稀释后进行RT-PCR 敏感性扩增。用本研究方法对10份临床样品进行3次重复检测,并与商品化试剂盒检测比较。
1.2.5 临床应用 对临床16份样品进行检测。
2 结果
2.1 RT-PCR建立及特异性试验结果
CH-1R、TJM-F92均扩增出预期大小的目的片段(即432bp和342bp),阴性对照、猪瘟、猪伪狂犬病、猪乙型脑炎、猪传染性腹泻、猪流行性腹泻、轮状病毒没有扩增出条带(图1)。

图1 RT-PCR 特异性检测Fig.1 RT-PCR specificity assay

图2 变异株敏感性试验Fig.2 The sensitivity test of the variant strain
2.2 敏感性试验结果
反应体系能扩增出105倍稀释的变异株模板(图2)和104倍稀释的经典株模板(图3),可以检测出低至101TCID50的病毒感染量。
2.3 重复性试验及与商品化试剂盒比较结果

图3 经典株敏感性试验Fig.3 The sensitivity test of the classic strain
对猪血清(X6~X10)和猪组织(Z1~Z5)利用本法重复3次检测,样品X9、Z1、Z4、Z5为PRRS变异株阳性,其他样品为阴性,3次结果无差异。利用商品化猪繁殖与呼吸综合征病毒(Nsp2 1594~1680变异株)RT-PCR检测试剂盒检测,阳性出现278 bp,结果与研究建立的方法符合率100%(图4)。
2.4 临床样品检测结果
从散养户和屠宰场16份样品中检测出经典株阳性1份(图5血清X2),变异株阳性5份(图5血清X9;图6 组 织Z1、Z4~Z6),总体阳性率为37.5%,变异株占总毒株数的83.3%。

图4 商品化试剂盒检测结果Fig.4 Detection results by commercial kit
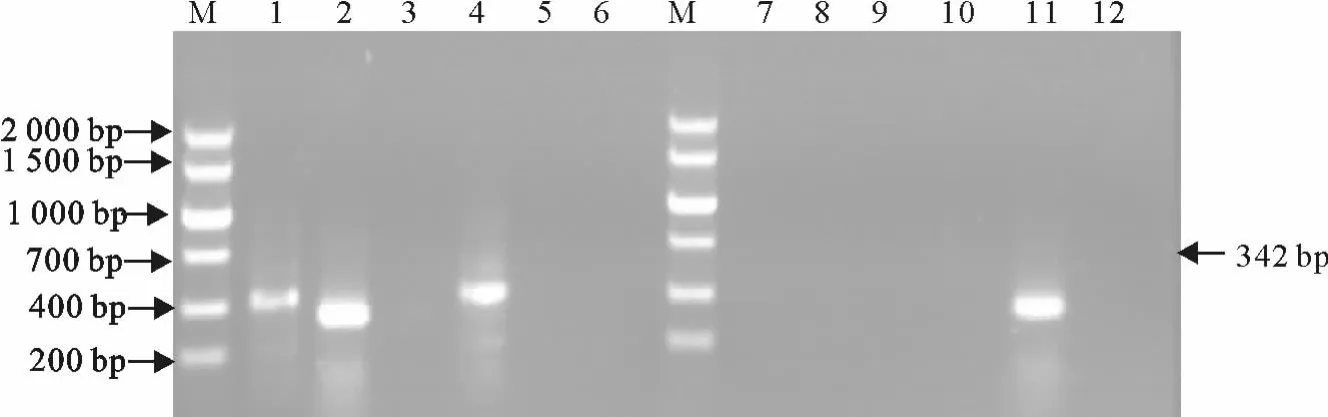
图5 猪血清检测结果Fig.5 Detection results of pig sera

图6 猪组织检测结果Fig.6 Detection results of pig tissues
3 讨论
PRRSV 诊断方法主要有酶联免疫吸附试验(ELISA)[5]、免疫过氧化物酶单层试验(IPMA)[6]、血清病毒中和试验(SVN)[7]、直接免疫荧光试验(IFA)[8]、病毒分离鉴定[9]、核酸序列测定[10]、针对单一PRRSV 毒株的反转录-聚合酶链反应(RTPCR)[11]等。前3 种方法常用于抗体检测,不能区分免疫抗体和野毒感染抗体。IFA、病毒分离鉴定、核酸序列测定可以准确地对病原做出鉴定,但耗费较长时间,不适合快速诊断。常规非鉴别性RTPCR 方法虽然快速,但是无法同时检测变异株和经典株感染。本研究利用美洲型猪繁殖与呼吸综合征病毒变异株相对于经典株在NSP2基因上不连续缺失90个核苷酸的标志特征,设计特异性共有引物,可以同时快速对2种毒株进行鉴别检测。琼脂糖凝胶电泳技术对相差90bp 的2 个较大分子量片段(500bp以上)很难用肉眼分辨,因此本研究设计的引物扩增片段(432bp和342bp)在标准分子质量400bp条带附近,电泳后用肉眼清晰辨别,不用测序即可快速鉴别。
试验表明本研究建立的方法具有良好特异性、敏感性、重复性和可靠性,只能扩增出美洲型PRRSV 基因,猪群当中常见的CSFV、PRV、JEV、TGEV、PEDV、RV 等病毒不会干扰结果,可扩增出低至101TCID50的病毒感染量,可以与国内优秀商品化试剂盒媲美。该法需要注意,1孔DNA Marker最多给予6个样品提供参照,否则电泳斜度可能造成分辨误差。在电泳过程中要控制电压温度,并且使用新配置的电泳液和凝胶才能跑出良好效果。
临床上从猪血清、猪组织中都可以检测出PRRSV,表明建立的方法可以用于活体猪常规监测,也可以用于病死猪鉴定检测。猪血清阳性率(2/10)低于猪组织阳性率(4/6),这与PRRSV 侵入机制、细胞受体和体内分布有关[12-13]。PRRSV 主要侵害含有巨噬细胞的器官如肺脏、淋巴结等,在肺脏中含量高且维持时间长,在血液中含量稍低且维持时间短。变异株所占总毒株的83.3%,表明当前猪群主要以高致病性变异毒株流行为主,这与相关报道结果一致[14-16]。通过检测发现,屠宰场和散养户都是猪蓝耳病发生风险点,要加强监控。
[1]Keffaber K K.Reproductive failure of unknown etiology[J].Swine Pract,1989,18(31):1-9.
[2]郭宝清,陈章水,刘文兴,等.从疑似PRRS 流产胎儿分离PRRSV 的研究[J].中国畜禽传染病,1996,22(2):1-5.
[3]Tian K,Yu X,Zhao T,et al.Emergence of fatal PRRSV variants:Unparalleled outbreaks of atypical PRRS in China and molecular dissection of the unique hallmark[J].PLoS One,2007,2(6):e526.
[4]范培虎,危艳武,郭龙军,等.2005-2010 年我国部分地区PRRSV 流行毒株的遗传变异分析[J].动物医学进展,2011,32(3):1-7.
[5]陈进会,赖维莉,颜其贵.重组M 蛋白间接ELISA 检测猪繁殖与呼吸综合征病毒抗体[J].中国动物检疫,2011,28(4):53-54.
[6]谭 斌,刘长明,危艳武,等.PRRSV-IPMA 抗体检测试剂盒的研制及其应用[J].中国兽医科学,2006,36(11):25-29.
[7]冷超粮,安同庆,陈家锃,等.高致病性猪繁殖与呼吸综合征病毒GP5蛋白B表位诱导中和抗体能力的研究[J].中国预防兽医学报,2011,33(4):297-300.
[8]米立娟,吕宗吉,马春全,等.猪繁殖与呼吸综合征病毒直接免疫荧光检测方法的建立[J].中国动物传染病学报,2013,21(1):42-47.
[9]杨德康,王桂军,李 郁,等.猪繁殖与呼吸综合征病毒的分离鉴定[J].畜牧与兽医,2009,41(5):78-80.
[10]施开创,林昌华,张步娴,等.猪繁殖与呼吸综合征病毒GX1003株全基因序列测定与分析[J].动物医学进展,2013,34(2):30-36.
[11]何世成,邹 敏,刘道新,等.高致病性猪繁殖与呼吸综合征病毒RT-PCR检测方法的建立[J].动物医学进展,2009,30(7):10-13.
[12]张奕强,刘文倩,刘永生,等.猪繁殖与呼吸综合征病毒侵入介体的研究进展[J].中国兽医科学,2011,41(3):109-114.
[13]方桂友,王隆柏,庄向生,等.变异型猪繁殖与呼吸综合征病毒在人工感染猪体内分布情况[J].福建农业学报,2011,26(3):5-10.
[14]张玉德,王光祥,吴锦艳,等.2007-2010年间我国西北地区猪繁殖与呼吸综合征病毒的分子流行病学调查[J].中国兽医科学,2012,42(10):1081-1088.
[15]刘沫飞,李 蕾,郑 辉,等.2010-2011年我国五省PRRSV分离株ORF5基因遗传变异分析[J].动物医学进展,2012,33(12):6-11.
[16]赵日浪,施开创,林昌华,等.广西区2008-2011年猪繁殖与呼吸综合征病毒NSP2基因的遗传变异分析[J].中国兽医科学,2012,42(8):784-790.

