ADDLs对原代培养小鼠皮层神经元及星形胶质细胞混合培养体系Notch-1信号转导及HIF-1α表达的影响
闫 鹏 乔 娴 孙圣刚 刘金玲 郑 瑾
阿尔茨海默病(Ahzheimer’s Disease,AD)是老年期痴呆的主要类型,其发病机制至今仍不甚明了,β淀粉样蛋白(Amyloidβprotein,Aβ)沉积是其主要的病理特征之一,而这同时也是AD较为公认的发病机制假说之一[1,2]。目前越来越多的研究表明,在Aβ的生成、代谢链中 Aβ寡聚体(Aβoli-gomers)即 ADDLs(Aβ-derived diffusible ligands)为主要的毒性形式[3,4],在AD的发病中扮演重要角色,而非β淀粉样蛋白单体或纤维状β淀粉样蛋白。鉴于此,本研究应用ADDLs模拟AD的体外细胞模型。
HIF-1α是在缺氧情况下调控细胞反应的一种主要调控因子,其被认为在多种情况下可发挥保护作用[5~10]。但近来有研究发现其可能有双面作用[6,10],这意味着在某些情况下 HIF-1α可能是有害的。研究发现AD患者脑部的微循环中HIF-1α升高[11,12]。另外,还有研究发现 Aβ1-42可使星形胶质细胞的 HIF-1α表达一过性升高[13]。HIF-1α在 AD发病中所扮演的角色仍有待进一步的研究探讨。Notch-1信号通路是一条与发育相关的通路,其在干细胞和胚胎发育等方面研究相对较多,但其通路成份在成年脑内仍有表达而且具备活性[14],此通路依靠Notch-1剪切为NICD继而向胞内进一步传递信号而发挥作用。正常情况下随着年龄的增长脑内Notch-1信号通路及APP的关键剪切酶γ分泌酶活性会呈现出与年龄相关的降低[15],但在AD患者的脑内Notch-1的剪切水平显著提高[14]。这说明Notch-1信号通路在AD的发病中发挥着重要作用。
既往研究发现在其他系统中HIF-1α和Notch-1信号通路存在交互作用,且具有重要意义[16]。本研究以原代培养小鼠皮层神经元和星形胶质细胞共培养体系为平台,初步探讨了ADDLs毒性作用对共培养体系中Notch-1信号传导水平和HIF-1α蛋白表达的影响,以期为相关研究提供依据。
1 材料与方法
1.1 实验材料
新生小鼠(P0-P2)购自华中科技大学同济医学院实验动物中心;DMEM/F12(1∶1)培养基、胎牛血清及青链双抗均购自Hyclone公司;F12培养基、Neurobasal无血清培养基及B27添加剂购自GIBCO公司;多聚赖氨酸及Aβ1-42蛋白购自sigma公司;HFIP(六氟异丙醇)购自Santa Cruz;Notch-1抗体购自 Epitomic公司,HIF-1α 抗体购自 Ebioscience公司;CCK-8试剂盒购自SAB公司。
1.2 ADDLs制备
依照既往文献所报道方法[17]制备ADDLs。制备方法简述如下:首先于冰上将Aβ1-42单体蛋白溶于HFIP至1 mmol/L,室温放置约1 h使其充分溶解,而后于4℃通风厨内使溶剂充分挥发完毕至成为干燥膜状,-80℃保存;用前以DMSO溶解干燥的膜状药物至5 mmol/L,充分振荡溶解后以4℃无酚红的F12培养基将药物进一步溶解至100 μmol/L,4℃孵育过夜;然后14 000 r/min离心10 min去除不溶性聚合物,留取上清即为ADDLs的F12溶液,保存于4℃;以BCA法测定ADDLs溶液的蛋白浓度;鉴于ADDLs的异质性,其摩尔浓度为其相应初始Aβ1-42单体蛋白的摩尔浓度(一般来说,ADDLs的产率大概为55%~75%)。
1.3 小鼠皮层神经元和星形胶质细胞混合体系的原代培养
初生2 d以内的新生小鼠以75%酒精喷洒全身消毒,置于超净台中快速断头后将头颅置于HBSS解剖液中(冰上操作),解剖出完整脑组织,分离出大脑半球,仔细剥除表面脑膜及血管,剪碎至约1 mm3组织块,以0.25%胰蛋白酶37℃消化10 min,后以等量体积种植培养基【含10%胎牛血清的DMEM/F12(1∶1)】终止消化,以适当的力度反复吹打至组织块基本消失,200目滤网过滤后将悬液于1000 r/min离心8 min,弃上清,以种植培养基将沉淀重悬均匀,再次以800 r/min离心4 min,弃上清,以种植培养基再次重悬,轻柔吹打均匀,计数,接种于预先经0.05 mg/ml多聚赖氨酸包被的孔板中;6孔板的种植密度约为2×106/ml,96孔板的接种密度约为1×105/ml;6孔板中每孔含培养基2 ml,96孔板中每孔内含培养基100μl;接种并于37℃,5%CO2培养箱中培养2~6 h后给予全量更换维持培养基(含2%体积B27的Neurobasal培养基);此后每周给予1/3量更换维持培养基。
1.4 细胞活力评估
采用CCK-8法对混合培养体系的细胞活力进行检测。接种于96孔板的原代培养小鼠皮层神经元及星形胶质细胞混合培养体系,于持续培养第7 d给予不同浓度ADDLs干预;而后每个孔中添加10 μl CCK-8溶液并额外孵育2 h后以酶标仪检测各孔的450 nm吸光值;相应实验孔吸光值-无细胞空白对照孔吸光值=细胞活力。
1.5 Western blot检测蛋白表达水平
6孔板细胞培养至相应时间点并完成相应药物干预等程序后应用含有1%PMSF的RIPA裂解缓冲液分别提取各培养孔的细胞总蛋白,后以BCA法测定蛋白水平。4℃条件下应用6%聚丙烯酰胺凝胶进行电泳,每个电泳孔加样50μg总蛋白样本,电泳完毕后以湿转法将凝胶内的目的蛋白转膜至相应的PVDF膜上;PVDF膜以含5%脱脂奶粉的TBST于室温条件下封闭2 h;以相应浓度的一抗[Notch-1(1∶200)and HIF-1α(1∶800)]4℃孵育过夜;以TBST漂洗5次,每次6 min,之后应用HRP标记的相应二抗于室温孵育1 h。再次以TBST漂洗5次(每次6 min)后以ECL发光法显影并以X胶片曝光;以GAPDH为蛋白内参,每组实验重复3次。
1.6 qPCR检测凋亡相关蛋白caspase-3 mRNA水平
6孔板细胞培养至相应时间点并完成相应药物干预等程序后应用Trizol抽提法提取总RNA,并进行含量和纯度测定。首先进行反转录,取4.643μg总 RNA,与 Oligo(d T)(10 u M)2μl、d NTP(2.5 m M)2μl混合,加dd H2O(无Rnase)至14.5μl,70℃5 min,短暂离心后置于冰上;后与5×RT buffer 4ul、HRP(RRI)/RNase inhibitor 0.5μl、M-MLV 1 μl及适量dd H2O(Rnase free)至20μl体系,反应条件:42℃60 min,95℃5 min,获取cDNA模板;Caspase-3 引 物 为 F(5’-TCTGACTGGAAAGCCGAAAC-3 ’); R (5 ’-GACTGGATGAACCACGACCC-3’),产物204 bp;进行qPCR扩增,总体系20μl,其中cDNA模板4μl,上下引物各0.4 μl,SYBR Green/Flourescein qPCR Master Mix(2X)10μl,RNase-free water定容至20μl,反应条件为50℃2 min、95℃10 min,95℃30 s、60℃30 s,40个循环后在qPCR仪(BioRad iQ5)进行扩增并应用△CT法分析;同时对扩增产物进行3%琼脂糖凝胶电泳,在凝胶成像系统中获取图像,验证目的基因片段的大小。
1.7 统计学处理
2 结 果
2.1 原代培养小鼠皮层神经元和星形胶质细胞共培养体系光学显微镜观察,见图1。
2.2 不同水平ADDLs作用4 h对原代培养小鼠皮层神经元和星形胶质细胞共培养体系细胞活力的影响(CCK-8法)
应用不同水平ADDLs对原代混合培养体系干预4 h,后采用CCK-8法对各组细胞活力进行检测。500 nmol/L及1μmol/LADDLs持续作用4 h对混合培养体系的细胞活力没有明显影响;当ADDLs干预浓度达到2μmol/L或更高时,混合培养体系的细胞活力较空白对照组明显减低,且减低程度与ADDLs的干预水平呈现出一致的趋势(图2)。
图1 原代培养小鼠皮层神经元和星形胶质细胞共培养体系(培养第7 d,×200倍)
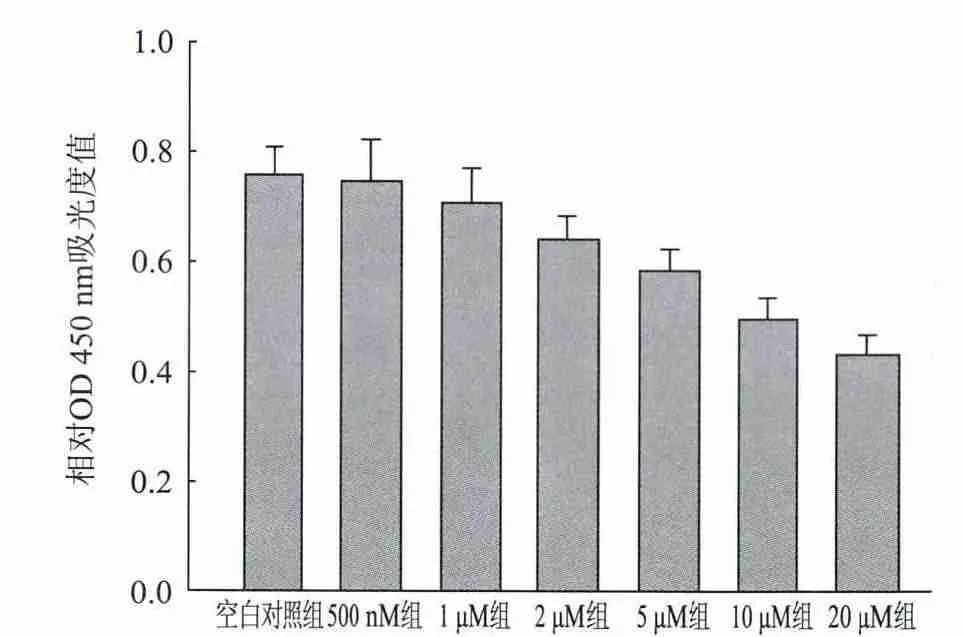
图2 CCK-8法测定ADDLs对原代培养小鼠皮层神经元和星形胶质细胞混合培养体系细胞活力的影响 500 n M组及1 u M组与空白对照组相比,差异均不显著(P>0.05);2~20μM各组分别与空白对照组相比,差异均显著(P<0.01),且2~20μM各组之间的差异亦均具有显著差异(P<0.01)(n=3)
2.3 10μmol/L ADDLs作用不同时间对原代培养小鼠皮层神经元和星形胶质细胞混合培养体系总体NICD及HIF-1α蛋白水平的影响
10μmol/L ADDLs作用后原代培养小鼠皮层神经元和星形胶质细胞混合培养体系NICD及HIF-1α蛋白水平明显升高,且随干预时间呈现先升高后略减低的总体趋势,二者表达的高峰均出现在ADDLs干预后8 h。8 h后二者蛋白水平有减低的趋势,在24 h时,HIF-1α蛋白水平尚未降至与空白对照组一致的水平,但NICD在24 h的表达水平与空白对照组无明显差别(P>0.05)(图3、4)。
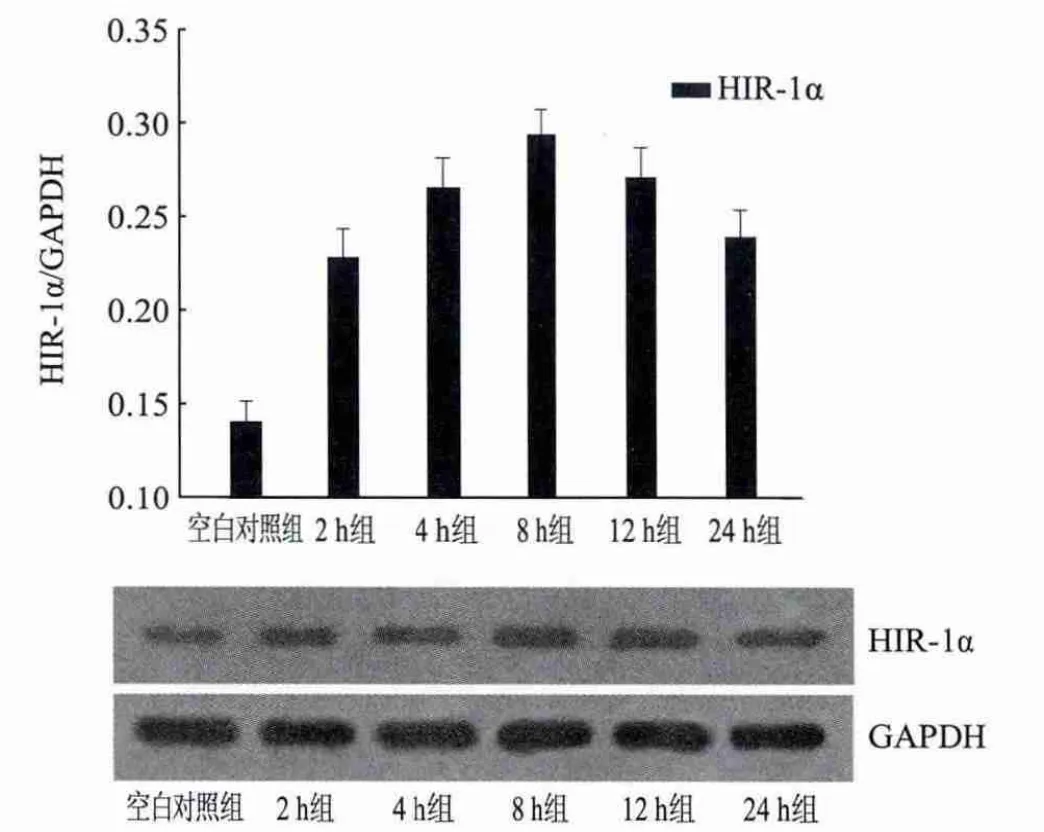
图3 10μmol/L ADDLs作用不同时间对原代培养小鼠皮层神经元和星形胶质细胞混合培养体系总体HIF-1α蛋白水平的影响 各时间组之间HIF-1α蛋白水平的差异均显著(P<0.05)(n=3)
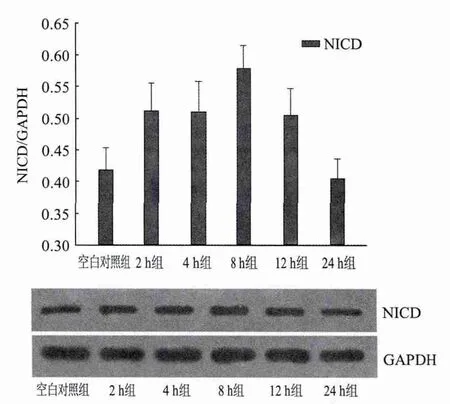
图4 10μmol/L ADDLs作用不同时间对原代培养小鼠皮层神经元和星形胶质细胞混合培养体系总体NICD蛋白水平的影响 2、4、8及12 h组与空白对照相比,差异均显著(P<0.05);2 h组与4 h组相比无明显差异;8 h组与4 h组相比、8 h组与12 h组相比,差异均显著(P<0.05);24 h组与空白对照相比无明显差异(P>0.05)(n=3)
2.4 10μmol/L ADDLs作用不同时间对原代培养小鼠皮层神经元和星形胶质细胞混合培养体系总体caspase-3 mRNA水平的影响
作为补充,我们对不同条件下原代培养混合体系的总体caspase-3 m RNA水平进行了检测。10 μmol/L的ADDLs干预后4 h及24 h 2个时间点原代培养混合体系的总体caspase-3 mRNA水平均明显升高,二者与空白对照组相比均具有显著差异(P<0.01)。但4 h和24 h组之间却无显著差异(P>0.05)(图5)。
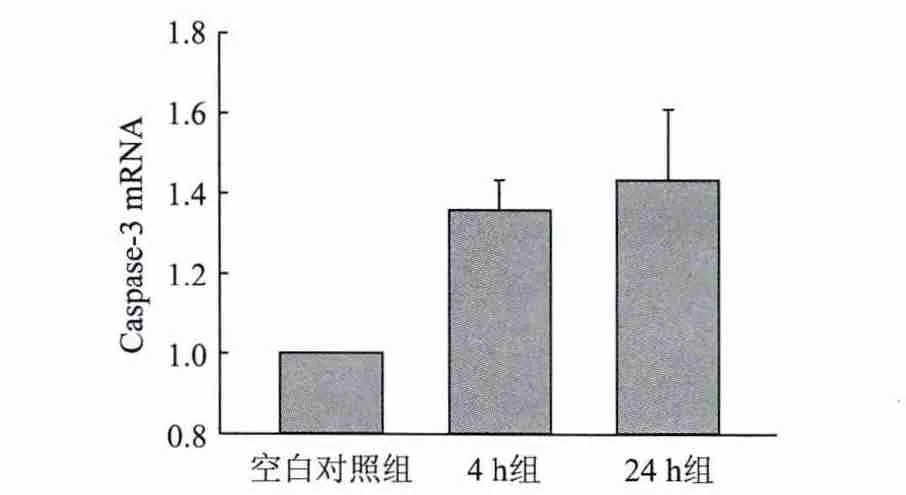
图5 10μmol/L ADDLs作用不同时间对原代培养小鼠皮层神经元和星形胶质细胞混合培养体系总体caspase-3 mRNA水平的影响(real-time PCR)
3 讨 论
阿尔茨海默病(AD)作为老年期痴呆的主要类型,其发病机制至今尚不清楚。既往的体内及体外研究均提示 AD中可能存在 HIF-1α表达升高[11,12],但仍有待进一步的研究进行验证。另外,还有研究表明AD中Notch-1信号通路有异常活化的情况[14]。这些研究综合起来提示在AD的发病中HIF-1α表达升高和Notch-1信号通路的异常活化可能存在关联。而近年来也有研究表明,在其他系统中HIF-1α和Notch信号通路存在交互作用,且具有重要意义[16]。
既往针对AD中Notch-1及HIF-1α的体外研究一般均采用单一种类的细胞培养体系。但是中枢神经系统中神经元及胶质细胞等其他细胞是有机的整体,所以本研究采用了原代培养小鼠皮层神经元及星形胶质细胞混合培养体系,以此在体外实验中尽可能地模拟体内状况。
首先,CCK-8实验表明低水平的ADDLs对原代培养混合体系的细胞活力未表现出明显的影响,而当ADDLs干预水平超过2μM时,其表现出对原代培养混合体系细胞活力的明显损害,且与干预水平呈现出一致的趋势。这和既往类似研究的结论[18]基本一致。基于此,本研究应用10μM ADDLs进行了下一步的实验内容。
通过对不同特定时间点原代培养混合体系总蛋白的检测,10μM ADDLs对混合培养体系中HIF-1α蛋白及NICD的水平表现出先上调后下调的大概趋势,且 HIF-1α蛋白及 NICD的变化趋势与ADDLs干预时间的关系十分类似,两种蛋白的最高水平均出现在“8 h”时间点,随后随着干预时间的进一步延长,两种蛋白的水平均呈现出进行性下降的趋势。其中,干预24 h时HIF-1α蛋白水平还未降至空白对照组的水平,而NICD的水平基本已降至与空白对照组一致的水平。Schubert等的研究发现ADDLs可一过性升高星形胶质细胞HIF-1α蛋白的表达水平,最高表达水平出现在ADDLs干预后4 h,而在干预24 h后HIF-1α蛋白水平较空白对照组还要更低[13]。这与本研究即类似又存在不同,根据实验条件的不同,本研究推测这种不同可能与神经元和星形胶质细胞之间的互相作用有关。对比ADDLs干预后HIF-1α蛋白和NICD表达水平,二者呈现出基本一致的变化趋势,这提示在ADDLs的作用下HIF-1α蛋白和Notch-1信号通路之间很可能有密切相关,故本研究结果初步验证了之前的相关假设。
作为补充,本研究对原代培养混合体系不同状况下凋亡相关蛋白caspase-3的mRNA水平进行了检测。10μM ADDLs作用后4 h,混合体系的总体caspase-3 mRNA水平明显升高,提示10μM ADDLs作用4 h有效诱导了混合培养体系的总体凋亡水平。然而24 h后的总体caspase-3 m RNA水平较4 h并无明显变化,提示ADDLs作用24 h所诱导的凋亡水平较4 h无明显差别。结合既往关于ADDLs毒性作用的研究[18]和本研究 HIF-1α蛋白及NICD水平的检测结果分析,这可能与ADDLs随时间的聚合规律有关,即随着孵育时间的延长,ADDLs水平逐渐降低,取而代之的是纤维化Aβ水平的升高,其细胞毒性较ADDLs明显减低。而共培养体系中HIF-1α蛋白及NICD水平升高后又降低的趋势可能也与ADDLs的聚合有关系,而具体情况还需要进一步更细致的研究。
综上所述,本研究以原代培养小鼠皮层神经元和星形胶质细胞共培养体系为平台,初步探讨了ADDLs毒性作用对共培养体系中整体Notch-1信号通路和HIF-1α蛋白表达的影响。研究结果为AD的ADDLs相关病理机制的研究提示了新的思路,这可能在AD的发病机制研究甚至防治方面有重要意义,但还需要利用更多的试验方法和手段对进一步的细节进行探索。
1 Haass C,Selkoe DJ.Soluble protein oligomers in neurodegeneration:lessons from the Alzheimer's amyloidβ-peptide.Nature reviews Molecular cell biology,2007,8(2):101-112.
2 Klein WL.Synaptotoxic Amyloid-βOligomers:A Molecular Basis for the Cause,Diagnosis,and Treatment of Alzheimer's Disease?Journal of Alzheimer's Disease,2013,33:S49-S65.
3 Lesné,S,Koh MT,kotilinek L,et al.A specific amyloid-βprotein assembly in the brain impairs memory.Nature,2006,440(7082):352-357.
4 Cheng,IH,Scearce-Levie K,Legleiter J,et al.Accelerating amyloid-βfibrillization reduces oligomer levels and functional deficits in Alzheimer disease mouse models.Journal of Biological Chemistry,2007,282(33):23818-23828.
5 Ahn,Jm,You SJ,Lee YM,et al.Hypoxia-inducible factor activation protects the kidney from gentamicin-induced acute injury.PloS one,2012,7(11):e48952.
6 Hashmi S,Al-Salam S.Hypoxia-Inducible Factor-1 Alpha in the Heart:A Double Agent?Cardiology in Review,2012,20(6):268-273.
7 Jeong JK,Moon MH,Park YG,et al.Gingerol-Induced Hypoxia‐Inducible Factor 1 Alpha Inhibits Human Prion Peptide-Mediated Neurotoxicity.Phytotherapy Research,2013,27(8):1185-1192.
8 Lang X,Wang X,Jin JH,et al.Mechanisms of cardioprotection by isoflurane against I/R injury.Frontiers in bioscience:a journal and virtual library,2012,18:387-393.
9 Wang C,Wang Z,zhang X,et al.Protection by silibinin against experimental ischemic stroke:Up-regulated p Akt,pm TOR,HIF-1αand Bcl-2,down-regulated Bax,NF-κB expression.Neuroscience Letters.2012,529(1):45-50.
10 Semenza,GL.Hypoxia-Inducible Factor 1 and Cardiovascular Disease.Annu Rev Physiol.2014,76:39-56.
11 Grammas P,Samany PG,Thirumangalakudi L,et al.Thrombin and inflammatory proteins are elevated in Alzheimer's disease microvessels:implications for disease pathogenesis.Journal of Alzheimer's Disease,2006,9(1):51-58.
12 Grammas P,Tripathy D,Sanchez A,et al.Brain microvasculature and hypoxia-related proteins in Alzheimer's disease.International journal of clinical and experimental pathology,2011,4(6):616-627.
13 Schubert D,Soucek T,Blouw B,et al.The induction of HIF‐1 reduces astrocyte activation by amyloid beta peptide.European Journal of Neuroscience,2009,29(7):1323-1334.
14 Ables JL,Breunig JJ,Eisch AJ,et al.Not(ch)just development:Notch signalling in the adult brain.Nature Reviews Neuroscience,2011,12(5):269-283.
15 Frånberg J,Karlström H,Winblad B,et al.γ-Secretase dependent production of intracellular domains is reduced in adult compared to embryonic rat brain membranes.PloS one,2010,5(3):e9772.
16 Du R,Sun W,Xia L,et al.Hypoxia-induced down-regulation of microRNA-34a promotes EMT by targeting the Notch signaling pathway in tubular epithelial cells.PloS one,2012,7(2):e30771.
17 Zhou Y,Klein WL.AβOligomers-Induced Toxicity is Attenuated in Cells Cultured with Nb Activ4TMMedium.Neurotoxicity research,2012,22(4):335-344.
18 Prangkio P,Yusko EC,Sept D,et al.Multivariate analyses of amyloid-beta oligomer populations indicate a connection between pore formation and cytotoxicity.PloS one,2012,7(10):e47261.

