砷的生物吸附研究进展
陈 朋, 王宁波, 李素岳, 严晓娟, 熊敏晖, 李红玉, 梁 宁
1.兰州大学药学院,兰州730020;
2.甘肃省商业科技研究所,兰州730010
砷(As)是一种剧毒的类金属,广泛存在于自然界[1]。由于各种地质运动和人类活动,砷暴露于环境中并对环境产生长期的影响[2,3]。饮用砷污染的水源,会导致各种疾病,如:癌症、心血管病和皮肤病等[3]。世界卫生组织和美国环境保护组织确定10 μg/L为饮用水含砷最低安全标准[4]。全世界约有70个不同国家和地区的150万人口正饱受饮用砷污染水源的危害[2]。因此,开发一种操作简便、高效快捷、低能低耗、环境友好的用于砷污染水源净化的方法,已成为全球关注的研究热点。本文综述了砷的生物吸附及生物吸附材料的研究进展,以期为开发新型高效的吸附剂提供参考。
1 砷及除砷方法
砷在自然界存在四种不同的价态:As(-Ⅲ)、As(0)、As(Ⅲ)、As(Ⅴ),其中 As(0)很少存在。以砷化合物的半致死量LD50计,不同价态和形态的砷毒性由大到小依次为:AsH3>As(Ⅲ)>As(Ⅴ)>MMA(一甲基砷酸)>DMA(二甲基砷酸)>TMAO(三甲基砷氧)>AsC>AsB>As[5]。水体中砷的主要存在形式为可溶性砷化合物,因此造成环境的污染,并影响人和动物的健康。
常用于去除水源中砷污染的处理手段[6]有凝集-絮凝法[7]、电化学法[8]、离子交换法[9]和膜过滤法[10],含砷废水的处理中主要使用化学法。凝集-絮凝法会形成高浓度的含砷污泥,电化学法会产生AsH3有毒气体,化学法会加入新的化学制剂并产生含砷沉淀物,这些处理方法处理后都存在二次污染的问题,影响环境安全;而离子交换法和膜过滤法处理成本过高,不适于实际应用的推广,且对较低浓度(100 mg/L以下)含砷水源处理效果不理想,处理后污泥无法高效回收也容易发生二次污染[11]。
水处理工业中迫切需要开发出既能高效处理水中的砷污染且成本低廉的方法与技术。近年来,利用生物修复的方法处理环境中的砷污染具有降低砷毒性、环境安全、无二次污染、成本低廉和深度净化等特点,由此建立的生物吸附法越来越受到广泛的关注与研究。生物吸附法是以具有吸附重金属或有机污染物的生物体及衍生物作为固相,在溶剂(通常使用水)中进行的传质的过程。相比其他方法,生物吸附法具有方便快捷、操作简单、成本低、能耗小、效率高、速度快以及易于回收等优点,成为砷处理方法中最具应用潜力的方法。在实际应用中生物吸附法更适合对含砷水源的长期、深度净化处理[3]。而作为生物吸附技术的核心——生物吸附剂的研制与开发也受到了广泛的研究与关注[12]。生物吸附法通常采用具有高比表面积、不溶性的生物材料作吸附剂,通过物理吸附、化学吸附或离子交换等机制将水中的砷污染物固定在吸附剂表面,达到除砷的目的。由于新材料的不断开发,生物吸附材料也逐渐从单一的生物材料发展成多种复合材料,如:活性炭[13]、针铁矿[14]、壳聚糖[15]、生物有机质[2]和磁性新型吸附复合材料[16]等。
2 砷的生物吸附与生物吸附材料
根据吸附机理的不同,吸附过程可分为两种途径:物理吸附和化学吸附。物理吸附主要是靠吸附剂表面基团与被吸附物之间的范德华力和静电引力完成的;化学吸附主要是吸附剂表面基团与被吸附物之间形成配位键以及离子交换的方式得以进行。不同的生物吸附材料利用不同的吸附机理达成吸附除砷的效果。
2.1 纤维素和碳质吸附材料
纤维素和碳质吸附材料主要的吸附机理是物理吸附,引入金属化合物改善碳质吸附材料的吸附性能还涉及到复杂的离子交换机制[17]。
很多农业废弃物都是良好的纤维素和碳质吸附材料,如秸秆、玉米杆等纤维素类,以及果壳、椰壳、核桃壳等制备的碳质材料等。这类农业废弃物来源广泛,成本低廉,可起到资源循环利用与环境保护的双效作用。以农业废弃物作为纤维素和碳质吸附材料的来源,开发新型、易获取且成本低廉的吸附剂已越来越受到重视。
纤维素类吸附材料能与多种金属离子结合,具有比表面积大、易形成亲水性环境、吸附和解吸速率快、再生能力强和净化彻底等优点。田野等[18]以天然纤维素作为基体材料,合成了阴离子吸附剂——纤维素接枝聚甲基丙烯酸二甲胺基乙酯,并应用于水中砷的去除,发现该吸附剂可有效去除水中三价砷和五价砷。李雅轩等[19]通过浸没相分离法制备了铁锰氧化物/醋酸纤维素复合材料,并对材料表征和除砷性能进行了研究,结果表明该材料对As(Ⅲ)和As(Ⅴ)的最大吸附容量分别为74.36 mg/g 和 31.48 mg/g。
碳质吸附材料种类很多,其中活性炭是一种以含炭为主的物质作原料,经高温炭化和活化制得的疏水性吸附剂。活性炭的吸附性既取决于孔隙结构,又取决于化学组成,为进一步提升活性炭对砷的吸附性能,在对其改性和发展活性炭基复合材料方面开展了大量研究。Gupta等[17]在铈氧化锰结合纳米结构活性炭对砷的吸附研究中发现,将吸附材料微小颗粒化能大大提高除砷效果。之后也有一些研究报道了在活性炭上固定铁氧化物[7,20]、银离子和铜离子[21]形成新的复合材料,发现改性后的活性炭有更强的砷吸附力。活性炭已成为新型的吸附材料吸附能力判定的一个比较标准,常常将一种新开发的吸附材料与活性炭的吸附效果进行比较,以评价新的吸附剂的吸附效果。生物炭类是一种具有磁性特征的碳类吸附剂,在缺氧的条件下把生物质与FeCl3进行高温处理,生物质中的油和气燃烧掉,剩下的就是带有磁性的生物炭材料[22]。Zhang等[16]报道了一种新型磁性生物炭吸附材料(γFe2O3-biochar)的制备方法,发现通过Fe2O3的改性不但增强了生物炭对砷的吸附效果,同时使吸附材料具有磁性,对分离吸附材料提供了可能。土壤中砷等污染物可通过水循环进入水源而造成污染,生物炭对于含有砷和多种重金属污染的土壤也显示出很好的修复能力[23]。
2.2 壳聚糖类吸附材料
来源于甲壳类动物的壳中提取的甲壳素及其衍生而来的壳聚糖是一种资源丰富、性能优良的生物吸附材料。壳聚糖及其衍生物表面都有大量的氨基和羟基,具有生物相容性和可降解性的天然属性,易于和金属离子螯合,是用于吸附水中重金属离子的常用材料,这类吸附材料主要的吸附方式是化学吸附。
Dos Santos等[24]在土壤修复中利用铁离子对砷具有很高的亲和性的特点,将壳聚糖与铁离子进行交联,在pH 9.0条件下,As(III)的最大吸收量可以达到13.4 mg/g。洛克沙胂(roxarsone)是广泛使用的含砷饲料添加药物,可造成环境中有机砷或无机砷污染。Poon等[25]制备了不同重量比例的壳聚糖与戊二醛的交联剂,证实重量比为1∶1的壳聚糖与戊二醛的共聚物对洛克沙胂的吸附能力最高,其砷吸附性能可媲美的颗粒活性炭标准物质,达到 2.36mmol/g。Mututuvari等[26]结合纤维素与壳聚糖的共同特性,使用冠醚一步法将二者交联制备成协同增效的超分子多聚糖复合材料,该材料在砷以及其他多种重金属与有机废弃物的吸附中表现出极强的吸附能力,而且该复合物还可重复循环使用。
2.3 微生物类吸附材料
微生物作为一种吸附材料对污染水源处理具有与其他方法截然不同的特点。微生物类吸附材料以微生物的新陈代谢为基础,基于生物氧化降低砷的毒性,细胞壁上的功能基团(多糖、脂类和蛋白质)与砷产生物理和化学吸附作用,新陈代谢产物对砷产生吸附、沉降等作用,进而实现水源的净化。其吸附方式是以生物新陈代谢为基础,有物理、化学途径参与的复杂的吸附和代谢过程。
三价砷一般比五价砷的毒性强,无机砷比有机砷的毒性强,而砷化氢是目前所知毒性最强的一种砷的存在形式。一些微生物例如嗜酸氧化亚铁硫杆菌(Acidithiobacillus ferrooxidans)[2,3]、粪产碱杆菌(Alcaligenes faecalis)[27]、根癌土壤杆菌(Agrobacterium tumefaciens)[28]等,能够氧化高毒性的三价砷成为毒性较低的五价砷,从而降低砷的毒性[29,30],这相比其他方法的简单物理吸附,具有显著优势与特点。微生物对无机砷以及有机砷的吸附主要依赖于菌细胞表面的基团。Yan等[3]研究了嗜酸氧化亚铁硫杆菌BY-3对二甲基砷DMA(V)的吸附处理,分析了DMA(V)对嗜酸菌的抑菌浓度,表明生物处理方法适用于较低砷浓度的水源,有较好的处理效果,同时,使用嗜酸菌吸附处理砒霜和甲基砷酸MMA(V)的对比研究,发现了细胞壁表面与砷特异性结合的羟基和氨基[2]。Prasad 等[31]研究了节细菌属(Arthrobacter sp.)抗砷细菌对水溶液中砷酸盐与亚砷酸盐的生物吸附,研究发现As(Ⅲ)和As(V)的吸附能力分别为74.91 mg/g(pH 7.0)和81.63 mg/g(pH 3.0),在 As(Ⅲ)和 As(V)吸附过程中,细菌表面主要的吸附功能基团为-OH,-C=O和-NH。Mohd Bahari等[32]从金矿中分离获得的一株超耐受砷细菌蜡状芽孢杆菌(Bacillus cereus)SZ2,该菌株对水溶液中As(Ⅲ)的最大吸附能力可达到153.41 mg/g,FTIR分析显示细菌表面吸附的主要功能基团为-OH和-NH。Chen等[33]对嗜酸氧化亚铁硫杆菌 (Acidithiobacillus ferrooxidans)生物浸出雄黄进行了研究,发现嗜酸菌除砷机制是通过氧化Fe(Ⅲ),Fe(Ⅲ)继续氧化雄黄里的As(Ⅱ),实现生物砷浸出后,溶液的砷再被嗜酸菌代谢生成的黄钾铁矾共沉淀,并被菌细胞壁上功能基团吸附(图1),在电镜下可观察到嗜酸菌与砷化合物的结合(图2A)[34],一系列的生化反应参与生物除砷的过程中(图2B)。
大量的研究结果表明,微生物类吸附材料在处理含砷废水方面具有很大的潜力。它们不仅在吸附过程中会改变砷的存在状态、降低砷的毒性,而且除砷后的生物吸附材料可以直接排放到环境中不需做进一步的处理,同时还可以在吸附过程与其他化学吸附材料联合增效以达到对砷的高效吸附。
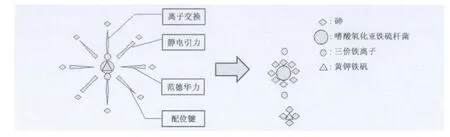
图1 嗜酸氧化亚铁硫杆菌BY-3生物除砷机制Fig.1 Biological mechanism of arsenic removal by Acidithiobacillus ferrooxidans BY-3.

图2 嗜酸氧化亚铁硫杆菌与砷化合物的结合(A)及除砷过程中的生化反应(B)Fig.2 Combination of Acidithiobacillus ferrooxidans BY-3 and arsenic compounds(A)and biochemical reactions in arsenic removal process(B).
3 展望
生物吸附法除砷是一种方便、快捷、有效的生物修复方法。具有简单、高效、选择性好、材料可再生等优点,在含砷水处理中技术中极具潜力。目前,各类生物吸附材料去除砷污染仍存在两大不足,即对低浓度含砷水源处理依然效果不佳[2],广谱吸附剂对砷污染的特异性结合不强。因此,随着对砷污染处理研究的深入,今后生物吸附材料的研究将在重点在以下方面展开:①进一步提高吸附材料吸附性能;②改造吸附材料特异性;③增强吸附材料吸附后处理能力;④防止二次污染,对环境友好;⑤开发生物质与农业废弃物来源的生物吸附剂。
[1]Ansone L,Klavins M,Viksna A.Arsenic removal using natural biomaterial-based sorbents[J].Environ.Geochem.Health,2013,35(5):633-642.
[2]Yan L,Yin H,Zhang S,et al..Biosorption of inorganic and organic arsenic from aqueous solution by Acidithiobacillus ferrooxidans BY-3[J].J.Hazard.Mater.,2010,178(1-3):209-217.
[3]Yan L,Yin H,Zhang S,et al..Organoarsenic resistance and bioremoval of Acidithiobacillus ferrooxidans [J].Bioresour.Technol.,2010,101(16):6572-6575.
[4]Amrose S,Gadgil A,Srinivasan V,et al..Arsenic removal from groundwater using iron electrocoagulation:effect of charge dosage rate[J].J.Environ.Sci.Health A Tox.Hazard.Subst.Environ.Eng.,2013,48(9):1019-1030.
[5]何瑶,黄清辉,刘颖,等.砷形态分析方法及其样品预处理技术研究进展[J].净水技术,2009,8(3):10-13,44.
[6]Choong T S,Chuah T,Robiah Y,et al..Arsenic toxicity,health hazards and removal techniques from water:an overview[J].Desalination,2007,217(1):139-166.
[7]Wickramasinghe S,Han B,Zimbron J,et al..Arsenic removal by coagulation and filtration:comparison of groundwaters from the United States and Bangladesh [J].Desalination,2004,169(3):231-244.
[8]Bisang J,Bogado F,Rivera M,et al..Electrochemical removal of arsenic from technical grade phosphoric acid[J].J.Appl.Electrochem.,2004,34(4):375-381.
[9]Jackson B P, MillerW, Effectivenessofphosphate and hydroxide for desorption of arsenic and selenium species from iron oxides[J].Soil Sci.Soc.Am.J.,2000,64(5):1616-1622.
[10]Saitúa H,Campderrós M,Cerutti S,et al..Effect of operating conditions in removal of arsenic from water by nanofiltration membrane[J].Desalination,2005,172(2):173-180.
[11]鲁栋梁,夏 璐.重金属废水处理方法与进展[J].化工技术与开发,2008,37(12):32-36.
[12]Vieira R H,Volesky B.Biosorption:a solution to pollution?[J].Int Microbiol.,2010,3(1):17-24.
[13]Vitela-Rodriguez A V,Rangel-Mendez J R.Arsenic removal by modified activated carbonswith iron hydro(oxide)nanoparticles[J].J.Environ.Manage.2013,114:225-231.
[14]Gimenez J,Martinez M,de Pablo J,et al..Arsenic sorption onto natural hematite, magnetite, and goethite [J]. J.Hazard.Mater.,2007,141(3):575-580.
[15]Gupta A,Yunus M,Sankararamakrishnan N.Zerovalent iron encapsulated chitosan nanospheres-a novel adsorbent for the removal of total inorganic arsenic from aqueous systems[J].Chemosphere.,2012,86(2):150-155.
[16]Zhang M,Gao B,Varnoosfaderani S,et al..Preparation and characterization of a novel magnetic biochar for arsenic removal[J].Bioresour.Technol.,2013,130:457-462.
[17]Gupta K,Bhattacharya S,Nandi D,et al..Arsenic(III)sorption on nanostructured cerium incorporated manganese oxide(NCMO):a physical insight into the mechanistic pathway[J].J.Colloid Interface Sci.,2012,377(1):269-276.
[18]田野,吴敏,孟令蝶,等.天然纤维素纤维改性及其对水中砷的吸附[J].科技导报,2010,(22):29-32.
[19]李雅轩,陈梅青,王瑜瑜,等.铁锰氧化物/醋酸纤维素复合材料制备及除砷性能研究[A].见:中国环境科学学会.中国环境科学学会学术年会论文集 (第五卷)[C].中国环境科学学会学术年会,昆明,2013.
[20]Vadahanambi S,Lee S H,Kim W J,et al..Arsenic removal from contaminated water using three-dimensional graphenecarbon nanotube-Iron oxide nanostructures[J].Environ.Sci.Technol.,2013,47(18):10510-10517.
[21]Rajakovic'L V.The sorption of arsenic onto activated carbon impregnated with metallic silver and copper[J].Sep.Sci.Technol.,1992,27(11):1423-1433.
[22]Chen B,Chen Z,Lv S.A novel magnetic biochar efficiently sorbs organic pollutantsand phosphate[J]. Bioresour.Technol.,2011,102(2):716-723.
[23]Tang J,Zhu W,Kookana R,et al..Characteristics of biochar and its application in remediation of contaminated soil[J].J.Biosci.Bioeng.,2013,116(6):653-659.
[24]Dos Santos H H,Demarchi C A,Rodrigues C A,et al..Adsorption of As(III)on chitosan-Fe-crosslinked complex(Ch-Fe)[J].Chemosphere.,2011,82(2):278-283.
[25]Poon L,Younus S,Wilson L D.Adsorption study of an organo-arsenical with chitosan-based sorbents[J].J.Colloid Interface Sci.,2014,420:136-144.
[26]Mututuvari T M,Tran C D.Synergistic adsorption of heavy metal ions and organic pollutants by supramolecular polysaccharide composite materials from cellulose,chitosan and crown ether[J].J.Hazard Mater.,2014,264:449-459.
[27]Anderson G,Williams J, Hille R. The purification and characterization of arsenite oxidase from Alcaligenes faecalis,a molybdenum-containing hydroxylase [J].J.Biol.Chem.,1992,267(33):23674.
[28]Lehr C R,Kashyap D R,McDermott T R.New insights into microbial oxidation of antimony and arsenic [J].Appl.Environ.Microbiol.,2007,73(7):2386-2389.
[29]Leiva ED,Ramila CD,Vargas I T,et al..Natural attenuation process via microbial oxidation of arsenic in a high Andean watershed[J].Sci.Total Environ.,2013,466-467C:490-502.
[30]Hamamura N,Macur R E,Korf S,et al..Linking microbial oxidation of arsenic with detection and phylogenetic analysis of arsenite oxidase genes in diverse geothermal environments[J].Environ.Microbiol.,2009,11(2):421-431.
[31]Prasad K S,Ramanathan A L,Paul J,et al..Biosorption of arsenite(As(+3))and arsenate(As(+5))from aqueous solution by Arthrobacter sp.biomass[J].Environ.Technol.,2013,34(17-20):2701-2708.
[32]Mohd Bahari Z,Ali Hamood Altowayti W,Ibrahim Z,et al..Biosorption of As(III)by non-living biomass of an arsenichypertolerant Bacillus cereus strain SZ2 isolated from a goldmining environment:equilibrium and kinetic study[J].Appl.Biochem.Biotechnol.,2013,171(8):2247-2261.
[33]Chen P,Yan L,Leng F,et al..Bioleaching of realgar by Acidithiobacillus ferrooxidans using ferrous iron and elemental sulfur as the sole and mixed energy sources.[J].Bioresour.Technol.,2011,102(3):3260-3267.
[34]Chen P,Yan L,Wang Q,et al..Surface alteration of realgar(As4S4)by Acidithiobacillusferrooxidans. [J]. Int.Microbiol.,2012,15(1):9-15.

