重组猪生长激素表达研究进展
张永红, 唐芬芬, 邵榆岚, 钟 健, 白兴荣
云南省农业科学院蚕桑蜜蜂研究所,云南蒙自661101
猪生长激素(porcine growth hormone/porcine somatotropin,pGH/pST)是猪脑垂体前叶嗜酸性细胞分泌的一种单一肽链蛋白质激素,在调节猪的生长发育方面起着重要作用,主要表现在降低脂肪含量、促进蛋白质合成和增加动物泌乳量,是畜牧业生产中极其重要的激素之一[1]。随着人类日益增长的消费需求,利用基因工程技术表达猪生长激素应用于养猪业,可提高猪生长速度、缓解养殖产业的压力、满足消费市场对猪肉的需求,产生重大的经济效益。本文主要综述了猪生长激素的基因结构、生理功能及其重组蛋白表达研究的进展,并展望了重组猪生长激素的应用和发展前景。
1 猪生长激素的概述
猪生长激素是一类多肽类激素,由191个氨基酸组成,分子量22 kDa,等电点为6。猪基因组中GH基因为单拷贝,且无其他相似序列,其基因全长为2 231 bp,由5个外显子和4个内含子构成,其外显子长度分别是 10 bp、161 bp、117 bp、162 bp和 198 bp,内含子长度分别为 242 bp、210 bp、197 bp 和 278 bp;编码成熟肽的片段大小为570 bp。
GH作为动物生长发育关键的激素,其基因序列在各物种中高度保守[2],pGH与人(hGH)、牛(bGH)、鼠(mGH)生长激素的核苷酸序列具有高度同源性。pGH同bGH基因的5'端、3'端UTR及polyA+下游序列高度保守,据此说明它们可能以某种相同的方式来调节GH的合成,可推测GH作为代谢关键激素在物种进化过程中基因序列仍然高度保守。pGH蛋白的三维结构已经获得解析(图1A)[4],X射线晶体结构分析表明,与bGH(图1B)极为相似的是都含有4个α螺旋[3]。
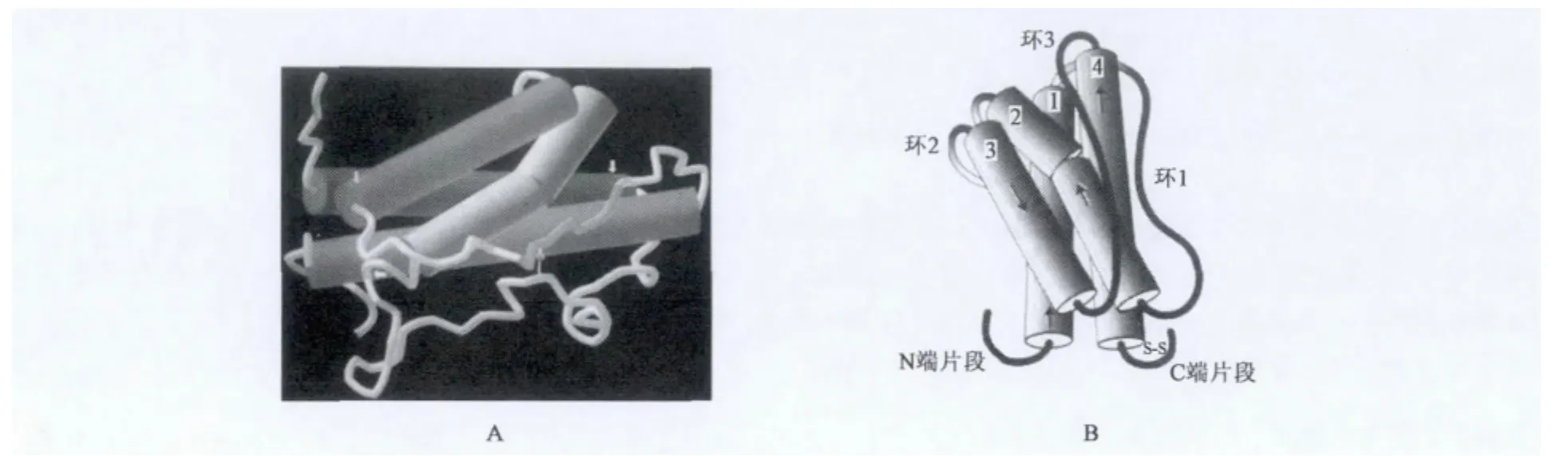
图1 GH 的蛋白质结构[3,4]Fig.1 Structure of growth hormone[3,4].
2 猪生长激素的生理功能
生长激素是脊椎动物脑垂体分泌的多肽类激素,是动物调节生长和组织发育必不可少的激素,缺乏该激素机体就会停止生长,它与下丘脑分泌的促生长激素释放因子、抑制素、类胰岛素样生长因子和胰岛素等体内激素形成刺激和反馈机制,共同影响动物各类型组织的生理代谢。猪生长激素生理功能主要表现在以下几个方面。
2.1 降低脂肪含量
pGH能使猪背膘的厚度和胴体脂肪含量明显降低[5]。注射pGH能减弱脂肪合成、抑制脂肪合成酶活性,直接作用于脂代谢中关键酶乙酰辅酶A使其活性和mRNA含量分别下降58% 和 40%[6]。
2.2 提高蛋白质合成量
生长激素通过增加氮存留、氨基酸吸收、蛋白质合成的氨基酸掺入,以及作用于RNA聚合酶,调节转录来促进蛋白质合成。注射pGH以后,猪胴体品质有很大变化,表现为组织蛋白含量增加,瘦肉率提高。GH与抗胰岛素表现为拮抗效应,葡萄糖需求减少,进而合成更多的蛋白质。它能调节葡萄糖和游离脂肪酸两种关键代谢物不可逆转的流失和氧化,短时间内提高乳汁分泌量,也可减少氮流失而提高蛋白质合成率[7]。
2.3 对类胰岛素样生长因子、胰岛素分泌及葡萄糖浓度的影响
Donkin等[8]研究发现,注射pGH能使猪血清中类胰岛素样生长因子IGF-I/II和胰岛素的水平提高,而且血浆中葡萄糖含量明显提高。重组pGH蛋白注射到动物体内能加快本体生长激素和IGF-I循环水平,促进肝脏中IGF-I mRNA水平升高。
2.4 对不同生长阶段猪个体的影响
长期注射猪生长激素对哺乳仔猪(到第28 d断奶的哺乳猪)[9]、小猪(体重 10 kg 左右)[10]、生长猪[11]、后备母猪[12]和哺乳母猪都能明显提高体重,而且哺乳母猪泌乳量也有较大提高[13]。
2.5 对矿物质代谢的影响
pGH能促进钙、磷、镁等矿物质元素的吸收,但矿物质元素在血浆中的浓度不发生变化[14]。Caperna等[14]发现pGH可增强Fe元素在体内的滞留,并促进其吸收。
3 重组猪生长激素的表达
pGH最早是直接从猪脑组织中提取获得,而采用简单的化学方法从猪垂体中提取pGH,大量猪个体脑垂体只能得到微量pGH,存在回收量和回收率低等问题,极大限制了pGH的应用。借助基因工程技术表达pGH能够克服上述缺点,使pGH在生产上应用成为可能。
自20世纪80年代起,有关pGH的克隆研究逐步深入。Seeburg等[15]用基因文库的方法克隆了pGH的非全长基因;继而,Vize等[2]利用含pGH基因全长cDNA序列作为杂交探针确定了该基因的全序列。我国在国外pGH研究的基础上,也进行了一些探索。王华岩等[16]克隆得到了含5'端和3'端UTR的pGH全长cDNA;齐顺章等[17]对pGH cDNA全基因序列进行了测定分析;杨青等[18]从构建的猪脑垂体基因文库中筛选到了pGH基因并成功克隆了该基因。Evock等[19]最先通过原核表达技术表达猪生长激素,而且具有促生长生物活性。目前的研究集中在利用原核或真核表达系统高效表达有活性的重组pGH上。
3.1 pGH基因的原核表达
pGH原核生物表达系统通常以大肠杆菌作为受体,技术成熟、操作简便,且大肠杆菌繁殖周期短、外源蛋白表达量高。但原核表达系统也存在明显缺点限制其应用,主要体现在:①原核其表达的pGH形成会包涵体,而不能分泌到培养基上清中,提取蛋白质首先必须首先破碎细胞获得包涵体,然后利用强变性剂来溶解包涵体使pGH蛋白变性,最后变性蛋白通过复性才能得到活性蛋白,包涵体虽有益于抵御蛋白酶降解,但不利于蛋白质的分离纯化。②原核表达蛋白无翻译后的修饰,并且从包涵体制备的外源蛋白可能无生物活性,pGH基因的表达序列长度(ORF序列、成熟肽片段等)也影响蛋白质的活性。③原核重组表达系统遗传稳定性差,需要选择合适的表达载体来表达目的蛋白质,还需优化诱导温度、诱导因子等。解决上述问题,pGH原核表达才能成功应用。最新研究证实,注射原核表达的重组pGH蛋白的日本微型猪表现出促生长效果[20]。
3.2 pGH基因的真核表达
3.2.1 哺乳动物细胞表达pGH pGH在哺乳动物、鱼类中已经成功得到表达并具有生物效应,考虑到哺乳动物细胞表达的产物在分子结构、理化特性和生物学功能方面最接近天然蛋白质分子,用哺乳动物细胞表达系统来表达pGH,可为pGH蛋白的生产应用提供依据。
脂质体载体和病毒载体常用于哺乳动物细胞的转染。1990年,Kato等[21]利用哺乳动物猴COS-1细胞成功表达了pGH,重组pGH蛋白同天然pGH蛋白分子大小一致。2007年,Zuhorn等[22]发现阳离子脂质体(CLS)能克服细胞障碍将表达载体成功转染到细胞内表达目的基因。2011年,Peng等[23]利用CLS介导的含 pGH 基因载体在COS-7真核细胞内表达pGH蛋白和小鼠体内表达pGH,小鼠体重发生显著变化。陈斌方等[24]用带有pGH cDNA的核糖体进入位点介导的双顺反子并带有新霉素抗性标记的逆转录病毒载体pSN-pGH转染鼠胚胎成纤维细胞,将感染的细胞通过腹膜注射到同系的去垂体小鼠体内,发现感染细胞分泌表达的pGH具有生物活性,植入15~57 d后小鼠胫骨有明显的促生长效应;G418处理小鼠发现植入的成纤维细胞70 d还有存留,随着小鼠生长,转染细胞减少而pGH mRNA水平降低,但pGH转录水平并不降低。采用病毒载体转染细胞植入动物体内能够表达有促生长效应的活性蛋白,但表达水平受pGH cDNA拷贝数的限制。利用不带任何筛选标记的逆转录病毒载体将pGH cDNA转入鼠成纤维细胞NIH373中表达,并将带有新霉素筛选标记的pGH反病毒载体二次感染处理NIH373细胞,结果发现增加宿主染色体前病毒中pGH DNA的拷贝数增加,进而增加氮端发生修饰的pGH的分泌量也有所增加[25]。
利用哺乳动物细胞系来表达pGH,表达的重组蛋白具有翻译后的修饰并表现天然的生物活性,但应用何种哺乳动物细胞系表达都存在细胞凋亡、表达调控原件的优化等问题,细胞培养成本较高并且筛选标记不明显,加之目的蛋白收获量较低,很难投入生产,因此需要探索新的蛋白质表达技术。
3.2.2 酵母表达pGH 酵母表达的外源蛋白存在翻译后的加工修饰,酵母兼具大肠杆菌异源蛋白表达量高的优点,因此酵母已成为基因工程技术中重要的表达系统。Jo等[26]根据已报道的pGH基因编码序列,通过优化密码子在酵母细胞中成功表达了pGH,其大小为22 kDa,并占胞内可溶蛋白10%,获得的重组pGH同样具有改变猪生长速率的生物活性。但是酵母表达系统同样存在表达蛋白内部降解、信号肽加工不完全、表达产物过度糖基化等不足,需要在实际应用中不断改进。
3.2.3 昆虫表达pGH 杆状病毒表达载体系统(baculovirus expression vector system,BEVS),也称作昆虫表达系统,于20世纪80年代构建并开始广泛应用,是一种功能全面的真核细胞基因表达载体系统,具有多角体启动子控制下的高效表达、真核细胞完善的转译后加工修饰、较易从细胞培养上清中和昆虫组织中纯化目的蛋白等优点。
当前,已有数千计的异源基因在该系统中得到表达,且产生的重组蛋白可进行精确的蛋白质折叠、糖基化、信号肽切割等翻译后加工修饰;并且基因加入信号肽后,表达产物有较强的胞外分泌能力,有利于产物的后加工,并且重组体的遗传稳定性好[27],BEVS在上述方面明显优于原核表达载体系统。欧阳菁等[28]利用BEVS在昆虫细胞中表达了pGH基因,选择带病毒polh基因启动子和gp67信号肽的重组pGP67-pGH转移载体,与致死缺陷型线性化AcMNPV-OCC-DNA共转染草地夜蛾细胞(Sf9),构建了既能形成多角体又能表达外源基因的苜蓿丫纹夜蛾核多角体重组病毒AcMNPV-pGP67-pGH-OCC+,SDS-PAGE 和 Western杂交检测到感染重组病毒的Hi5细胞上清液可溶蛋白中22 kDa的猪生长激素条带,pGH蛋白占细胞可溶蛋白的4.48%。虽然杆状病毒表达系统表达蛋白可完成翻译后的修饰并且表达量相对较高,但该系统还具有病毒增殖周期较短,目的蛋白无法连续表达的缺点,并且病毒基因表达调控机制尚不清楚,各病毒株系之间毒力还存在差异,毒力的大小和增殖直接影响蛋白质的表达量,需要进一步深入研究。
家蚕是迄今为止被人类完全驯化并得以充分利用的重要经济昆虫之一,具有易饲养、繁殖周期短、繁殖数量大等特点。在基因工程领域,作为重要的模式生物,家蚕的遗传背景清楚,研究深入。家蚕表达外源基因具有简单、成本低廉、安全等优点,以家蚕生物作为反应器可低成本、大规模生产重组蛋白,是一种重要的昆虫表达系统,目前已得到广泛的开发与应用。家蚕杆状病毒表达系统被广泛用于家蚕生物反应器研究中,朱江等[29]将带有6×His纯化标签的 pGH基因片段连接到pBacPAK构建成重组穿梭载体pPGH030,重组载体同Bm-BacPAK6共转染BmN细胞,细胞破碎后的上清溶液中可检测到pGH蛋白表达;BmN细胞上清液接种5龄家蚕和蚕蛹,幼虫和蛹血淋巴中均检测到分子量约25 kDa的特异pGH蛋白质条带,证实pGH在家蚕细胞和蚕体中得到了表达。与昆虫培养细胞相比,利用家蚕幼虫和蛹生产pGH能够获得更高的表达量,同时还可开发为含有pGH蛋白的新型昆虫饲料。
利用家蚕BmNPV表达系统生产重组蛋白时,存在家蚕批次病毒接种的问题,并且后续蛋白分离纯化相对繁琐。因此,对家蚕反应器表达重组蛋白的大量研究集中在改进转基因方法,以及如何提高蛋白表达量和易于分离纯化蛋白上。家蚕个体表达重组蛋白pGH的后续分离纯化较为困难,而采用家蚕特异组织(丝腺、脂肪体等)在特定时期表达pGH,可提高其表达量并弥补个体表达的不足。家蚕幼虫的丝腺作为合成和分泌丝蛋白的器官,5龄后期丝胶和丝心蛋白大量合成,若利用相应的丝胶和丝素启动子来驱动pGH的表达,不仅利于纯化目的蛋白,而且表达量大为提高[30]。家蚕组织特异性表达基因的启动子也逐渐被克隆,如30k蛋白家族中的lp3基因启动子,在家蚕脂肪体和血液中特异表达[31],还有中肠特异表达启动子[32]等。而家蚕组成型启动子如A3[33]、热激蛋白 HSP 启动子[34]在家蚕的各个组织尽有表达,不存在时期特异性,应用这类启动子则方便纯化蛋白且目的蛋白表达量也相对较高。为了增强启动子的驱动活性,也可以在启动子的上游插入增强子片段使目的蛋白表达量增大。目前家蚕转基因技术相对成熟,已经建立各种转基因载体,如,基于pigg Bac转座子带荧光筛选标记(GFP、DsRed)的转基因家蚕,制作相对容易[35]。家蚕转基因技术的研究对拓展家蚕生物反应器和促进pGH的生产化具有重要意义。
3.3 pGH转基因动物研究
自1982年将pGH基因整合到小鼠基因组上首先实现阳性转基因小鼠[36],利用转基因技术已经成功将 pGH 基因应用于猪[37]、兔子[38]等哺乳动物。评估重组pGH的功能需要测定转基因动物体重和组织发育情况,确定pGH的促生长作用。1988年,Vize等[37]建立用人金属硫蛋白启动子驱动pGH表达的转基因猪,阳性个体较阴性个体生长速率加快和体重有所增加;2003年,仲飞等[39]同样使用绵羊铁硫蛋白启动子启动pGH在小鼠体内表达促进了个体生长速率。实验动物体重发生了明显变化,但是潜在的风险还不得而知,为了克服简单外源启动子驱动GH表达的转基因技术给动物个体产生的副作用,Jia等[40]运用BAC(细菌人工染色体)携带pGH基因,还包括正、负调控元件,选择合适启动子驱动pGH在小鼠体内表达,阳性小鼠在整个发育过程中未发现任何疾病症状。1998年,张志红等[41]构建绵羊铁硫蛋白启动子启动pGH的表达盒,将载体注射到金鱼受精卵内表达pGH,金鱼表达的重组pGH能使其体重明显上升,证实pGH在鱼类也同样产生促生长的效果。
4 重组猪生长激素的应用与发展前景
开发重组猪生长激素具有重要的科研价值、经济意义、社会意义和生态效益。动物微量注射pGH就能产生明显的促生长效果,能够提高猪对饲料的利用率,缩短肉猪的出栏时间,减少碳排放,缓解市场供需矛盾。但pGH的应用必须有严格的规范和监管,一方面,过量注射或长期注射pGH会产生风险,甚至严重的副作用,如雌性牛个体生育率下降,可能完全不育,免疫力也低于未注射的个体[42],而猪长期注射重组 pGH蛋白的潜在问题还未评估。另一方面,由于正常动物个体自身合成分泌的生长激素足以维持正常的生长发育,因此利用通过转基因技术在动物体内过量表达同源或外源GH进行生产性应用,则必须严格评估其安全性。
使用重组pGH促进肉猪生长的同时保持猪个体的健康是今后生产应用的重要方向。重组pGH蛋白与固醇类激素、人工合成的生长调节激素不同,不会长时间在动物体内残留,因此不存在pGH在动物体内积累的问题。人食用注射pGH的猪或转pGH基因的猪,因pGH半衰期较短、种间异性,不与hGH受体结合产生生理效应,短时间内对人体不会产生危害,但是目前还没有充分的证据证明pGH对人体无潜在且长远的影响,因此还需严格评估。尽管重组pGH应用于养猪业仍存在分歧,但是相对于传统生长调节激素,在动物毒性、动物残留和对人体的影响等方面,已经具有明显的比较优势。通过基因工程技术优化,清楚探索该激素作用机制,重组猪生长激素同样能够应用于生产。通过优化pGH基因的翻译序列、引入其基因内含子序列、选择优异的启动子等手段使得重组pGH蛋白更接近天然结构;清楚了解pGH的代谢机理,研究如何在生猪饲养过程中合理、规范使用pGH蛋白,可将pGH蛋白质运用于养猪业以生产更加健康的猪。不同区域的猪在瘦肉率、口感、生长速度等性状上都存在差异,运用传统的育种手段,还存在生殖隔离、选育周期较长等问题,若将pGH用于经济性状较好的猪品种,该品种猪可实现瘦肉率高、生长较快等传统育种的目标,可解决传统遗传育种遇到的上述问题。
利用经济昆虫家蚕来表达猪生长激素,可充分合理利用家蚕资源,茧壳产生其经济价值外,蛹和蛾还可以开发含pGHz的新型饲料添加剂,无需提取纯化pGH蛋白即可直接应用,节省pGH蛋白的生产成本,这也是目前颇具生产前景的研究方向。
随着人口增加,人们对物质生活要求的提高,养猪业饲料成本上涨、占生产成本比重增大,pGH的使用有助于缓解上述矛盾。重组pGH蛋白质并不随着猪的生长在猪体内残留,在经基因工程技术优化以后,pGH能为广大消费者提供相对廉价、瘦肉率高、更健康的猪,产生重大的社会效益,因此,研究开发重组猪生长激素、实现重组猪生长激素蛋白生产化具有广阔的发展前景。
[1]Hagen D R,Mills E W,Bryan K A,et al..Effects of exogenous porcine growth hormone(pGH)On growth,carcass traits,reproductive characteristics and meat sensory attributes of young boars[J].J.Anim.Sci.,1991,69(6):2472-2479.
[2]Vize P D,Wells J R E.Isolation and characterization of the porcine growth hormone gene[J].Gene,1987,55(2):339-344.
[3]Carlacci L,Chou K C,Maggiora G M.A heuristic approach to predicting the tertiary structure of bovine somatotropin[J].Biochemistry,1991,30(18):4389-4398.
[4]Abdel-Meguid S S,Shieh H S,Smith W W,et al..Three dimmensional structure of a genetically engineered variant of porcine growth hormone[J].Proc.Natl.Acad.Sci.USA,1987,84(18):6434-6437.
[5]Etherton T D,Wiggins J P,Chung C S,et al..Stimulation of pig growth performance by porcine growth hormone and growth hormone-releasing factor[J].J.Anim.Sci.,1986,63(5):1389-1399.
[6]Harris D M,Dunshea F R,Bauman D E,et al..Effect of in vivo somatotropin treatment of growing pigs on adipose tissue lipogenesis[J].J.Anim.Sci.,1993,71(12):3293-3300.
[7]Peel C J,Bauman D E.Somatotropin and lactation[J].J.Dairy Sci.,1987,70(2):474-486.
[8]Donkin S S,McNall A D,Swencki B S,et al..The growth hormone-dependent decrease in hepatic fatty acid synthase mRNA is the result of a decrease in gene transcription[J].J.Mol.Endocrinol.,1996,16(2):151-158.
[9]Harkins M,Boyd R D,Bauman D E.Effect of recombinant porcine somatotropin on lactational performance and metabolite patterns in sows and growth of nursing pigs[J].J.Anim.Sci.,1989,67(8):1997-2008.
[10]Harrell R J,Thomas M J,Boyd R D,et al..Effect of porcine somatotropin administration in young pigs during the growth phase from 10 to 25 kilograms[J].J.Anim.Sci.,1997,75(12):3152-3160.
[11]Kanis E,Nieuwhof G J,De Greef K H,et al..Effect of recombinant porcine somatotropin on growth and carcass quality in growing pigs:interactions with genotype,gender and slaughter weight[J].J.Anim.Sci.,1990,68(5):1193-1200.
[12]Bryan K A,Clark A M,Hagen D R.Effect of treatment with and subsequent withdrawal of exogenous porcine somatotropin on growth and reproductive characteristics of gilts[J].J.Anim.Sci.,1990,68(8):2357-2361.
[13]汪琳仙,张少英.外源猪生长激素对猪血液葡萄糖、胰岛素含量的影响[J].北京农业大学学报,1989,15(4):456-459.
[14]Caperna T J,Campbell R G,Steele N C.Interrelationships of exogenous porcine growth hormone administration and feed intake level affecting various tissue levels of iron,copper,zinc and bone calcium of growing pigs[J].J.Anim.Sci.,1989,67(3):654-663.
[15]Seeburg P H,Sias S,Adelman J,et al..Efficient bacterial expression of bovine and porcine growth hormones[J].DNA,1983,2(1):37-45.
[16]王华岩,周顺伍,王辛中,等.猪生长激素基因cDNA的分子克隆[J].北京农业大学报,1987,13(4):379-385.
[17]齐顺章,王辛中,周顺伍,等.猪生长激素基因cDNA的全序列分析[J].生物工程学报,1989,5(1):35-39.
[18]杨青,朱宝利,周顺伍,等.猪垂体中猪生长激素基因的克隆和部分序列分析[J].生物工程学报,1992,8(4):318-323.
[19]Evock C M,Caperna T J,Steele N C,et al..Influence of time of injection of recombinant porcine somatotropin(rpST)relative to time of feeding on growth performance,hormone and metabolite status,and muscle RNA,DNA,and protein in pigs[J].J.Anim.Sci.,1991,69(6):2443-2451.
[20]Ashok S K,Kuwabara Y,Abe S,et al..Expression and purification of growth hormone from Microminipig(MMP)and its effects on body fat percentage with injection[J].J.Appl.Biol.Biotechnol.,2014,2(1):23-29.
[21]Kato Y,Shimokawa N, Kato T, et al.. Porcine growth hormone:molecularcloningofcDNA andexpressionin bacterial and mammalian cells[J].Biochim.Biophys.Acta,1990,1048(2):290-293.
[22]Zuhorn I S,Engberts J B F N,Hoekstra D.Gene delivery by cationic lipid vectors:overcoming cellular barriers[J].Eur.Biophys.J.,2007,36(4-5):349-362.
[23]Peng C,Wang L,Chen Z,et al..Construction of porcine growth hormone eukaryotic expression vector and its transfection mediated by cationic liposome in mice.[J]. Anim.Biotechnol.,2011,22(4):223-235.
[24]Chen B F,Chang W C, Chen ST, et al.. Long-term expression ofthe biologically active growth hormone in genetically modified fibroblasts afterimplantation into a hypophysectomized rat[J].Hum.Gene Ther.,1995,6(7):917-926.
[25]Hwang L H,Chen B F,Lee P J,et al..Use of helper‐free retroviral vector to direct a high expression of porcine growth hormone in mouse fibroblast cells[J].Biotechnol.Appl.Biochem.,1992,16(2):171-181.
[26]Jo J M,Lee T H,Jeong H,et al..Method for the production of porcine growth hormone using a synthetic gene in yeast cells[J].Biotechnol.Adv.,1997,15(2):543-543.
[27]Kidd I M,Emery V C.The use of baculoviruses as expression vectors[J].Appl.Biochem.Biotechnol.,1993,42(2-3):137-159.
[28]欧阳菁,龙綮新,杨林,等.猪生长激素基因在昆虫细胞中的分泌表达[J].畜牧兽医学报,2002,33(5):482-485.
[29]朱江,姜秀英,曹广力,等.His-猪生长激素融合基因在BmN细胞和蚕体内的表达与纯化[J].苏州大学学报,2005,21(2):376-382.
[30]Liu Y,Yu L,Guo X,et al..Analysis of tissue-specific region in sericin 1 gene promoter of Bombyx mori[J].Biochem.Biophys.Res.Commun.,2006,342(1):273-279.
[31]Zhong B X,Li J K,Lin J R,et al..Possible effect of 30K proteins in embryonic development of silkworm Bombyx mori[J].Acta Biochim.Biophy.Sin.,2005,37(5):355-361.
[32]陆 改,程廷才,蒋 亮,等.家蚕中肠特异启动子 BmAPN的克隆及活性分析[J].中国农业科学,2012,45(20):4279-4287.
[33]Tamura T, Thibert C, Corinne R, et al.. Germline transformation of the silkworm Bombyx mori L.using a piggyBac transposon-derived vector[J].Nat.Biotechnol.,2000,18(1):81-84.
[34]庄兰芳,危浩,林健荣,等.家蚕 hsp70启动子的克隆及功能研究[J].中国细胞生物学学报,2011,33(5):503-509.
[35]Handler A M.Use of the piggyBac transposon for germ-line transformation of insects [J].Insect Biochem.Mol.Biol.,2002,32(10):1211-1220.
[36]Palmiter R D,Brinster R L,Hammer R E,et al..Dramatic growth of mice that develop from eggs microinjected with metallothionein-growth hormone fusion genes [J].Nature,1982,300(10):611-615.
[37]Vize P D,Michalska A E,Ashman R,et al..Introduction of a porcine growth hormone fusion gene into transgenic pigs promotes growth[J].J.Cell Sci.,1988,90(2):295-300.
[38]Wang H J,Lin A X,Zhang Z C,et al..Expression of porcine growth hormone gene in transgenic rabbits as reported by green fluorescent protein[J].Anim.Biotechnol.,2001,12(2):101-110.
[39]仲 飞,李秀锦,王辛中,等.腺病毒介导的猪生长激素cDNA在大鼠体内的诱导表达及其促生长作用的研究[J].病毒学报,2003,(2):41-45.
[40]Tong J,Lillico S G,Bi M J,et al..Tissue-specific and expression of porcine growth hormone gene in BAC transgenic mice[J].Transgenic Res.,2011,20(4):933-938.
[41]张志红,刘桂生,张玉廉,等.外源猪生长激素基因在金鱼体内的整合与表达研究[J].生物工程学报,1998,14(2):227-229.
[42]Naar E M,Bartke A,Majumdar S S,et al..Fertility of transgenic female mice expressing bovine growth hormone or human growth hormone variant genes[J].Biol.Reprod.,1991,45(1):178-187.

