棉花WRKY基因GhWRKY25的克隆和表达分析
杨淑巧, 王志安, 张安红, 许 琦, 肖娟丽, 罗晓丽
山西农业科学院棉花研究所,山西运城044000
棉花是重要的经济作物,其纤维是世界纺织工业的重要原料。同时棉花还是油料、饲料和其他工业原料的重要来源之一[1]。然而棉花的产量和品质受到虫害、病害和各种逆境的影响,每年因为这些不利因素的影响造成棉花的损失在15%以上[2]。同时在我国存在着粮食作物与棉花种植竞争利用土地的问题,为了保证粮食安全,棉花的种植面积和种植地都要相应发生变化。在不利于粮食作物种植的盐碱地和干旱地种植棉花成为棉花研究的一个方向。目前的研究集中在加强棉花抗逆育种和抗逆栽培上。抗逆棉花品种培育的研究最大的难点是抗逆资源的挖掘,然而常规育种的方法很难有效地获得这些抗逆资源。利用基因工程方法,尤其转基因技术成功培育了一些抗性品种,如商业化推广的转基因抗虫棉。因此,抗逆棉花品种培育可应用转基因手段,加快抗逆材料的获得。克隆有效的抗逆基因成为当今棉花抗逆育种的基础和研究热点。
转录因子WRKY能够调控植物的生长发育和对周围逆境的适应性[3],WRKY 基因家族[4,5]在植物中普遍存在,如已报道的甘薯[6]、欧芹[7]、拟南芥[8]、水稻[9]等,并且该基因家族包含基因数量众多,拟南芥中有74个 WRKY基因[10],水稻中有100多个[9]。WRKY基因家族的主要功能是参与植物对盐碱、干旱和极端温度等逆境的抗性,这与其蛋白的结构密切相关。WRKY蛋白一般包括1~2个WRKY结构域,每个结构域由大约60个氨基酸组成。WRKY结构域有一个高度保守的氨基酸序列WRKYGQK,这也是该结构域名称的来由[11],在该结构域的C端包含一个锌指结构。在植物中WRKY基因分为3类,分别为Ⅰ、Ⅱ和Ⅲ类,Ⅰ类的 WRKY蛋白包含两个WRKY结构域和一个C2H2锌指结构,Ⅱ类和Ⅲ类均只包含一个WRKY结构域,只是Ⅱ类的锌指结构和Ⅰ类相同,而Ⅲ类的锌指结构为C2HC。根据氨基酸序列的差异,Ⅱ类WRKY也可分为5个亚类,分别为ⅡA、ⅡB、ⅡC、ⅡD 和ⅡE[4],其作用的DNA序列顺势因子为W-box,即(T)(T)TGAC(C/T)序 列[7,12]。WRKY 蛋 白 结 合 于W-box调控其下游基因的表达,从而行使其抗逆功能。
虽然目前在棉花中已经有不同的WRKY基因的克隆和功能研究报道,然而相对于拟南芥,棉花中WRKY基因的研究还远远不够。本研究克隆了一个新的WRKY基因GhWRKY25,并对其组织特异表达、激素诱导和干旱盐碱等逆境诱导表达进行了分析。
1 材料与方法
1.1 材料
供试材料为陆地棉品种中棉所35,种植于山西农业科学院棉花研究所温室,28℃,16 h光照/8 h黑暗,常规管理。在棉花生育期中分别摘取棉花幼苗的根、茎、叶和棉花盛花期的蕾、花和铃样品,投入液氮中速冻保存在-80℃冰箱中待用。
1.2 主要试剂与仪器
Trizol试剂、Superscript RIII First Strand Synthesis System试剂盒购自美国Invitrogen公司;大肠杆菌感受态细胞(Trans-T1 Phage Resistant)、BL21(DE3)购自北京全式金生物技术有限公司;DNA酶 I、pGEM-T Easy vector System 购自 Promega公司;SYBR Premix ExTaq、DNA聚合酶及限制性核酸内切酶购自TaKaRa公司;T4 DNA Ligase购自Fermentas公司;琼脂糖凝胶DNA回收试剂盒、质粒小量提取试剂盒购自GENEray公司;PCR纯化试剂盒购自上海生工生物公司;其他试剂均为国产分析纯。克隆测序由三博远志生物技术有限公司提供。ABI-7000定量PCR仪为Applied Biosystem公司产品。
1.3 棉花组织总RNA的提取和cDNA的合成
称取棉花样品100 mg,利用Trizol试剂提取总RNA。在总RNA中加入DNA酶I处理去除残留DNA。然后参照SuperScript R III First-Strand Synthesis System试剂盒方法,获得cDNA用于基因克隆和定量PCR分析(qPCR)。
1.4 GhWRKY25基因的克隆
利用本实验室建立的抗逆棉花叶片差减cDNA文库获得的WRKY基因EST(Expressed sequence tags),用该EST序列获得雷蒙德氏棉花的GrWRKY25序列。根据查找的全长序列设计编码区上下游引物,引物序列为F:5'-atggcagagaaaaggacaag-3'和 R:5'-ttacactcttatctgctcctc-3',以 棉 花cDNA为模板扩增全长。其产物用1%琼脂糖凝胶电泳检测,在紫外灯下将目的片段切胶回收,连接到PGEM-T easy vector载体上,转化大肠杆菌感受态,进行蓝白斑筛选,挑取白斑,菌落PCR检测后,将阳性克隆测序。
1.5 GhWRKY25序列分析和系统进化树构建
在NCBI中选取不同植物的WRKY25的氨基酸序列,利用ClustalW2对比氨基酸序列,并进行结构域的分析。在数据库中选取不同类型的WRKY蛋白,利用 MEGA4.0程序来构建有关WRKY蛋白的进化树。
1.6 qPCR检测棉花中GhWRKY25表达的组织特异性
提取棉花的根、茎、叶、蕾、花和幼铃等器官的总RNA,反转录成cDNA,以cDNA为模板进行定量PCR,检测GhWRKY25基因在不同部位的表达。GhWRKY25基因扩增的引物为WRKY-F:5'-gggaaccctcatccaaggag-3'和WRKY-R:5'-cgtcgtggttatgcttcc-3'。以 ubiquitin基因(登录号:AY189972)为内参基因,引物为Ubi-F:5'-AAGACCTACACCAAGCCCAAG-3'和Ubi-R:5'-ACACTCCGCATTAGGACACTC-3'。qPCR 反应体系为 25 μL,以定量稀释后的cDNA 0.5 μL为模板。扩增条件为:95℃,1min;95℃,5 s;59℃,30 s;72℃,30 s;78℃,82℃,85℃各读板一次,设置40个循环,绘制熔解曲线。设3次重复。运用Opticon Monitor 2软件计算样品的Ct值,并采用2-△△Ct计算方法求得样品的相对表达量。
1.7 qPCR检测不同处理条件下GhWRKY25的表达水平
中棉所35种子在温室中种植,选取长势一致的子叶期幼苗用来做不同处理。处理后的样品提取总 RNA,反转录成 cDNA,定量 PCR检测GhWRKY25基因的表达水平变化。qPCR反应条件及参考基因同1.6。
1.7.1 盐处理 用300mmol/L NaCl浇灌棉花苗,模拟盐胁迫条件。用清水处理的棉苗作为对照,每个处理3次重复。在处理后0 h、2 h、4 h、8 h和12 h时间点取植株叶片放入液氮中速冻,保存在-80℃冰箱中待用。
1.7.2 干旱处理 连续12 d停止浇水,直至叶片出现萎蔫。正常浇水的植株作为对照。在处理后0 d、2 d、4 d、6 d、8 d、10 d 和 12 d 时间点取早晨萎蔫回复的叶片和正常浇水的植株叶片,放入液氮中速冻,保存在-80℃冰箱中待用。
1.7.3 激素处理 对棉花苗进行不同激素的处理,处理的方法按照文献报道进行[13]。喷洒激素的浓度分别为JA 100mmol/L、SA 2mmol/L、ABA 50 μmol/L、GA 1 μmol/L。处理后不同时间点取植株叶片放入液氮中速冻,保存在-80℃冰箱中待用。
2 结果与分析
2.1 GhWRKY25基因的克隆和编码氨基酸序列的结构分析
利用扣除差减杂交(suppression subtractive hybridization,SSH)方法对干旱处理的棉花表达进行分析,获得一个与干旱相应相关的EST库,对所获得的序列进行分析,筛选出一个与拟南芥WRKY25同源的WRKY基因EST,利用这个EST序列在雷蒙德氏棉花的基因组序列库里获得了该基因的全长,为1 551 bp。利用这个基因序列设计特异引物在陆地棉cDNA中进行扩增分离得到了基因序列一致的 WRKY序列,定名为GhWRKY25。进行氨基酸序列同源比对后可看出,GhWRKY25与苜蓿和拟南芥WRKY3的同源性较高,同源性分别达到96%和73%(见图1)。同时我们发现GhWRKY25包含有两个典型的WRKY结构域和 C2H2锌指结构,属于Ⅰ类WRKY转录因子。
2.2 GhWRKY25的系统进化树分析
选取了不同植物且包括不同类的WRKY蛋白与 GhWRKY25进行系统进化树的构建,见图2。可以看出,GhWRKY25和其他植物的WRKY3蛋白具有较高的亲缘关系,属于Ⅰ类WRKY,与可可(Theobroma cacao)WRKY3具有高度的亲缘关系。该进化树也表明了WRKY在植物中不断进化和变异的情况,说明WRKY在植物中执行着重要的生理和生化功能。
2.3 GhWRKY25的组织特异性分析
在转录水平分析GhWRKY25基因在棉花的根、茎、叶、蕾、花和幼铃等器官的表达,结果表明GhWRKY25基因在这些器官中均有表达(见图3),说明该基因是一个组成型表达基因,同时发现其在花中的表达量较高,在蕾的表达量较低,暗示该基因行使功能可能存在组织特异性。
2.4 不同激素处理下GhWRKY25表达分析
植物激素与植物的抗逆过程密切相关,在逆境胁迫条件下,植物激素含量发生变化,从而影响一系列生理生化反应以及有关基因的表达。为了研究GhWRKY25基因对不同激素的响应,同时分析它在不同激素途径中可能的分子机理,我们利用SA、JA、ABA和GA3对棉花进行处理,在转录水平分析其表达量,结果表明GhWRKY25在SA、JA、ABA和GA3处理下均在一段时间内表现为上调表达。SA处理后GhWRKY25基因表达的上调幅度不如其他三个激素信号分子,JA、ABA和GA3处理后其表达均表现为先剧烈上升然后开始回落(见图4)。而这三种激素处理使GhWRKY25基因的表达达到峰值的时间依次滞后约2 h。说明该基因能够对这些激素产生应答,但是应答模式不完全一致。
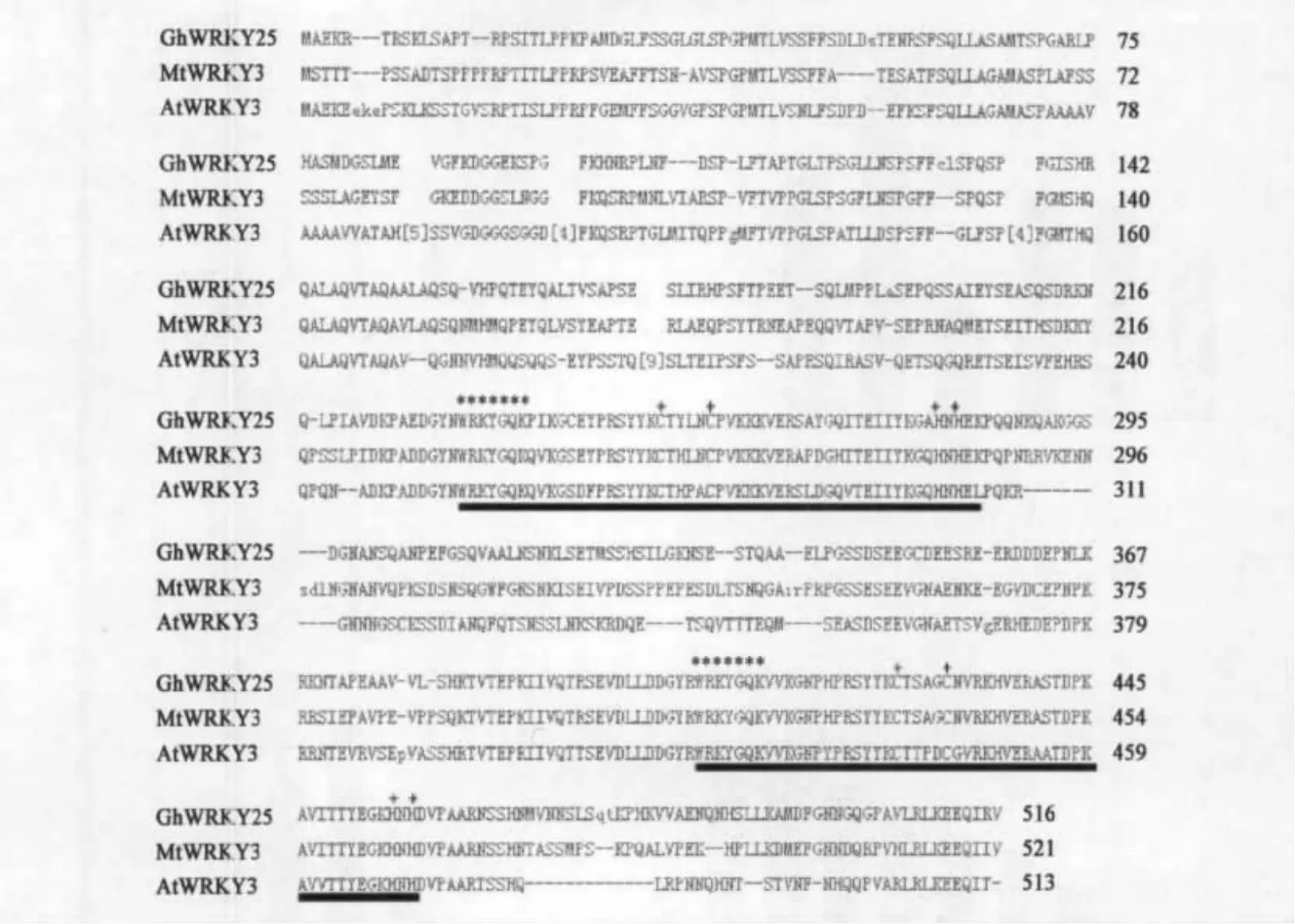
图1 GhWRKY25与MtWRKY3、AtWRKY3氨基酸序列的同源性比对Fig.1 Alignment of the amino acid sequences of GhWRKY25 with MtWRKY3 and AtWRKY3.
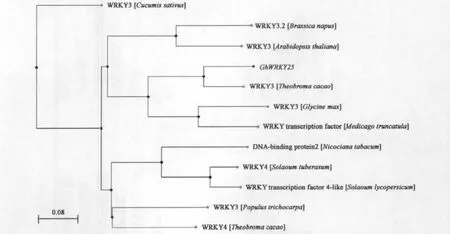
图2 GhWRKY25和其他植物WRKY的系统进化树Fig.2 Phylogenetic tree of GhWRKY25 and other plant WRKY proteins.
2.5 干旱和盐处理下GhWRKY25的表达分析
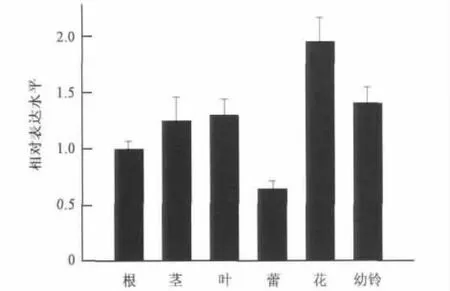
图3 GhWRKY25在不同组织器官的表达Fig.3 Expression patterns of GhWRKY25 in different tissues.
盆栽棉花被停止浇水12 d后出现了萎蔫现象,分析在此期间每隔2 d GhWRKY25基因表达水平的变化,结果表明GhWRKY25基因被显著地诱导(见图5),其表达量是对照的 4倍。用300mmol/L NaCl处理棉花,在不同时间点取样进行qPCR分析,结果表明盐处理的棉花叶片中Gh-WRKY25基因表达显著提高,尤其在处理后8 h,转录水平最高,是水处理的3.6倍(见图5)。上述结果提示GhWRKY25基因与干旱和盐逆境显著相关,表明该基因可能在逆境适应上具有重要的功能。
3 讨论
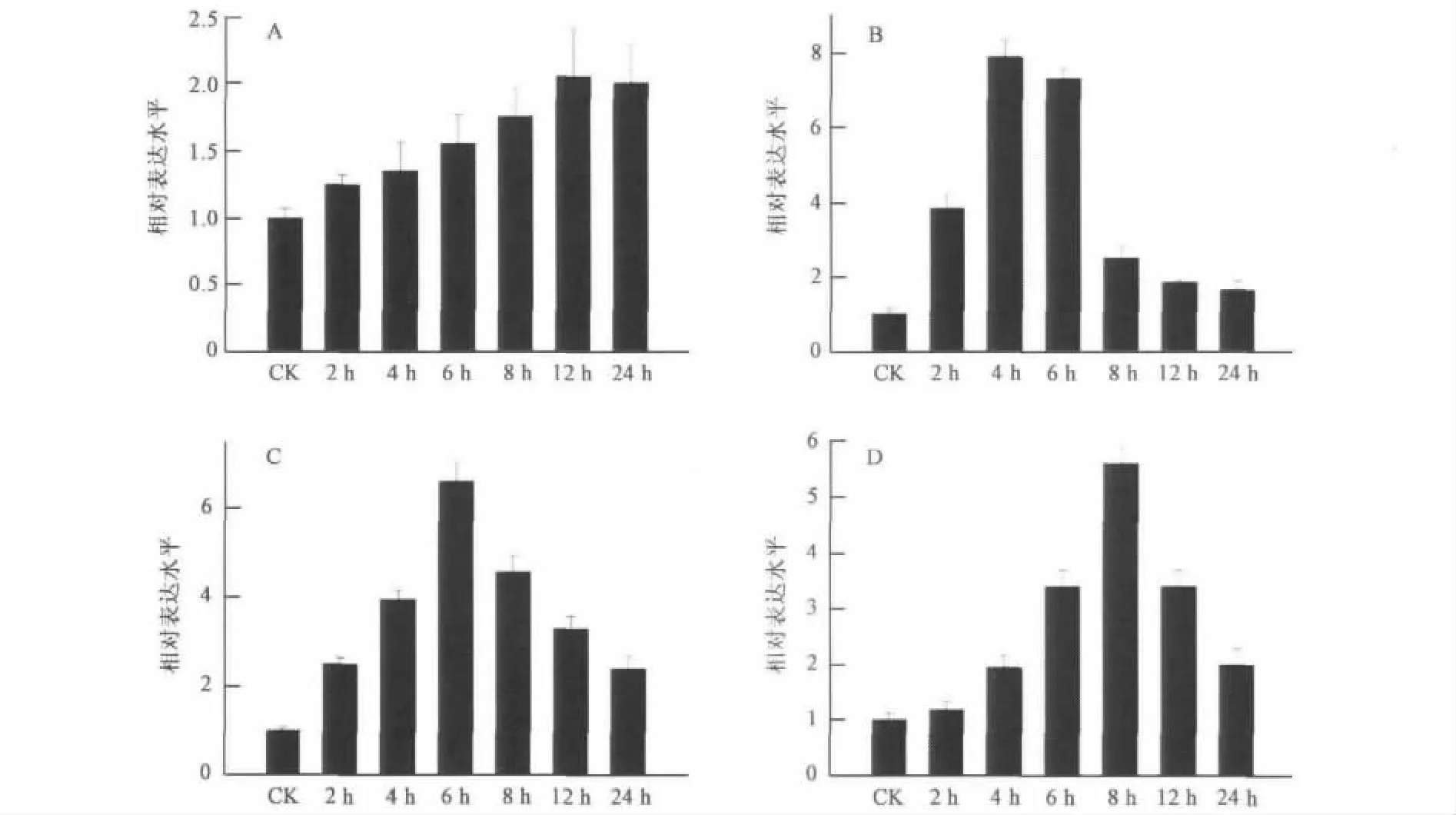
图4 不同激素信号分子的处理下GhWRKY25的表达Fig.4 Expression patterns of GhWRKY25 after treatments by various hormone signaling molecules.
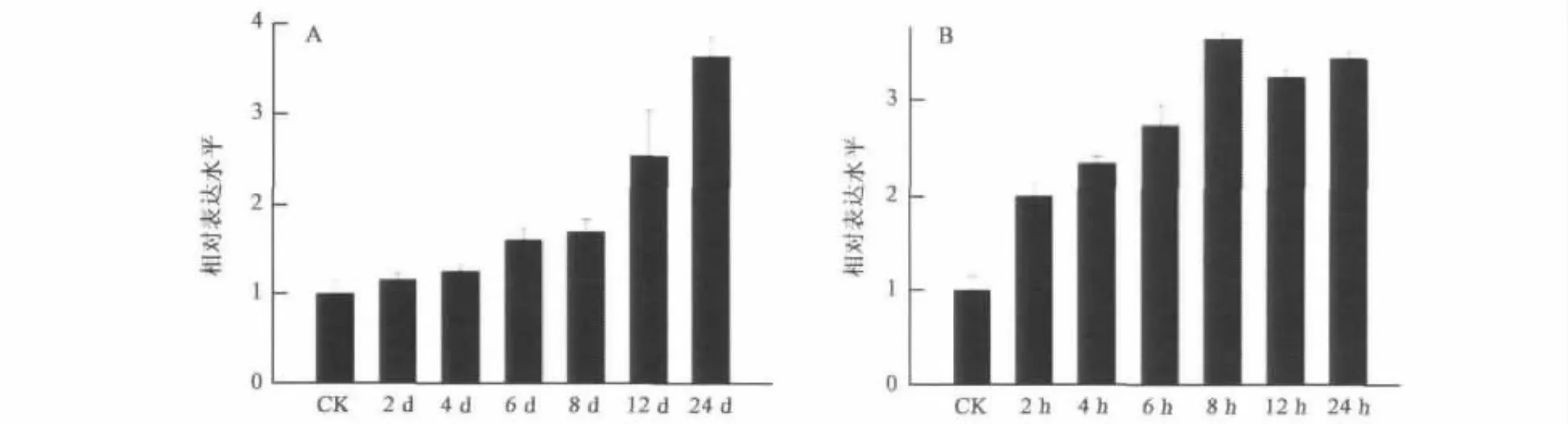
图5 干旱和盐处理下GhWRKY25的表达Fig.5 Expression patterns of GhWRKY25 under drought and salt stresses.
GhWRKY25基因是棉花众多WRKY基因中一员,在棉花中该基因家族包含数十种甚至上百种这类转录因子,这些转录因子行使着多种功能,其中包括对外界不良环境的适应等。这些基因在植物的生长发育和生理生化中起着重要的作用。
GhWRKY25在棉花各组织器官中均有表达,但在花和蕾中表达水平差异较明显,蕾中表达量最低,而花中表达量上升至最高。提示其抗逆性调节与调节植物开花时间有关。与已知的一些棉花WRKY基因在各组织表达水平无明显差异有所不同。GhWRKY25很可能作为一个与发育有关的关键因子,为深入研究棉花在逆境中的发育成熟机制提供可能。
从其他种类植物克隆得到的可响应逆境的WRKY基因,过表达时一般能够提高植物的抗逆性[4,14,15],与之相似的是,GhWRKY25 对干旱和盐逆境的响应也为上调表达,该基因可能在这些逆境下,参与调控逆境适应性相关基因的表达,从而产生抗逆性。在棉花中已经分离出几个能够对干旱和盐胁迫产生抗性的WRKY,如GhWRKY3[16]、GhWRKY40[17]、GhWRKY39 等[18]。我们所分离的GhWRKY25作为一个新的WRKY基因,可能成为棉花抗逆分子育种的候选基因。
已知SA等多种激素在逆境胁迫中发挥重要作用。GhWRKY25基因对多种激素 SA、JA、ABA和GA具有应答反应,暗示着这个基因对棉花的抗逆功能可能是通过这些激素信号分子及其信号通路进行的。在拟南芥、水稻等植物[19~21]的研究中,有一些类似的报道也表明WRKY是通过参与激素信号转导途径,从而调控下游抗逆基因的表达。
[1]赵绪福.浅议中国棉花生产发展问题[J].农业技术经济,2003,(6):45-48.
[2]喻树迅,范术丽.我国棉花遗传育种进展与展望[J].棉花学报,2003,15:120-124.
[3]Rushton P J,Somssich I E, Ringler P, et al.. WRKY transcription factors[J].Trends Plant Sci.,2010,(15):247-258.
[4]Eulgem T,Rushton P J,Robatzek S,et al..The WRKY superfamily of plant transcriptional factors[J].Trends Plant Sci.,2000,5:199 -206.
[5]Ulker B,Somssich I E.WRKY transcription factors:From DNA binding towards biological function[J].Curr.Opin.Plant Biol.,2004,7:491 -498.
[6]Ishiguro S,Nakamura K.Characterization of a cDNA encoding a novel DNA-binding protein,SPF1,that recognizes SP8 sequences in the 5'upstream regions of genes coding for sporamin and β-amylase from sweet potato[J].Mol.Gen.Genet.,1994,244(6):563 -571.
[7]Rushton P J,Torres J T,Parniske M,et al..Interaction of elicitor-induced DNA-binding proteins with elicitor response elements in the promoters of parsley PR1 genes[J].EMBO J.,1996,15(20):5690-5700.
[8]de Pater S,Greco V,Pham K,et al..Characterization of a zinc-dependent pendent transcriptional activator from Arabidopsis[J].Nucleic Acids Res.,1996,24(23):4625-4632.
[9]Zhang Y, Wang L. The WRKY transcription factor superfamily:its origin in eukaryotes and expansion in plants[J].BMC Evol.Biol.,2005,(5):1.
[10]Qu L J,Zhu Y X.Transcription factor families in Arabidopsis:major progress and outstanding issues for future research[J].Curr.Opin.Plant Biol.,2006,(9):544 -549.
[11]Xing D H,Lai Z B,Zheng Z Y,et al..Stress and pathogeninduced Arabidopsis WRKY48 is a transcriptional activator that represses plant basal defense[J].Mol.Plant,2008,1(3):459-470.
[12]Ciolkowski I,Wanke D,Birkenbihl R P,et al..Studies on DNA-binding selectivity of WRKY transcription factors lend structural clues into WRKY-domain function[J].Plant Mol.Biol.,2008,68(1 -2):81 -92.
[13]李光雷.棉花GhWRKY11基因的克隆及功能验证[D].北京:中国农业科学院,硕士学位论文,2012.
[14]Pandey S P,Somssich I E.The role of WRKY transcription factors in plant immunity[J].Plant Physiol.,2009,150:1648-1655.
[15]Rushton P J,Somssich I E.Ringler PWRKY transcription factors[J].Cell,2010,15:1360 -1385.
[16]Guo R,Yu F,Gao Z,et al..GhWRKY3,a novel cotton(Gossypium hirsutum L.)WRKY gene,is involved in diverse stress responses[J].Mol.Biol.Rep.,2011,38:49 -58.
[17]Wang X,Yan Y,Li Y,et al..GhWRKY40,a multiple stressresponsive cotton WRKY gene,plays an important role in the wounding response and enhances susceptibility to ralstonia solanacearum infection in transgenic Nicotiana benthamiana[J].PLoS ONE,2014,9(4):e93577.
[18]Shi W,Hao L,Li J,et al..The Gossypium hirsutum WRKY gene GhWRKY39-1 promotes pathogen infection defense responses and mediates salt stress tolerance in transgenic Nicotiana benthamiana[J].Plant Cell Rep.,2014,33(3):483-498.
[19]Cheong Y H,Chang H S,Gupta R,et al..Transcriptional profiling reveals novel interactions between wounding,pathogen,abiotic stress,and hormonal responses in Arabidopsis[J].Plant Physiol.,2002,129:661 -677.
[20]Dang F F,Wang Y N,Yu L,et al..CaWRKY40,a WRKY protein of pepper,plays an important role in the regulation of tolerance to heat stress and resistance to Ralstonia solanacearum infection[J].Plant Cell Environ.,2012,36:757 -774.
[21]Dong J,Chen C,Chen Z,et al..Expression profiles of the Arabidopsis WRKY gene superfamily during plant defense response[J].Plant Mol.Biol.,2003,51:21 -37.

