转vgb基因油菜的耐涝性
李培玉, 张 锐, 孙国清, 马 林, 薛计雄, 林 芹, 郭三堆
1.中国农业科学院生物技术研究所,农作物基因资源与基因改良国家重大科学工程,北京100081;
2.新疆农业大学农学院,乌鲁木齐830052
油菜是我国重要的油料作物和蛋白质饲料作物,也是食用植物油的主要来源之一。我国油菜种植面积以及总产量占世界的三分之一,是世界上最大的油菜产区[1]。但我国油菜产区降水量较大,经常会发生严重的涝害[2,3]。涝害严重影响了我国油菜产业的发展,因此提高油菜的耐涝能力对于我国油菜可持续发展具有非常重大的意义。
涝害的本质并不是植株体内水分的不断积累增加,而是长时间缺氧使根系功能减弱导致植物代谢途径的改变,并产生许多有害物质,如二氧化碳、硫化物等,进而影响植物的正常生长和发育,随着危害程度的增加造成严重的伤害和减产[4~6]。而且由于缺氧造成作物根系损伤,植株在涝害解除以后也很难恢复生长,具有明显的滞后效应[7]。因此,如何提高油菜抗涝害能力是当前制约油菜可持续发展的瓶颈问题。
当前,改良作物的耐涝能力主要是提高其无氧生活环境的适应能力。Quimio等[8]在水稻渍水胁迫的研究中发现,厌氧环境下,转基因植株PDC酶活性和乙醇的合成率减少了50%。在渍水胁迫过程中,通过限制酶活性的提高从而加快了代谢过程,进而提高了终产物乙醇的合成。一些转录因子也与作物耐渍性相关,但目前为止,只在拟南芥中发现了一个转录因子AtMYB2[9]。
透明颤菌血红蛋白(Vitreoscilla haemoglobin,VHb)是研究比较成熟的一种加氧蛋白(Vgb)。最初由Khosla等[10]从透明颤菌中克隆得到,并在大肠杆菌和酵母中表达,可以加强细胞的呼吸强度,降低细胞的临界氧浓度,提高细胞的生长速率,使细胞在低氧甚至无氧条件下仍能保持生长优势[11~13]。已有将vgb基因引入植物细胞的研究,实验证明该基因也可使转基因植物发芽提前,并加快植物的生长,这可能与该基因可以增加细胞中的氧浓度相关[14]。
本研究首次通过基因工程手段将透明颤菌血红蛋白基因过表达转入油菜,验证其在油菜增产和抗涝方面的功能和作用,为vgb基因在油菜中的表达所产生的生物量和生理代谢变化提供了数据,为农作物抗涝研究提供了理论依据。
1 材料与方法
1.1 试验时间、地点
本研究田间试验于2010-2011年在湖北麻城进行。
1.2 试验材料
甘蓝型油菜中双10号,由本实验室保存。大肠杆菌菌株E.coli TOP10、质粒pBI121,由本实验室保存。其他质粒均购自Promega公司。
1.3 表达载体的构建及转化
用PstⅠ和 XhoⅠ双酶切 pGSKA质粒和pG4ASVHB质粒,得到pGSKA载体(4 kb)和vgb(452 bp)基因片段,经过回收、连接,鉴定后得到中间载体pGSVKA。EcoRⅠ和HindⅢ双酶切中间载体pGSVKA,回收表达盒基因片段,克隆于pBI121质粒中,并命名为pGBISVKA(见图1)。
在油菜盛花期将已经授粉的花朵摘去,采用直接喷花法或蘸花法转化油菜花朵,转化后的花朵做好标记。
1.4 卡那霉素检测
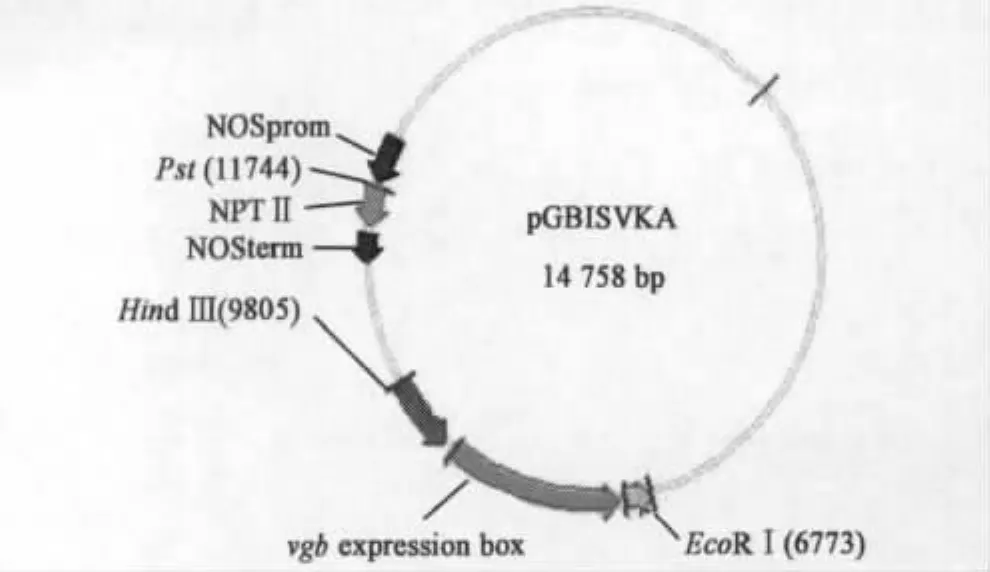
图1 pGBISVKA质粒载体图谱Fig.1 Map of pGBISVKA plasmid vector.
选择晴朗、无风天气的午后,配制2 000 mg/L的卡那霉素溶液,取脱脂棉浸入卡那霉素的溶液,然后贴附在油菜叶片的表面,或用喷壶将卡那霉素溶液均匀喷洒在油菜叶片表面,一周后观察试验结果。卡那霉素敏感植株的叶片在接触卡那霉素处呈黄色,不敏感植株的叶片无变化。
1.5 PCR 检测
按照Joobeur等[15]的方法提取油菜基因组。根据vgb基因的CDS序列设计引物:vgbF:5'-ggctgcaggcttgatcaacagac-3'和 vgbR:5'-agctcgagctcaacagcttgagcgtac-3'。以转基因油菜基因组DNA为模板,进行PCR扩增。PCR体系50 μL:1 μL基因组 DNA,5 μL 10 × PCR buffer,5 μL dNTPs,1 μL vgbF(10 μmol/L),1 μL vgbR(10 μmol/L),0.5 μL Taq 酶(2.5 U/μL),ddH2O 38.5 μL。PCR扩增程序为:95℃ 5min;95℃ 30 s,63℃ 30 s,72℃ 2.5min,35 个循环;72℃ 5min。4℃,保存。电泳检测结果。
1.6 Southern 杂交检测
Southern杂交检测采用地高辛随机引物标记法标记探针,化学发光检测技术进行检测[16]。
1.7 耐涝性检测
油菜的淹水试验在经人工处理的不渗漏的淹水池进行。普通田地向下挖40~45cm,铺设防水塑料布,然后用土填平,旁边起埂,施肥后人工播种,在油菜花期进行为期15 d的淹水实验,每天下午6点人工往淹水池里灌水,水面保持在油菜根部4~5cm处。淹水结束后从转基因株系中挑选出生长状况基本一致的15个株系进行生理指标测定[17,18],包括丙二醛、脯氨酸和超氧化物歧化酶的测定,进行3次重复。然后拔出,洗净,比较在淹涝条件下根部的形态变化。试验采用三重复随机区组设计试验。
1.8 统计分析
对原始数据进行标准化处理,用SPSS11.0软件进行方差分析。
2 结果与分析
2.1 转基因植株的卡那霉素筛选
在油菜的苗期用卡那霉素筛选,先采用大面积喷洒卡那霉素溶液进行初筛,然后将不变色的油菜用脱脂棉浸泡卡那霉素溶液后,贴在油菜叶片表面,最终获得转基因阳性植株11株。
2.2 PCR 鉴定
提取转基因油菜叶片的基因组DNA,以稀释10倍的基因组为模板,以vgbF和vgbR为引物,以非转基因油菜为对照,以pGBISVKA质粒为阳性对照进行 PCR,转基因植株样品扩增出约450 bp条带,与预期的长度完全一致,而阴性对照材料(中双10号)PCR扩增结果未出现相应的电泳图谱,如图2所示。
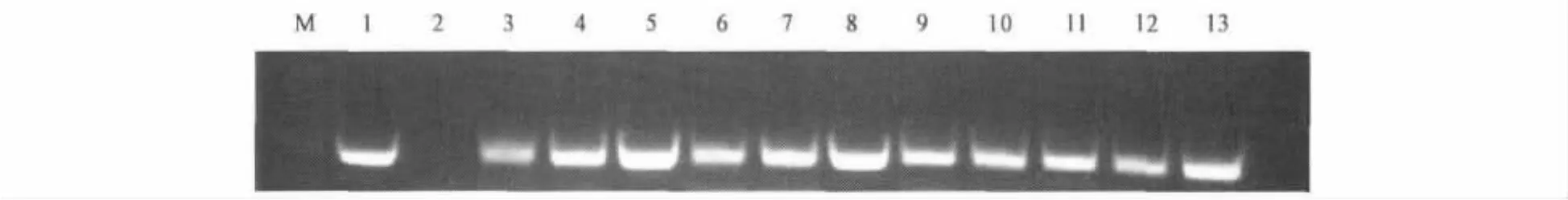
图2 PCR鉴定转vgb基因油菜植株Fig.2 PCR identification of vgb transgenic plants.
2.3 Southern 杂交分析
为了检测外源基因在油菜基因组中的整合情况,对转基因植株基因组DNA进行EcoRⅠ单酶切,以vgb基因标记探针开展Southern杂交,结果见图3。Southern杂交结果显示,转基因株系中出现了两条明显杂交条带,表明所检测的转基因油菜是双拷贝整合。
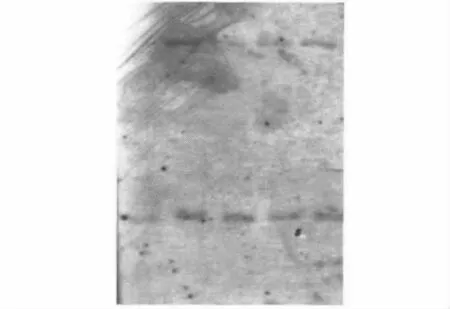
图3 转vgb基因植株的Southern blot分析Fig.3 Southern blot detection of vgb transgenic plants.
2.4 转基因油菜耐涝性分析
2.4.1 涝渍胁迫处理对转vgb基因油菜脯氨酸含量的影响 在正常供水条件下(见图4),转基因油菜和对照植株叶片脯氨酸含量较为正常,各材料之间脯氨酸含量差异不显著。但是在淹水条件下,各材料的脯氨酸含量均出现不同程度的变化,非转基因植株11~15在其淹水前后变化很明显,脯氨酸含量较高,而转基因植株1~10变化不明显。说明转vgb基因的油菜在淹水过程中已经基本适应了淹水的环境,已不需要脯氨酸的调节,但对照油菜则受到淹水的危害很严重,且很难恢复正常水平。
2.4.2 淹涝胁迫处理下对油菜SOD活力的影响对油菜进行为期15 d的淹涝实验,采集样品测定SOD酶活,结果如图5所示。在正常供水条件下,转基因油菜和对照SOD酶活的差异不明显。而在淹水条件下,测得转基因植株的SOD酶活性虽然有所降低,但与正常供水情况差距并不明显,而对照植株的 SOD酶活性显著下降,约50%的降幅。与对照相比,淹水条件下,转基因植株的SOD酶活保持相对稳定。而SOD酶活性的急剧变化,暗示着产生的SOD不能够完全清除氧自由基,积累的氧自由基可能会对植物体产生损害,造成损失。实验结果显示的转vgb基因油菜的SOD酶活性受淹水影响较小,说明植株已经适应了淹涝环境,并且SOD的合成已经逐渐恢复,这有利于油菜的体内的自由基的清除,使损失降低。
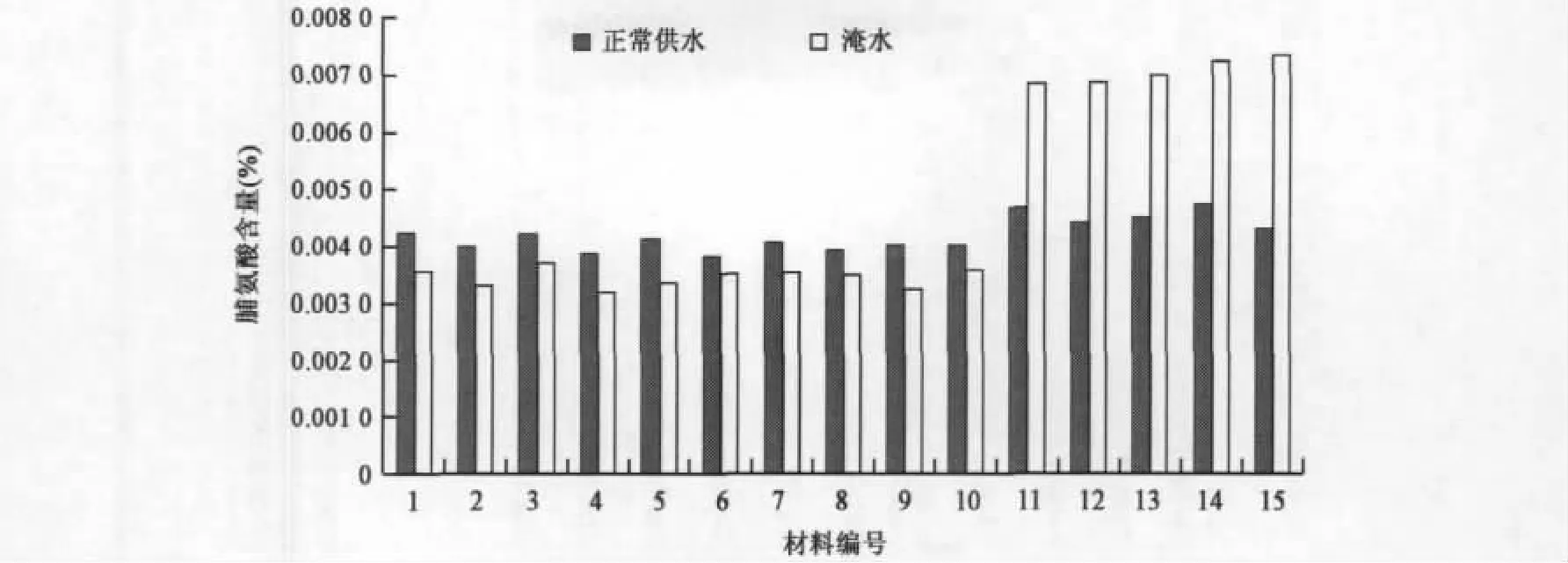
图4 脯氨酸的含量在转基因植株和对照间的区别Fig.4 Differences of proline contents between transgenic lines and the control.
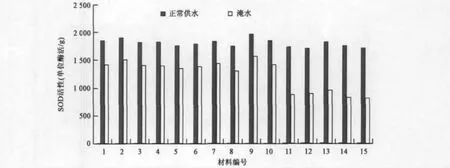
图5 SOD的含量在转基因植株和对照间的区别Fig.5 Differences of SOD contents between transgenic lines and the control.
2.4.3 油菜淹涝胁迫下对转基因油菜丙二醛含量的影响 在干旱、水涝等条件下,植物体内常发生质膜过氧化作用,破坏膜系统,导致植物受到伤害。MDA是细胞质膜不饱和脂肪酸过氧化的产物,其含量的高低可作为膜质过氧化的指标,当细胞内MDA的量增加时,表明细胞膜受伤害程度的加深。MDA检测结果表明:在正常条件下,转基因油菜的MDA值和对照相差不大,但是在淹涝条件下,对照的MDA的量明显上升,统计分析表明,对照油菜的MDA值比转基因油菜的高,且差异显著(见图6)。
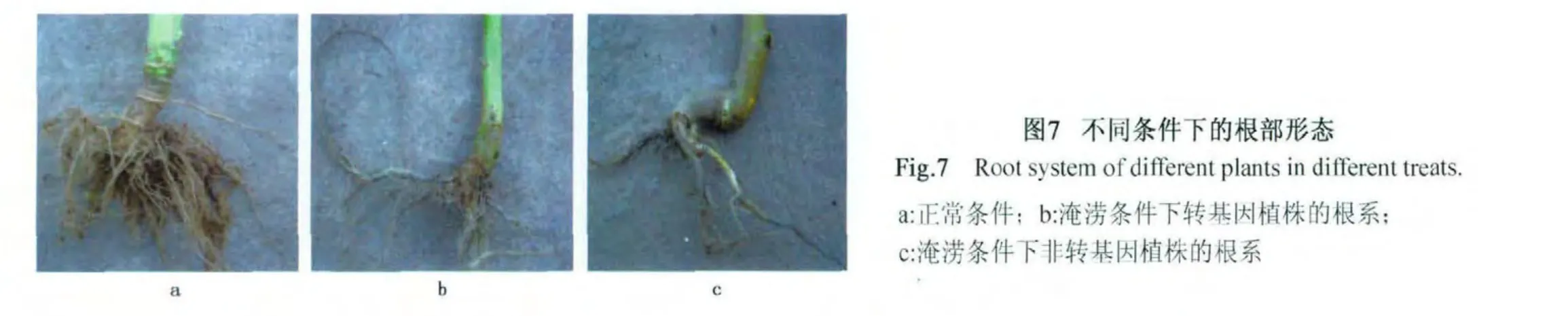
2.4.4 油菜淹涝胁迫下根部变化 为了研究转基因植株的耐涝性,对转基因株系进行大量扩繁,选取生长一致的转基因植株和非转化对照植株,在淹水条件下转基因油菜根部同对照植株的比较,结果如图7(彩图见封三图版)所示。从图中看出,转基因油菜虽然侧根很多,但是碳化严重,非转基因油菜侧根较少,碳化相对轻微,差别不明显。
3 讨论
通过基因工程手段来实现对植物抗逆性的改良已成为人们关注的重点。本研究通过引入外源vgb基因,可降低细胞的临界氧浓度,增强细胞的呼吸强度,从而提高细胞生长速率,进而加快植物生长速率。VHb还可以通过促进呼吸作用来增加ATP的浓度,间接地促进植物的光合作用和生长。在实验中还检测了叶绿素含量,与对照相比,转基因植株的叶绿素含量增加,同时光合作用也得到增强,从而加快了植物的生长。另一方面,转vgb基因的植株可以保证氧浓度水平的相对稳定,减少无氧呼吸,从而避免不必要的能量浪费。

图6 MDA的含量在转基因植株和对照间的区别Fig.6 Differences of MDA contents between transgenic lines and control.
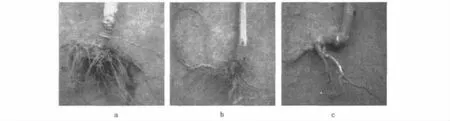
图7 不同条件下的根部形态Fig.7 Root system of different plants in different treats.
在扩繁过程中进一步发现,这一基因的转入可以增加油菜的生物量,提高种子萌发率,缩短萌发时间,提高油菜籽的产量,起到增产的作用。
通过对油菜进行淹涝实验表明:转入vgb基因的油菜具有明显的抗涝能力。当非转基因油菜的根部缺氧后,其能量代谢逐渐转变为以糖酵解、乙醇和乳酸发酵等途径为主,这样不仅会造成物质能量的大量消耗,而且会产生大量氧自由基、乳酸、乙醇等有害物质,从而造成根系的吸收大幅降低,叶片死亡,光合作用下降甚至停止。而转基因植株中,VHb与氧有着很强的亲和能力,能够清除氧自由基,改变氧化磷酸化效率,抑制种子中不饱和脂肪酸氧化功能,增强了油菜根部同氧的结合能力。并且VHb位于整个胞质中,可以使细胞能够维持相对稳定的氧浓度水平,进而提高了植株的抗涝能力。
[1]涂金星,张冬晓,张毅,等.我国油菜育种目标及品种审定问题的商榷[J].中国油料作物学报,2007,29(3):350-352.
[2]刘后利.实用油菜栽培学[M].上海:上海科学技术出版社,1987.
[3]张学昆,陈洁,王汉中,等.不同遗传性状油菜的抗涝行分析[J].中国油料作物学报,2007,29(2):98-102.
[4]Voesenek L A,Colmer C D,Pierik R,et al..How plants cope with complete submergence[J].New Phytol.,2006,170:213-226.
[5]Levitt J.Responds of Plants to Environmental Stress[M].NewYork:Academic Press,1980,13-222.
[6]Zhou G S,Zhu X T.Changes of physiological characters of wheat after waterlogging and relations between physiological characters and waterlogging tolerance of different varieties[J].Sci.Agric.Sin.,2002,35(7):777 -783.
[7]Tang Z C.Reaction and adaptation of plants under water stress[J].Plant Physiol.Commun.,1983,3:24 -29.
[8]Quimio C A,Torrizo L B,Setter T L,et al..Enhancement of Submergence tolerance in transgenicrice overproducing pyruvate decarboxylase[J].J.Plant Physiol.,2000,156:516-521.
[9]何激光.渍害对油菜生理特性及农艺性状的影响[D].长沙:湖南农业大学,硕士学位论文,2011.
[10]Khosla C,Bailey J E.The Vitreoscilla hemoglobin gene:molecular cloning,nucleotide sequence and genetic expression in Escherichia coli[J].Mol.Gene Genet.,1988,214:158 -161.
[11]Holmberg N,Lilius G,Bailey J E,et al..Transgenic tobacco expressing Vitreoscilla hemoglobin exhibits enhanced growth and altered metabolite production[J].Nat.Biotechnol.,1997,15:244-247.
[12]Khosla C,Bailey J E. The Vitreoscilla hemoglobin gene:Molecular cloning,nucleotide sequence and genetic expression in Escherichia coli[J].Mol.Gene Genet.,1988,214:158-161
[13]Liu S C,Liu Y X,Webster D A.Sequence of the region downstream of the Vitieoscilla hemoglobin gene:vgb is not pare of a multigene operon[J].Appl.Microbiol.Biotechno1.,1994,42:304.
[14]Roberts J K, Callis J, JardetskyO, et al.. Cytoplasmic acidosis as a determinant of flooding intolerance in plants[J].Proc.Natl.Acad.Sci.USA,1984,81:6029 -6033.
[15]Joobeur T,Gusm in i G,Zhang X,et al..Construction of a watermelon BAC library and identification o f SSRs anchored to melon or Arabidopsis genomes[J].Theor.Appl.Genet.,2006,112:1553-1562
[16]周长发,张锐,张晓,等.地高辛随机引物法标记探针的Southern杂交技术优化[J].中国农业科技导报,2009,11(4):123-128.
[17]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学技术出版社,1999.
[18]白宝璋,汤学军.植物生理学测试技术[M].北京:中国科学技术出版社,1993,73-157.

