复合诱变选育高效转化DHEA为7α,15α-diOH-DHEA的菌株及其转化工艺优化
李传鹏,李会,吴燕,李恒,张汝金,张峥斌,史劲松,许正宏
1江南大学药学院,江苏无锡214122
2浙江仙居君业药业有限公司,浙江台州317300
复合诱变选育高效转化DHEA为7α,15α-diOH-DHEA的菌株及其转化工艺优化
李传鹏1,李会1,吴燕1,李恒1,张汝金2,张峥斌2,史劲松1,许正宏1
1江南大学药学院,江苏无锡214122
2浙江仙居君业药业有限公司,浙江台州317300
李传鹏,李会,吴燕,等.复合诱变选育高效转化DHEA为7α,15α-diOH-DHEA的菌株及其转化工艺优化.生物工程学报,2014,30(1):147−156.
Li CP,Li H,Wu Y,et al.Optimization of hydroxylating DHEA to 7α,15α-diOH-DHEA by compound mutation and fermentation optimization.Chin J Biotech,2014,30(1):147−156.
结合酮康唑抗性筛选法,采用亚硝基胍和低能氮离子注入复合诱变方法筛选得到一株高效生物转化去氢表雄酮(DHEA)为3β,7α,15α-三羟基雄甾-5-烯-17-酮(7α,15α-diOH-DHEA)的菌株亚麻刺盘孢Colletotrichum lini ST-1,该突变株在底物DHEA投料浓度为10 g/L时产物摩尔得率达到34.2%,较出发菌株提高了46.2%。在此基础上进行培养基组分的优化,采用Plackett-Burman实验设计考察转化培养基中各组分对产物摩尔得率的影响,有效筛选出葡萄糖、酵母粉和MgSO4·7H2O浓度对产物摩尔得率影响显著,继而采用最陡爬坡路径逼近最大响应区域,并利用中心组合响应面设计实验对3个显著性因素的最佳水平进行研究,得到最适转化培养基组分为(g/L):葡萄糖26.34;酵母粉12.15;玉米浆3.00;FeSO4·7H2O 0.015;MgSO4·7H2O 0.14;KH2PO40.90。采用该优化培养基,菌株C.lini ST-1的产物摩尔得率达到49.3%,较优化前提高了44.2%。
亚麻刺盘孢,生物转化,复合诱变,培养基优化,响应面法
甾体激素药物对机体有重要的调节作用,广泛应用于医药行业,其市场价值仅次于抗生素,在生物技术的推动下,其生产已经成为医疗保健行业的重要分支[1-4]。去氢表雄酮(DHEA)是自然界生物体内重要的活性物质,其双羟化产物3β,7α,15α-三羟基雄甾-5-烯-17-酮(7α,15α-diOHDHEA)是第4代口服避孕药有效成分屈螺酮的重要前体[5-6]。
生物转化是一种有效的工具,与化学合成相比,反应条件温和、具有较强的区域和立体选择性,可以完成一些化学方法难以合成化合物的制备,并且已广泛应用于甾体化合物的合成[7-9]。近年来生物转化DHEA的研究越来越受到关注,尚珂等[10]采用亚麻刺盘孢Colletotrichum lini AS 3.4486对DHEA进行生物转化,并且对其羟化机理进行了初步探究。Romano等[11]应用C.lini在N,N-二甲基甲酰胺助溶、添加辅底物葡萄糖和Tween-80分散条件下对DHEA进行批次转化,在DHEA总投料浓度为7 g/L时能得到5.8 g/L的7α,15α-diOH-DHEA。Lobastova等[12]分别采用尖孢镰刀菌Fusarium oxysporum VKM F-1600和赤霉菌Gibberella zeae BKM F-2600转化DHEA,在投料浓度为2 g/L时产物摩尔得率分别达到63.0%和68.0%。但是仍然存在菌株转化效率不高、底物投料浓度低等缺点,成为DHEA生物转化工业化应用的瓶颈[13]。因此,通过筛选或改良获得一株高效转化DHEA的菌株具有重要的意义。
发酵过程参数的优化通常采用单因素实验,但是操作周期长,无法考察各因素之间的相互关系。Plackett-Burman实验设计是一种两水平、基于不完全平衡块原理的设计方法,可以用最少的实验次数在众多的影响因素中快速有效地筛选出关键因素[14]。响应面法是利用合理的实验设计,通过模型的构建与拟合,对各因素及各因素之间的相互作用进行优化和评价,快速有效地寻求最优工艺参数的一种统计方法[15]。近年来,利用响应面设计对发酵过程参数的优化得到广泛的应用[16-21]。
本研究以实验室保藏的C.lini为出发菌株,通过亚硝基胍(NTG)和低能氮离子(N+)注入复合诱变,并结合酮康唑抗性筛选法获得一株高效转化DHEA为7α,15α-diOH-DHEA的菌株。并在此基础上采用统计学设计方法对转化培养基进行了优化,以进一步提高诱变菌株的转化效率,为DHEA生物转化的工业化奠定基础。
1 材料与方法
1.1 菌株
C.lini:由本实验室保藏。
1.2 主要材料与试剂
DHEA、7α,15α-diOH-DHEA为国产分析纯,由浙江仙居君业有限公司提供;7α-OH-DHEA由本实验室制备;其他化学试剂均购自国药集团化学试剂有限公司;TLC薄板购自青岛海洋化工有限公司。
1.3 培养基与培养条件
斜面培养基(g/L):马铃薯葡萄糖琼脂(PDA)培养基。30℃培养3–5 d。
种子培养基(g/L):葡萄糖15,酵母粉15,玉米浆3,豆饼粉10,pH自然。取菌种斜面,无菌水洗下孢子,玻璃珠振荡打散,调整孢子浓度为1×106个/mL,取3 mL接种于含有100 mL种子培养基的500 mL摇瓶中,30℃、220 r/min培养3 d后以10%(V/V)的接种量转接于种子培养基二次活化,30℃、220 r/min培养1 d后制得液体种子。
酮康唑筛选培养基(g/L):PDA液体培养基冷却至70℃左右,加入不同体积的酮康唑母液(DMSO溶解、0.22 μm有机系滤膜过滤除菌),混合均匀倒平板。
转化培养基(g/L):葡萄糖15,酵母膏15,玉米浆3,FeSO4·7H2O 0.02,MgSO4·7H2O 0.3,KH2PO41,pH 6.5。以10%(V/V)的接种量接种于含有30 mL转化培养基的250 mL摇瓶中,30℃、220 r/min培养至24 h,以10 g/L投入底物DHEA,转化3 d后停止转化。
1.4 主要仪器
HYL-C组合式摇床购自太仓强乐实验设备有限公司;Ultimate 3000高效液相色谱仪购自戴安公司;离子束注入设备由南京工业大学提供。
1.5 分析方法
1.5.1 薄层层析(TLC)检测法
展开剂(氯仿:甲醇=15:1(V/V));显色剂(浓硫酸:乙醇=1:1(V/V))。采用硅胶板,点样量3 μL,105℃加热5 min显色。
1.5.2 高效液相色谱(HPLC)检测法
取转化液,乙酸乙酯抽提多次后合并抽提液,干燥至出现结晶;色谱纯乙腈复溶,0.22 μm的有机膜过滤除杂,HPLC检测。
HPLC条件:柱型,Agilent TC-C18,4.6 mm× 250 mm,5 μm;流动相,乙腈/水(70∶30);柱温30℃;检测波长,206 nm;流速,0.5 mL/min;进样量,10μL。
1.6 复合诱变方法
1.6.1 酮康唑最低抑菌浓度的确定
将单孢子悬液稀释涂布于含有不同浓度酮康唑的PDA平板,30℃培养1–2 d后平板菌落计数,未生长菌落的最低作用浓度即为酮康唑的最低抑菌浓度[22]。
1.6.2 亚硝基胍(NTG)诱变剂量的确定
将单孢子悬液(1×106–1×108个/mL)与1 mg/mL的NTG溶液等体积混合,吹打均匀、30℃摇床振荡反应,分别处理10–60 min,0.9 mol/L的生理盐水稀释终止反应,稀释涂布于PDA平板;对照组未加入亚硝基胍;30℃培养1–2 d后平板菌落计数,选择致死率在80%–90%的剂量作为最佳诱变剂量。
1.6.3 低能氮离子(N+)注入诱变剂量的确定
吸取100 μL单孢子悬液(1×106–1×108个/mL)均匀涂布于无菌空白平皿,无菌风吹干制成菌膜,放入无菌真空靶室内进行N+离子注入(注入能量15 000 eV,注入剂量0.4×1016–4.0×1016ions/cm2,脉冲式注入,每个脉冲5 s,间隔15 s),注入结束后加入1 mL无菌水洗下,稀释涂布于PDA平板;对照组置于真空靶室内,不经离子注入;30℃培养1–2 d后平板菌落计数,计算存活率;分别挑取不同注入剂量平板上单菌落摇瓶发酵,计算正突变率,选择正突变率最大的剂量为最佳注入剂量[23]。
1.6.4 复合诱变
将出发菌株单孢子悬液(1×109–1×1010个/mL)以亚硝基胍最佳诱变剂量处理后,吸取100 μL单孢子悬液制成菌膜,然后以最佳注入剂量氮离子注入,诱变结束后稀释涂布于含有最低抑菌浓度的酮康唑筛选平板,筛选获得高产突变株。
1.6.5 菌株的筛选
初筛:从生长差异较大筛选平板上随机挑取生长良好的酮康唑抗性突变株划线PDA平板,培养3–5 d后挑取气生菌丝划线PDA斜面。
复筛:单孢子悬液接种于种子培养基培养3 d,将二次活化种子液以10%(V/V)的接种量接种转化培养基,培养至24 h以10 g/L投入底物DHEA,转化3 d后停止转化,取样萃取和HPLC检测。
1.7 优化设计
Plackett-Burman设计:在单因素实验的基础上,通过Plackett-Burman设计对影响产物摩尔得率的转化培养基各组分进行筛选,找出关键因素。
最陡爬坡实验:根据Plackett-Burman实验筛出的重要因素效应的正负和大小来设计步长,按照正效应取较高值、负效应取较低值的原则,进一步逼近产物摩尔得率最大响应区域。
中心组合设计实验:根据Plackett-Burman实验筛选出的重要因素和最陡爬坡实验确定的响应面实验因素水平的中心点,利用Design expert V8.0.6软件设计响应面实验,对实验结果进行回归模型的方差分析和响应面分析,用F检验评价数学模型方程的显著性,方程的拟合性由决定系数R2确定,最后获得最佳培养基配方。
1.8 模型验证
对拟合得到的回归方程的各自变量求偏导数得到方程组,求解方程组得到极值点的自变量取值。再按照计算得到的参数进行3次发酵转化验证实验,以验证模型的可靠性,并确定最终的优化结果。
2 结果与分析
2.1 复合诱变筛选结果
2.1.1 酮康唑最低抑菌浓度的确定
P450酶为甾体羟化反应中起催化作用的酶,酮康唑等唑类化合物可以抑制P450酶活性,菌株的酮康唑抗性与P450酶羟化活力具有一定的相关性[24]。表1为不同酮康唑浓度下菌株的生长状况,由表可知酮康唑浓度达到100 μmol/L时没有菌落生长,将其作为最低抑菌浓度。
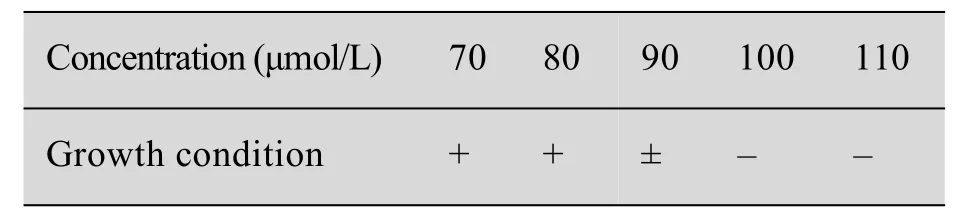
表1 酮康唑最低抑菌浓度的确定Table 1Minimum inhibitory concentration of ketoconazole
2.1.2 亚硝基胍诱变剂量的选择
图1为亚硝基胍诱变致死率曲线。对于多核细胞或孢子采用较高的诱变剂量可以获得较纯的变异菌落[25],因此选择致死率在80%–90%的作用时间30 min作为最佳诱变剂量。
2.1.3 低能氮离子注入诱变剂量的选择
图2为N+离子注入(注入能量15 000 eV,注入剂量0–4.0×1016ions/cm2)“马鞍形”存活率曲线。图3为N+离子注入剂量与正突变率的关系图,由图可知随着注入剂量的增大,正突变率先增大后减小,注入剂量为2.8×1016ions/cm2时正突变率最大,将其作为最佳注入剂量。
2.1.4 复合诱变菌株的筛选
以最佳诱变剂量进行复合诱变。经多轮筛选选取5株产量较高的菌株斜面保藏并进行摇瓶复筛,最终选取菌株C.lini ST-1进行后续研究。其产物摩尔得率达到34.2%,与出发菌株(产物摩尔得率23.4%)相比提高了46.2%。突变株经斜面连续传代5次后,产物摩尔得率稳定,表明菌株遗传稳定性良好。传代稳定性实验结果见表2。
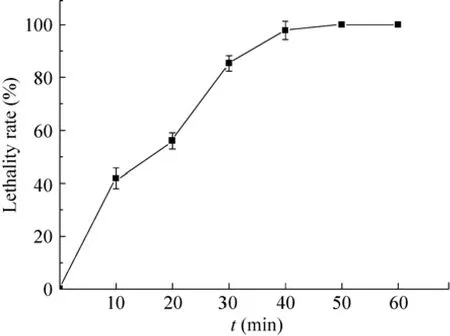
图1 NTG诱变致死率曲线Fig.1Lethality curve by NTG.
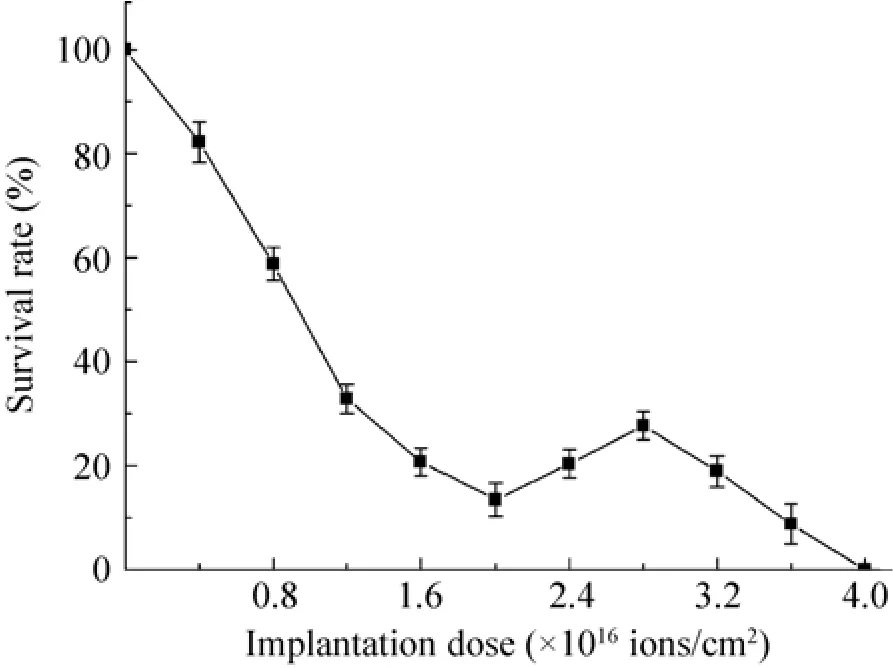
图2 N+注入存活率曲线Fig.2Survival rate curve by N+implantation.
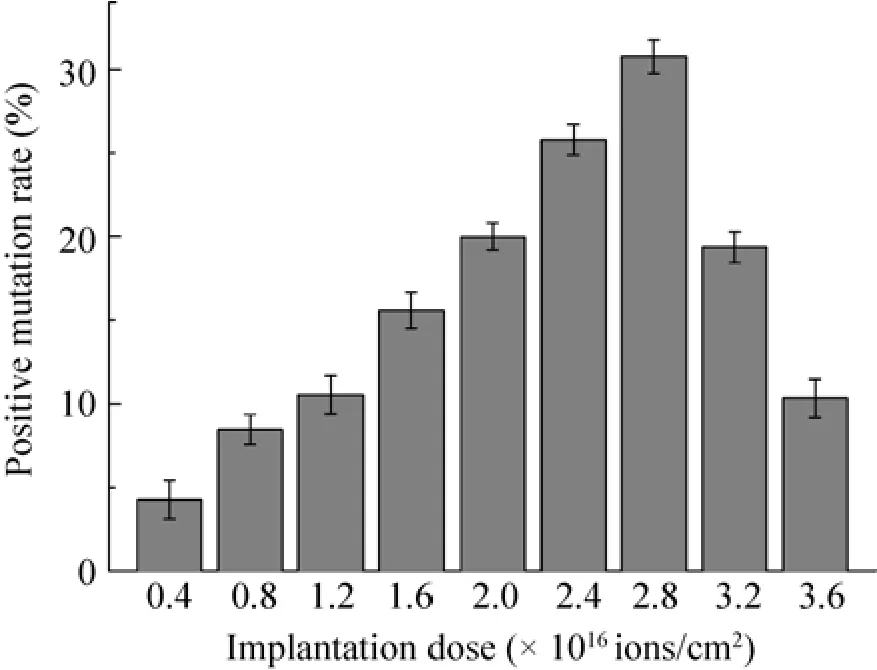
图3 N+注入剂量与正突变率的关系Fig.3Relation of dose and positive mutation rate of N+implantation.
2.2 统计学实验优化转化培养基
2.2.1 Plackett-Burman实验
利用design expert V8.0.6软件进行PB实验设计,对葡萄糖(X1)、酵母粉(X2)、玉米浆(X3)、FeSO4·7H2O(X4)、MgSO4·7H2O(X5)、KH2PO4(X6) 6个因素进行考察,每个因素取高(+)低(-)两个水平,响应值为7α,15α-diOH-DHEA的摩尔得率(Yp)。实验设计与结果见表3,实验结果方差分析见表4。
表4显示葡萄糖、酵母粉和MgSO4·7H2O对产物摩尔得率影响显著(P<0.05)。其中正向影响因子为葡萄糖,负向影响因子为酵母膏和MgSO4·7H2O,各因素对产物摩尔得率的影响可用以下方程表示:

方程的决定系数R2=0.9530,表明该回归方程拟合良好。
2.2.2 最陡爬坡实验结果
试验设计及结果如表5所示。由表5可知最大产物摩尔得率区在第4次实验附近,产物得率达到47.1%。因此,后续响应面实验将实验4的培养基浓度作为中心组合设计实验的中心点。
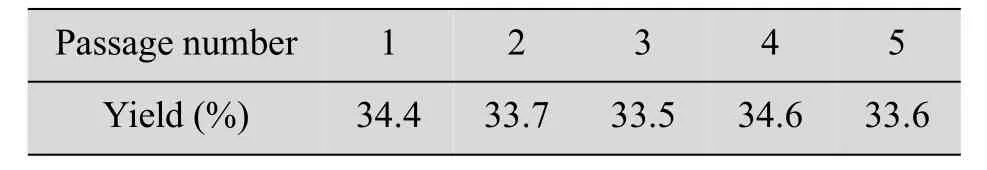
表2 突变株的遗传稳定性Table 2Genetic stability of mutant strain
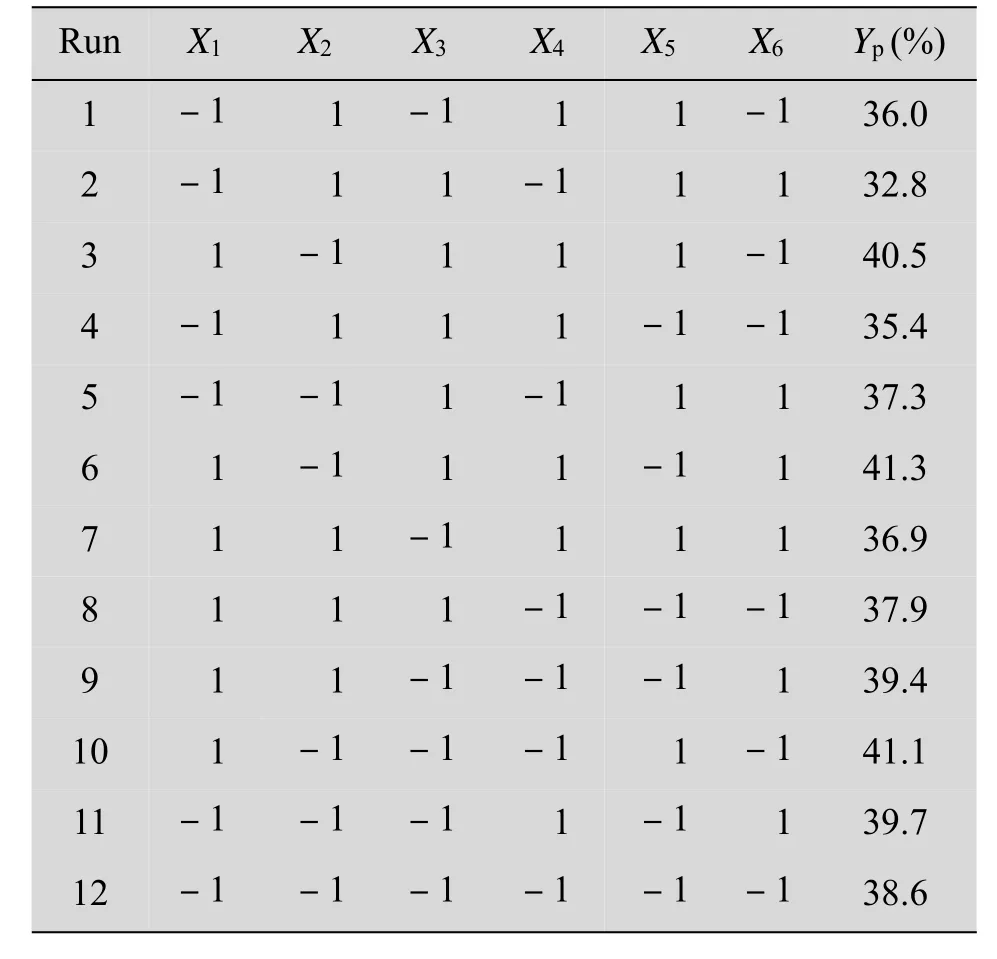
表3 Plackett-Burman实验设计及响应值Table 3Plackett-Burman design and responding value
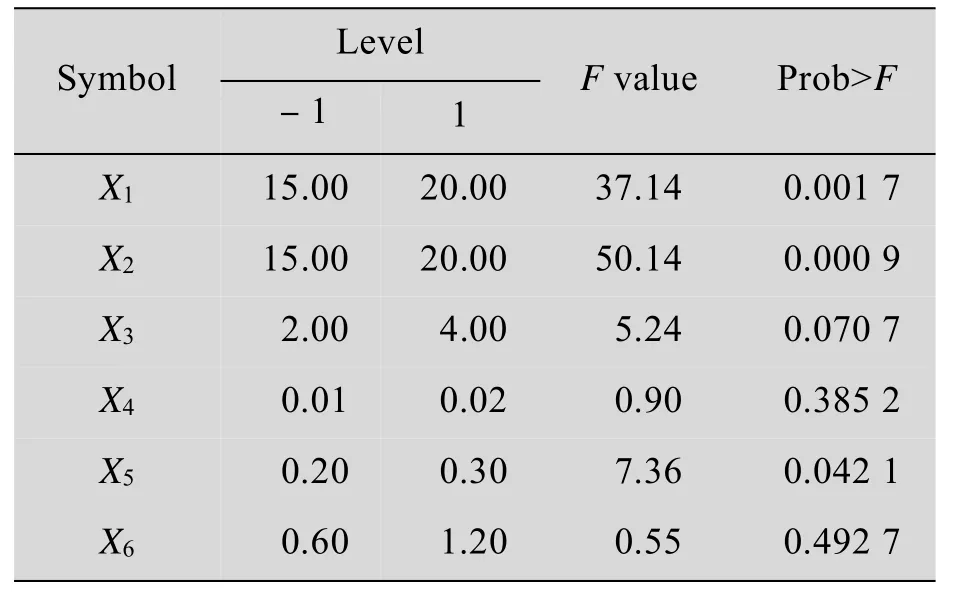
表4 Plackett-Burman实验设计各因素水平及影响效果Table 4Factors levels and results of Plackett-Burman design
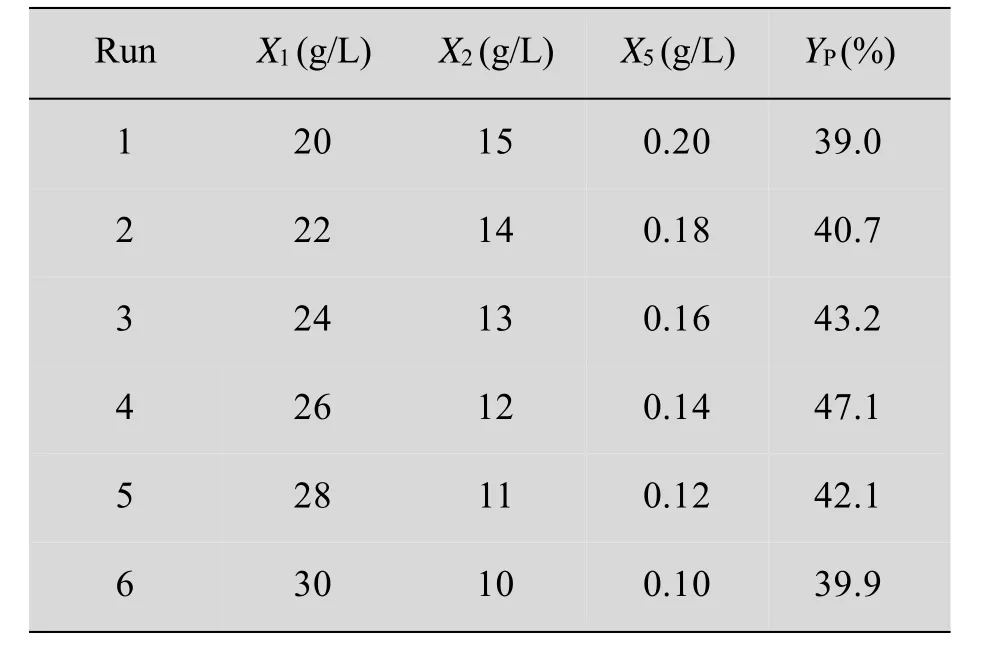
表5 最陡爬坡试验设计及结果Table 5Experimental design and results of steepest ascent
2.2.3 响应面实验结果分析
采用design expert V8.0.6软件进行响应面试验设计确定显著因子的最优水平,并进行回归分析和方差分析,拟合得到回归方程:
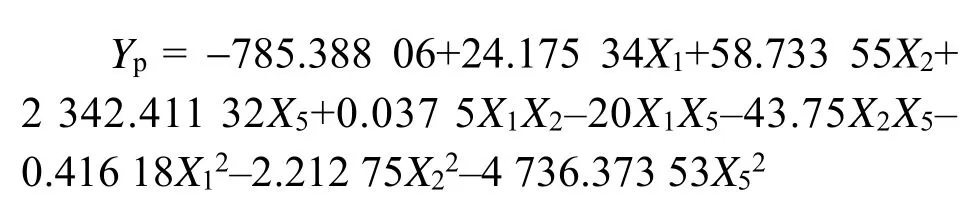
中心组合试验设计及结果见表6,回归模型的方差分析见表7,响应面图形见图4–6。
从表7的回归模型的方差分析以看出,回归模型的P<0.0001,该值小于0.01,表明该模型极显著。一次项X2、X5的P<0.05,显著,平方项X12、X22、X52的P<0.0001,极显著,表明各因素与产物摩尔得率之间存在明显的二次关系,X1X5、X2X5的P<0.05,显著,且X2X5达到极显著水平,表明X2与X5的交互作用对产物摩尔得率影响显著。一次项X1和交互项X1X2的P>0.05,不显著。失拟项的P值为0.2304,远远大于0.05,不显著,表明实验数据与模型拟合良好。模型的复相关系数R2=0.9638,表明该模型能够解释96.38%的响应值变化,该模型能较好地模拟7α,15α-diOH-DHEA的实际转化过程。
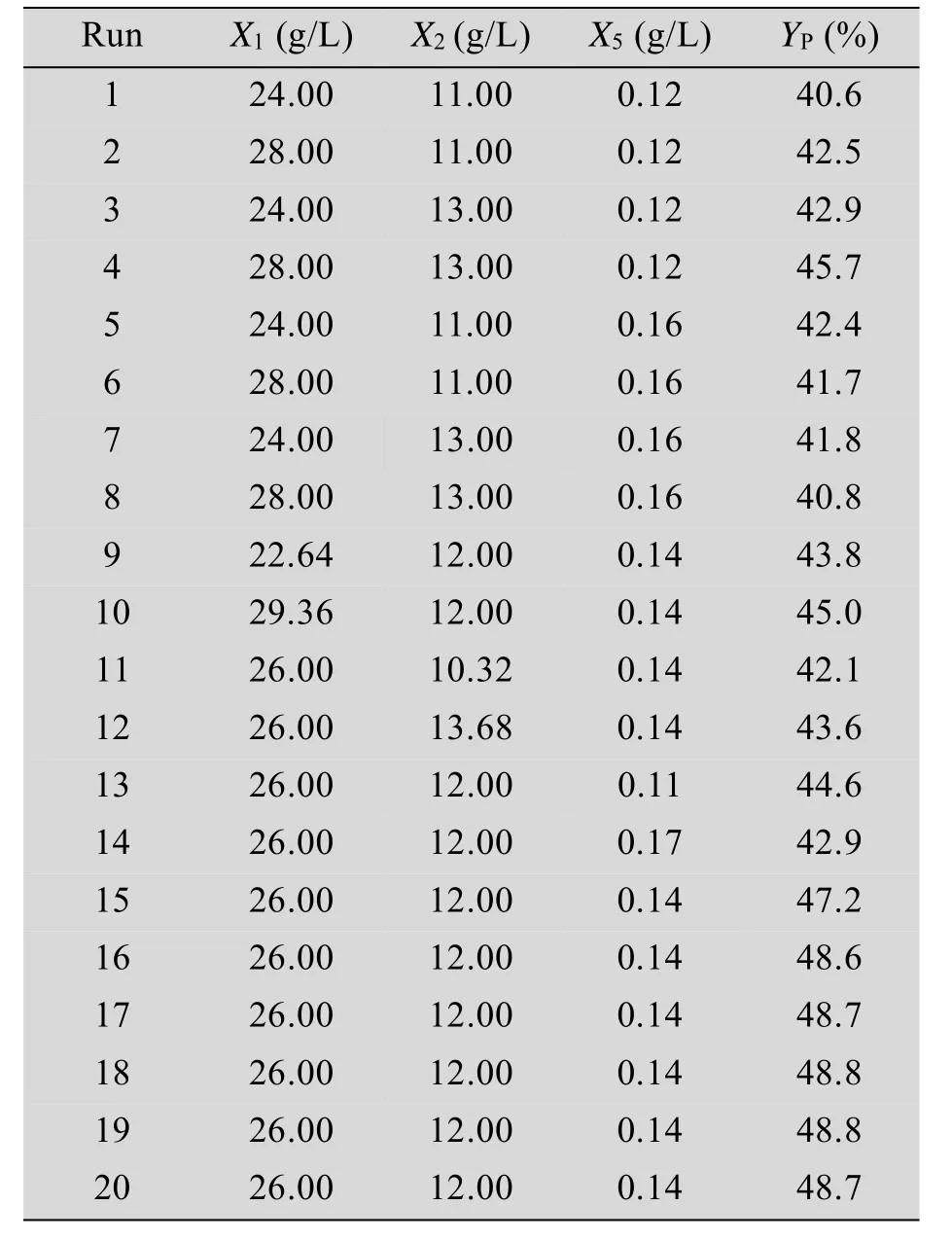
表6 中心组合设计及结果Table 6Experiment design and results of the CCD design
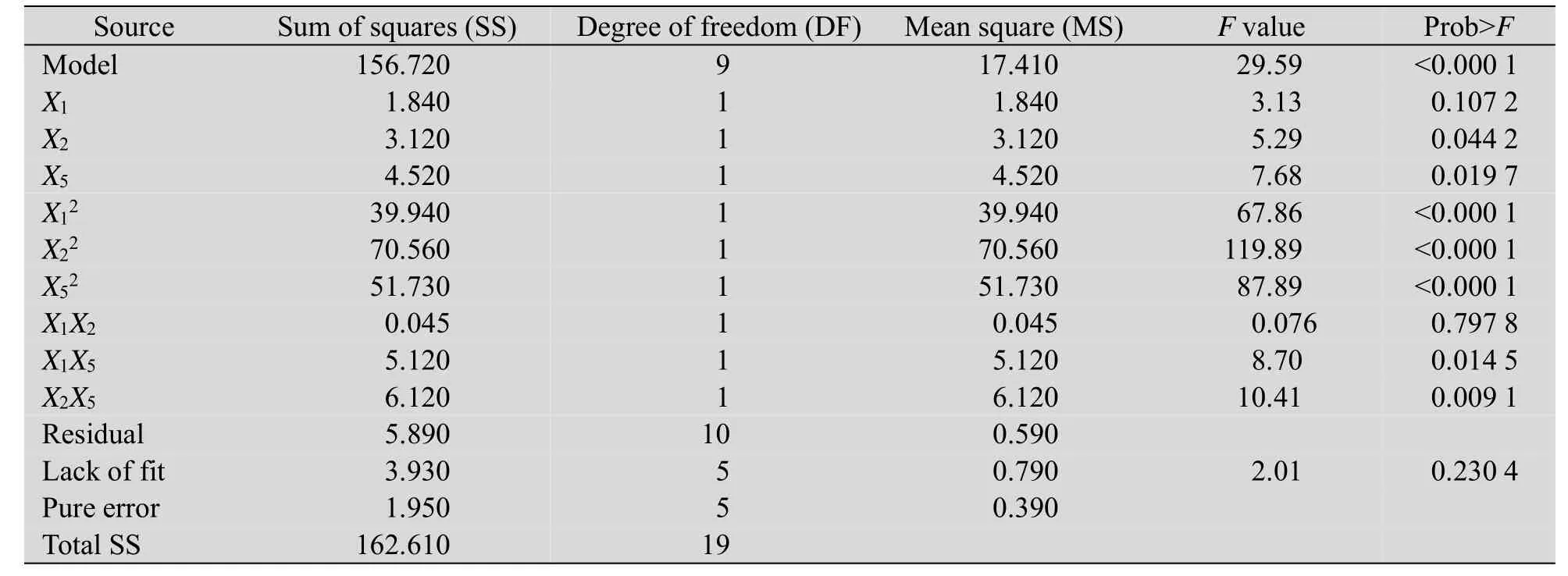
表7 回归模型方差分析Table 7ANOVA of response surface model
从图4–6响应面分析立体图可以看出X1与X5、X2与X5的交互作用显著,X1、X2和X5存在极值点。对回归方程求导得到培养基组分(g/L)为:葡萄糖26.34;酵母粉12.15;玉米浆3;FeSO4·7H2O 0.015;MgSO4·7H2O 0.14;KH2PO40.9。将各数值代入回归方程得到理论产物摩尔得率预测值为48.6%。为检验模型预测的准确性,在优化条件下进行转化实验,产物摩尔得率平均值为49.3%,与模型预测值非常接近,表明该模型能够很好地预测实际的转化情况。
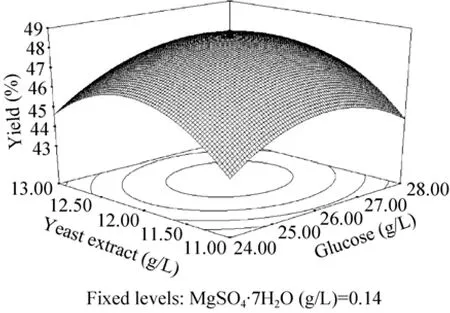
图4 葡萄糖和酵母粉浓度对产物摩尔得率影响的响应面图Fig.4Surface layer of the mutual-affection of glucose and yeast extract concentration on molar yield of product.

图5 葡萄糖和MgSO4·7H2O浓度对产物摩尔得率影响的响应面图Fig.5Surface layer of the mutual-affection of glucose and MgSO4·7H2O concentration on molar yield of product.

图6 酵母粉和MgSO4·7H2O浓度对产物摩尔得率影响的响应面图Fig.6Surface layer of the mutual-affection of yeast extract and MgSO4·7H2O concentration on molar yield of product.
3 结论
本实验对C.lini进行复合诱变,筛选获得一株7α,15α-diOH-DHEA高产菌株C.lini ST-1,该突变株在DHEA投料浓度10 g/L条件下,产物摩尔得率达到34.2%,与出发菌株相比提高了46.2%。为进一步提高菌株的转化能力,采用统计学实验设计对转化培养基进行优化,利用中心组合设计实验对Plackett-Burman实验筛选出的3个关键因素进行研究,确定最佳转化培养基配方为葡萄糖26.34 g/L、酵母粉12.15 g/L、MgSO4·7H2O 0.14 g/L,产物摩尔得率理论预测值为48.6%。在最优培养基条件下,产物摩尔得率为49.3%,与理论预测值非常接近,较优化前提高了44.2%,说明采用响应面法优化亚麻刺盘孢转化培养基是可行的。
REFERENCES
[1]Fernandes P,Cruz A,Angelova B,et al.Microbialconversionofsteroidscompounds:recent developments.EnzymeMicrobTechnol,2003, 32(6):688–705.
[2]Tong WY,Dong X.Microbial biotransformation: recent development on steroid drugs.Recent Pat Biotechnol,2009,3(2):141–153.
[3]Brown WE.The impact of biotechnology to health care industry.Ann Rep fermen Proc,1984,7:135.
[4]Haq NB,Rasheed AK.Biological transformation of steroidal compounds:a review.Steroids,2012, 77(12):1267–1290.
[5]Huang LH,Li J,Xu G,et al.Biotransformation of dehydroepiandrosterone(DHEA)with Penicillium griseopureumSmithandPenicilliumglabrum (Wehmer)Westling.Steroids,2010,75(13/14): 1039–1046.
[6]Han GD,Liu HB.Progress on the synthesis of a novel oral contraceptive drospirenone for women. Chinese J Med Chem,2010,20(2):146–154(in Chinese).韩广甸,刘宏斌.新型女用口服避孕药屈螺酮的合成进展.中国药物化学杂志,2010,20(2): 146–154.
[7]DonovaMV,EgorovaOV.Microbialsteroid transformations:current state and prospects.Appl Microbiol Biotechnol,2012,94(6):1423–1447.
[8]Holland HL.Recent advancesin applied and mechanistic aspects of the enzymatic hydroxylation of steroids by whole-cell biocatalyst.Steroids, 1999,64(3):178–186.
[9]CharneyW,HerzongLH.Microbial Transformations of Steroids.New York:Academic Press,1976:5–73.
[10]ShangK,HuHF,ZhuBQ.Synthesisof 7α,15α-dihydroxyandrostenolonebymicrobial transformation.Chinese Acad Med Mag Organ, 2004(2):30–34(in Chinese).尚珂,胡海峰,朱宝泉.微生物转化法合成7α,15α-二羟基雄烯醇酮.中国医学生物技术应用杂志,2004(2):30–34.
[11]Romano A,Romano D,Ragg E,et al.Steroid hydroxylations with Botryodiplodia malorum and Colletotrichumlini.Steroids,2006,71(6): 429–434.
[12]Lobastova TG,Gulevskaya SA,Sukhodolskaya GV,etal.Dihydroxylationof dehydroepiandrosterone in positions 7α and 15α by mycelial fungi.Appl Microbiol Biotechnol,2009, 45(6):617–622.
[13]Xu ZH,Wu Y,Li H.Current state and progress of biotransformationtechnologyofsteroid compounds.Chin J Bioproc Eng,2013,11(2): 30–36(in Chinese).许正宏,吴燕,李会.甾体生物转化技术研究的现状与进展.生物加工过程,2013,11(2):30–36.
[14]Plackett RL,Burman JP.The design of optimum multifuctorial experiments.Riometrika,1946,34: 255–272.
[15]MontgomeryDC.DesignandAnalysisof Experiments.5th ed.New York:John Wiley and Sons,2001:451–463.
[16]Wang P,Sun LM,He JY.Medium optimization for enhanced production of carbonyl reductase by Candidatropicalis104byresponsesurface methodology.ChinJBiotech,2009,25(6): 863–868(in Chinese).王普,孙立明,何军邀.响应面法优化热带假丝酵母104菌株产羰基还原酶发酵培养基.生物工程学报,2009,25(6):863–868.
[17]Balusu R,Paduru RR,Kuravi S,et al.Optimization of critical medium components using response surface methodology for ethanol production from cellulosic biomass by Clostridium thermocellum SS19.Process Biochem,2005,9(40):3025–3030.
[18]Zhang SW,Huang JF,Luo LX.Optimization of fermentation medium for protease production by Bacillus subtilis.China Brewing,2013,32(2): 20–24(in Chinese).张士伟,黄建飞,罗立新.枯草芽胞杆菌产蛋白酶发酵培养基的优化.中国酿造,2013,32(2): 20–24.
[19]He J,Zhen Q,Qiu N,et al.Medium optimization for the production of a novel bioflocculant from Halomonassp.V3a´usingresponsesurfacemethodology.Bioresour Technol,2009,100(23): 5922–5927.
[20]ChenXC,BaiJX,CaoJM,etal.Medium optimization for the production of cyclic adenosine 3′,5′-monophosphate by Microbacterium sp.no. 205 using response surface methodology.Bioresour Technol,2009,100(2):919–924.
[21]Tang XJ,He GQ,Chen QH,et al.Medium optimization for the production of thermal stable beta-glucanase by Bacillus subtilis ZJF-1A5 using response surface methodology.Bioresour Technol, 2004,93(2):175–181.
[22]Lu WY,Chen PC,Guo YW,et al.Ketoconazole resistance mutation-a study on the breeding of steroids11β-hydroxylationstrain-Curvularia lunata.Microbiol China,2003,30(6):26–29(in Chinese).卢文玉,陈伴成,郭亚文,等.氢化可的松高产菌株新月弯孢霉的选育.微生物学通报,2003, 30(6):26–29.
[23]Wan HG,Wang WJ,Miao LL,et al.Mutation breeding of high-yield exopolysaccharide-producing strains by nitrogen ion beam implantation.J Radiat Res Radiat Proc,2012,30(3):170–173(in Chinese).万红贵,王文娟,缪玲玲.氮离子束注入诱变选育胞外多糖高产菌株.辐射研究与辐射工艺学报,2012,30(3):170–173.
[24]Guo YW.Breeding of resistance mutants and analysis of P450 enzyme by Curvularia lunata[D]. Tianjin:TianjinUniversityofScience& Technology,2004(in Chinese).郭亚文.新月弯孢霉抗性菌株选育及P450酶特性分析[D].天津:天津科技大学,2004.
[25]Zhuge J,Li HZ,Wang ZX.Genetic Improvement on Microorganisms.Beijing:Chemical Industry Press,2008(in Chinese).诸葛健,李华钟,王正祥.微生物遗传育种学.北京:化学工业出版社,2008.
(本文责编郝丽芳)
July 23,2013;Accepted:October 21,2013
Hui Li.Tel:+86-510-85326883;Fax:+86-510-85918206;E-mail:lihui@jiangnan.edu.cn
Optimization of hydroxylating DHEA to 7α,15α-diOH-DHEA by compound mutation and fermentation optimization
Chuanpeng Li1,Hui Li1,Yan Wu1,Heng Li1,Rujin Zhang2,Zhengbin Zhang2,Jinsong Shi1, and Zhenghong Xu1
1 School of Pharmaceutical Science,Jiangnan University,Wuxi 214122,Jiangsu,China
2 Zhejiang Xianju Junye Pharmaceutical Co.,Ltd.,Taizhou 317300,Zhejiang,China
Combined with method of ketoconazole resistance screening,a 7α,15α-diOH-DHEA high-producing mutant Colletotrichum lini ST-1 was obtained by compound mutation of NTG and low energy N+ion beam implantation.With the substrate concentration of 10 g/L DHEA,the molar yield of 7α,15α-diOH-DHEA reached 34.2%,increased by 46.2%than that of the original strain.Then we optimized the medium.First,Plackett-Burman design was used to evaluate the effects of medium components on molar yield of the product.Results show that glucose,yeast extract and MgSO4·7H2O were the important parameters for the biotransformation process.Subsequently,the path of steepest ascent was used to approach the optimal levels.To obtain the optimal levels,central composite design and response surface analysis were carried out.The optimal medium was as follows(g/L):glucose 26.34,yeast extract 12.15,corn flour 3.00,FeSO4·7H2O 0.015, MgSO4·7H2O 0.14,KH2PO40.90.Under the optimal conditions,the molar yield of 7α,15α-diOH-DHEA reached 49.3%, which was 44.2%higher than that of using the medium before optimization.
Colletotrichum lini,biotransformation,compound mutation,medium optimization,response surfaces methodology
Supported by:National High Technology Research and Development Program of China(863 Program)(No.2011AA02A211),National Natural Science Foundation of China(No.21206055),Natural Science Foundation of Jiangsu Province,China(No.BK2012127).

