粗糙脉孢菌纤维素酶液体发酵优良形态突变体筛选
孙志勇,林良才,王敏,田朝光
1天津科技大学生物工程学院,天津 300457
2中国科学院天津工业生物技术研究所 系统微生物工程重点实验室,天津 300308
粗糙脉孢菌纤维素酶液体发酵优良形态突变体筛选
孙志勇1,2,林良才2,王敏1,田朝光2
1天津科技大学生物工程学院,天津 300457
2中国科学院天津工业生物技术研究所 系统微生物工程重点实验室,天津 300308
孙志勇, 林良才, 王敏, 等. 粗糙脉孢菌纤维素酶液体发酵优良形态突变体筛选. 生物工程学报, 2014, 30(1): 55−63.
Sun ZY, Lin LC, Wang M, et al. Improving cellulases production with Neurospora crassa by morphology mutants screening. Chin J Biotech, 2014, 30(1): 55−63.
丝状真菌被广泛地用于包括纤维素酶在内的工业酶生产过程。在液体深层发酵中,丝状真菌菌丝形态直接影响发酵液的流变特性,进而与目标酶蛋白产量存在着重要的关联。目前,针对丝状真菌工业酶液体发酵菌丝形态的研究依然是从传统的发酵工程学角度出发,对与发酵水平紧密相关的形态、粘度等性状相关基因的认识远远不够。为了挖掘深层发酵中对丝状真菌发酵产酶性能具有重要影响的形态发育相关基因,以粗糙脉孢菌Neurospora crassa单基因突变体库中的95株形态突变株为研究对象,在结晶纤维素为碳源的条件下进行筛选,探寻与野生型菌株蛋白产量有显著差异的突变株。同时,对这些突变株的内切-β-1,4-葡聚糖酶酶活、β-葡萄糖苷酶酶活、发酵液粘度和菌丝干重进行了测定,并观察了发酵液中突变株的菌丝形态。实验结果表明,与野生型菌株相比,突变株SZY32、SZY35、SZY39和SZY43发酵液中蛋白浓度显著降低,突变株SZY11、SZY63、SZY69和SZY87发酵液中蛋白浓度显著性提高。值得注意的是,突变株SZY11和SZY43发酵液菌丝体主要形态为菌球状,其发酵液粘度分别降低75%和50%,突变株SZY87在发酵液中呈长丝状,发酵液粘度显著升高至少2倍。这些与产酶水平相关的形态、粘度基因的获得将有助于丝状真菌纤维素酶等工业酶高产工程菌株的理性构建。
粗糙脉孢菌,菌丝形态,发酵液粘度,纤维素酶
丝状真菌是包括纤维素酶在内的传统发酵工业的主要生产者,与细菌和酵母相比,在翻译后修饰、分泌能力、代谢产物多样性和生产能力等方面具有显著优势,被广泛用于生产各种代谢物、生物活性物质和工业酶等,涉及医药、食品等多个行业[1-4]。液体深层发酵过程中,丝状真菌菌丝形态对其目标产品的合成代谢及产量有显著影响。通常情况下,丝状真菌菌丝形态分为2种形式:丝状 (Mycelial form) 和球形 (Pelleted form)[5-6]。丝状又分为松散的菌丝聚集体(Clump) 和菌丝体 (Mycelium)。菌体形态以丝状为主会造成菌丝间相互缠绕,增大发酵液粘度,不利于营养物质和氧的溶解、传递,甚至使发酵体系达到气溶胶状态,产率明显降低[4,7-8]。若菌丝体形成细小菌丝颗粒,则料液传质效果较好,动力输入减小,生产成本降低。然而,菌球颗粒太大或太致密会阻碍氧气和营养物质的传递,导致内部处于缺氧及营养匮乏的状态,影响菌体生长和产物合成[9-11]。因此,如何优化控制丝状真菌发酵过程中的菌丝体形态成为现代工业发酵调控的热点与难点。
在里氏木霉Trichoderma reesei和黑曲霉Aspergillus niger等工业菌株发酵生产中,常常出现发酵液流变性差、营养物质传递不均匀和溶氧困难等问题,进而发生高能耗、低产率的情况。在丝状真菌工业发酵过程中,发酵液的流变性能主要取决于单位体积的菌体生物量和菌丝体形态[12]。目前,国内外研究者对于丝状真菌菌体形态的控制主要是从传统的发酵工程学角度出发,如菌种特性、接种量、培养基成分、温度、搅拌转速、pH、发酵罐的大小和类型等[4,7,10]。此外,诱变育种也被用于菌丝形态的研究,如Bocking等将米曲霉Aspergillus oryzae通过亚硝酸和紫外诱变,得到5株多分支突变株并且摇瓶发酵培养,发现培养基消耗速率加快,发酵液流变学性能明显改善,其扭矩值降低50%以上,蛋白产量显著提高[13]。至于模式真菌粗糙脉孢菌Neurospora crassa单基因敲除突变株,研究者多是从其生理性状入手,如Ziv等通过固体平板观察其菌丝长度、分支和产孢情况,并对突变基因做互补和蛋白定位等分析工作,发现COT1可通过磷酸化水平的调控来控制菌丝的延伸和分支[14]。Watters等在无机盐固体培养基上利用33 ℃和10 ℃两个温度条件培养N. crassa单基因敲除突变株,探索突变株生长速率与分支度间的关系[15]。少数研究者也利用突变株发酵产酶。Lee等利用温度敏感型突变株mcb在以1.0%蔗糖和0.5%羧甲基纤维素为碳源的条件下摇瓶培养4 d,发现蛋白产量和内切-β-1,4-葡聚糖酶活力均比野生型菌株有明显提高[16]。然而,对发酵产酶过程中蛋白水平和粘度等发酵性状相关功能基因的克隆鉴定却鲜有报道。
本文以N. crassa野生型菌株FGSC2489为对照,将95株形态突变体在以结晶纤维素为碳源的培养基中进行筛选,通过测定发酵液蛋白浓度、酶活活力和发酵液粘度等发酵性状,同时观察发酵液菌丝体形态,筛选获得8株蛋白浓度显著变化的突变株,其中5株突变株的发酵液粘度明显改变,并对这些菌株突变基因的功能进行了简述。这些功能基因的获得,加深了对丝状真菌菌丝形态变化分子机理层次的认识,为进一步阐述丝状真菌优良发酵性状的分子基础以及基因组水平的菌种改良奠定了基础,以期达到提高纤维素酶发酵水平的目的。
1 材料与方法
1.1 材料
1.1.1 菌种
N. crassa野生型菌株FGSC 2489、N. crassa形态突变体和潜在形态突变体均购自美国真菌遗传保藏中心 (Fungal Genetics Stock Center,FGSC)。菌种保藏采用冷冻甘油管法。
1.1.2 培养基
斜面培养基(L):1% Vogel’s salts,20 g蔗糖,15 g琼脂粉,自然pH。
产酶培养基(L):1% Vogel’s salts,20 g结晶纤维素,7.5 g酵母粉,2 mL吐温80。
Vogel’s salts medium(L):125 g C6H5Na3O7,250 g KH2PO4,100 g NH4NO3,10 g MgSO4·7H2O,5 g CaCl2·2H2O,5 mL微量元素溶液,2.5 mL 0.1 mg/mL生物素溶液。
微量元素溶液 (L):50 g C6H8O7·H2O,50 g ZnSO4·7H2O,10 g Fe(NH4)(SO)2·6H2O,2.5 g CuSO4·5H2O,0.5 g MnSO4·H2O,0.5 g H3BO3,0.5 g Na2MoO4·2H2O。
1.1.3 主要试剂
Brad-ford试剂购自BIO-RAD公司;AZO-CM-CELLULOSE试剂购自Megazyme公司;对硝基苯-β-D-吡喃半乳糖苷p-NPG和其他化学试剂均购自Sigma公司。
1.2 实验方法
1.2.1 突变体筛选方法
根据N. crassa野生型菌株FGSC2489摇瓶发酵培养结果,突变体筛选时孢子终浓度为105/mL。产酶培养基装液量为100 mL培养基/ 250 mL三角瓶,pH 6.5。25 ℃摇床200 r/min光照培养7 d。
1.2.2 发酵液蛋白浓度的测定
发酵上清液蛋白浓度采用Bradford法测定,以牛血清白蛋白作为标准。试验重复3次,取平均值。
1.2.3 酶活测定
1) 内切-β-1,4-葡聚糖酶活力的测定方法:将发酵上清液用0.1 mol/L醋酸钠缓冲液 (pH 4.6) 稀释适宜倍数,取终体积为0.5 mL,40 ℃水浴锅预热5 min,取出,加入0.5 mL Megazyme AZO-CM-CELLULOSE底物溶液,混匀,40 ℃温育10 min,加入2.5 mL沉淀剂终止反应,室温静置10 min,混匀,1 000×g离心10 min,测OD590值。空白组使用灭活酶液作对照。每个样品做3个平行对照。
根据下列公式计算内切-β-1,4-葡聚糖酶活力(U/mL):
Units/mL =(412.5×OD590-6.0)×2×Dilution/1 000
2) β-葡萄糖苷酶活力的测定方法:取50 μL发酵上清液,加入200 μL 0.05 mol/L乙酸钠缓冲液 (pH 4.8),混匀,加入250 μL 1 mg/mL p-NPG底物溶液,混匀,50 ℃温育10 min,加入500 μL 1 mol/L碳酸钠溶液终止反应,测OD420值。空白组使用灭活酶液作对照。每个样品做3个平行对照。
根据下列公式计算β-葡萄糖苷酶活力(U/mL):
Units/mL =(294.1176×OD420-10) ×0.00025× 4×Dilution/(10 min)
3) 活性定义:在上述测定条件下,单位体积每分钟水解底物产生1 μmol产物所需的酶量为1个酶活力单位。
1.2.4 发酵液菌丝形态的观察
取10 μL发酵液滴于载玻片中央处,轻轻盖上盖玻片,分别使用40倍体视显微镜和100倍QIMAGING Retiga 2000R电子显微镜观察,拍取菌丝显微图片。
1.2.5 发酵液粘度的测定
取9 mL摇匀的发酵液置于样品杯中,设置Brookfield HB DV-III Ultra旋转粘度计的转速为40 r/min,读取仪器运行1 min时稳定的扭矩值,单位为%[13]。试验重复3次,取平均值。
1.2.6 发酵液菌丝干重和纤维素水解率的测定
取10 mL发酵液,真空泵抽滤去上清液,用已称重的锡箔纸包裹,65 ℃烘箱烘干至恒重,称重。单位为g。每个样品做3个平行对照,试验重复3次。
取10 mL发酵液,在煮沸的醋酸硝酸混合液中溶解真菌菌丝体[17-18],65 ℃烘干至恒重,称重。按公式W (%) =(1-10×称量的纤维素干重/2.00)×100%,计算纤维素水解率。每个样品做3个平行对照,试验重复3次。
2 结果与分析
2.1 突变体库的初筛
按1.2.1突变体筛选方法将95株形态突变体和潜在的形态突变体逐一筛选,与野生型菌株蛋白产量作比较,得到蛋白产量提高20%以上和下降20%以上的各4株 (图1)。如图2所示,突变株SZY11、SZY63、SZY69和SZY87蛋白产量比野生型菌株高20%以上,其中SZY69蛋白产量最高,约为野生型菌株的130%。突变株SZY32、SZY35、SZY39和SZY43的蛋白产量明显低于野生型菌株,其中突变株SZY35的蛋白产量仅为野生型菌株的65%。

图1 95株突变体蛋白含量分布图 (野生型菌株标记为五星,X轴表示95株突变体编号)Fig. 1 The distribution of protein concentration of 95 mutants (Star means wild type, X-axis shows the number of mutants).

图2 突变株的蛋白含量Fig. 2 Protein concentration produced by the wild type and mutants when grown on Avicel. *P < 0.05,** P <0.01.
2.2 突变株酶活力的测定
2.2.1 内切-β-1,4-葡聚糖酶活力的测定
将8株突变株与野生型菌株在产酶培养基中培养7 d,离心取上清,测定内切-β-1,4-葡聚糖酶活力。如图3所示,与野生型菌株相比,突变株SZY35、SZY39和SZY43酶活较低,SZY43最低,约为17 U/mL,比野生型菌株降低32%。而突变株SZY63、SZY69和SZY87酶活较高,最高可达到43 U/mL,比野生型菌株提高27%。SZY11和SZY32没有显著差异。
2.2.2 β-葡萄糖苷酶活力的测定
按实验方法1.2.3中的酶活测定方法,测定β-葡萄糖苷酶活力。从图3中看出,与野生型菌株相比,突变株SZY32、SZY39和SZY43酶活较低,其中SZY43最低,约为0.17 U/mL,比野生型菌株降低77%。SZY63酶活最高,约为1.45 U/mL,比野生型菌株提高100%。其余突变株没有显著变化。
结合两个酶酶活来讲,突变株SZY39和SZY43酶活均比野生型菌株低,突变株SZY63酶活均比野生型菌株有显著提高。

图3 突变株的内切-β-1,4-葡聚糖酶活力和β-葡萄糖苷酶活力Fig.3 Endo-β-1,4-glucanase activities and β-glucosidase activities produced by the wild type and mutants when grown on Avicel.
2.3 发酵液菌丝形态的观察
将8株突变株在以结晶纤维素为碳源的培养基中培养7 d,分别使用体视显微镜和电子显微镜观察发酵液菌丝形态。由图4可知,野生型菌株发酵液菌丝体呈丝状,纤维素残留量较少。突变株SZY32、SZY35和SZY39菌丝体也呈丝状,然而SZY35和SZY39发酵液中残留较多的纤维素晶体,这一点与这两株突变株低蛋白产量和低酶活水平的结果相符合。值得注意的是,突变株SZY11和SZY43菌丝形态呈菌球状,SZY11发酵液中菌球数量较多,表面更光滑,结晶纤维素残余量较少,而SZY43仅有少量菌球,表面粗糙,菌球中心致密,并包裹有较多的纤维素碎片,说明其对纤维素利用率较低,这与其发酵液蛋白水平降低和酶活下降的情况相吻合。
此外,突变株SZY63、SZY69和SZY87菌丝形态呈丝状,其中SZY69和SZY87菌丝比野生型菌株长,尤其是SZY87,菌丝形态变化显著(图4)。这种菌丝形态虽然在一定程度上利于营养成分的传递,发酵上清液中蛋白含量和酶活均有所提高,但会降低发酵液流变性能,增大发酵能耗。
2.4 发酵液粘度的测量
与野生型菌株相比,8株突变株发酵液中菌丝形态差异明显 (图4)。而菌丝形态与发酵液流变性能有着密切联系,且发酵液的流变性可通过发酵液粘度来衡量。如图5所示,突变株SZY11和SZY43发酵液粘度显著降低,分别为野生型菌株的25% 和50%。这一结果与这两株突变株在发酵液中呈菌球状的特征相符 (图4) 。突变株SZY39、SZY69和SZY87发酵液粘度明显升高,其中SZY87表现出较长的菌丝形态,粘度至少为野生型2倍。由此推测,丝状真菌在液体深层发酵过程中菌丝体呈球状,发酵液粘度值较小,具有优良的流变性能,而丝状菌丝体会使发酵液粘度升高,可能造成发酵条件异常,导致整个发酵失败。发酵液粘度大、流变性能差,严重影响营养物质的传递和利用,增大发酵过程中的搅拌和通氧能耗,不利于发酵工业节能减排绿色发展目标的实现。

图4 突变株的发酵液菌丝形态 (40倍和100倍,图中残留纤维素用黑框标出)Fig. 4 Micrograph of mycelial morphology of the wild type and mutants when grown on Avicel (40 fold and 100 fold, black frames represent cellulose residue).
2.5 发酵液菌丝干重
除发酵液菌丝形态的影响外,单位体积菌体干重的大小对发酵液粘度高低有着重大影响。通过测定摇瓶发酵7 d时的菌体干重,特别是蛋白产量明显升高的突变株的菌体干重,寻找影响发酵液粘度性状的真正原因。研究表明,野生型菌株纤维素水解率可达到98%,除突变株SZY35和SZY39以外,其余6株突变体纤维素水解率与野生型菌株相比,没有显著变化。与野生型菌株相比,突变株SZY35和SZY39发酵液中残留较多的结晶纤维素 (图4),但其菌丝干重却显著升高,相关基因在纤维素酶表达过程中的功能有待进一步深入研究。由图6发现,突变株SZY63菌丝干重显著下降,比野生型菌株减少约30%。突变株SZY11和SZY43菌丝干重与野生型菌株相比没有显著性差异,但其发酵液粘度却显著降低,说明其菌丝形态的变化引起发酵液粘度的降低。
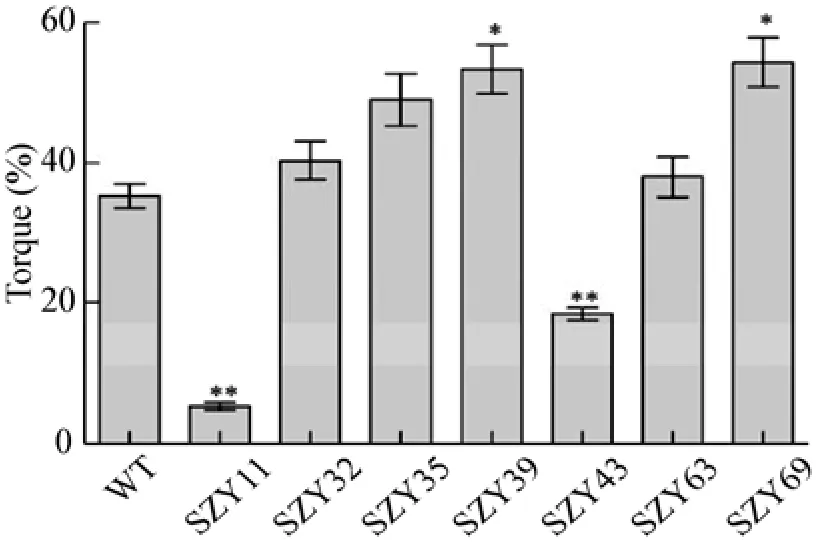
图5 突变株的发酵液粘度Fig. 5 Viscosity of the wild type and mutants when grown on Avicel. *P < 0.05,** P < 0.01.

图6 突变株的菌丝干重和结晶纤维素的水解率Fig. 6 Mycelial dry weight and hydrolysis rate of Avicel cellulose of the wild type and mutants when grown on Avicel.
3 讨论
N. crassa作为一种模式真核生物,其全基因组测序工作早在2003年已经完成[19],并被广泛用于遗传学、生物化学和分子生物学研究,已积累了大量的研究资源。Colot等于2006年构建了N. crassa单基因敲除突变体库[20],该突变体库是目前为止丝状真菌中基因覆盖率最大的一个突变体库,这使得在液体深层发酵过程中理性而系统地筛选与菌体形态相关的基因成为了可能。
本研究通过测定发酵上清液蛋白含量、酶活活力、发酵液粘度和菌丝干重,从95株形态突变体中筛出8株突变株,并利用显微镜观察其发酵液菌丝体形态。这8株菌分别命名为SZY11、SZY32、SZY35、SZY39、SZY43、SZY63、SZY69和SZY87,其所对应的突变基因如表1所示。

表1 突变株基因功能注释Table 1 Mutants gene annotation
突变株SZY11菌丝体呈球状,大小约为(350±60) µm,蛋白水平较野生型菌株提高25%,发酵液粘度降低75%,但酶活、菌丝干重均未增加。从表1看出,突变株SZY11缺失基因与细胞壁蛋白合成有关,由此推测,该基因对细胞壁结构的完整性起重要作用。该基因缺失或许影响菌丝极性延伸,使菌丝变短,更易形成球状,导致发酵液粘度降低。然而具有相似菌丝形态的突变株SZY43所缺失基因却是锌指转录因子。最近的研究表明,与纤维素降解相关的转录因子多来自锌指蛋白家族,其对纤维素酶和半纤维素酶的表达调控具有重要作用。该突变株菌丝形态呈球状,发酵液粘度降低50%,但发酵上清液蛋白含量降低22%,内切-β-1,4-葡聚糖酶和β-葡萄糖苷酶活力分别下降45%和75%。由此推测,该转录因子的缺失不仅改变发酵液菌体形态,而且影响纤维素酶的合成与分泌[21]。此外,另一锌指蛋白转录因子突变株SZY35发酵上清液蛋白含量降低30%,内切-β-1,4-葡聚糖酶活力下降23%。
突变株SZY87发酵液蛋白含量和酶活均有所提高,但其发酵液菌丝较长,粘度值显著升高。SZY87菌株缺失基因可编码一种晶状热激蛋白,野生型菌株在45 ℃高温处理后可诱导该蛋白表达,使其作为分子伴侣参与呼吸代谢,提高菌株的温度耐受性[22]。虽然并未将突变株SZY87在45 ℃下进行摇瓶培养,但在25 ℃下培养时,发现其发酵液中菌丝体呈长丝状 (图4),说明该热激蛋白对菌丝分化有一定影响,其生物学功能有待进一步研究探索。
无数研究表明,菌丝体形态与单个细胞的代谢存在密切联系,但目前我们还无法清晰地阐述这种潜在的代谢和调控机制。这些与菌丝分化相关基因的获得,为研究液体深层发酵过程中菌丝形态与代谢的关系提供了良好素材,有助于阐述关键基因对菌丝形态的作用,有利于深入分析菌丝形态变化对发酵性状的影响,为理性构建具有优良发酵性状的工程菌株奠定了基础,对丝状真菌工业发酵具有一定的实际指导意义。
REFERENCES
[1] Archer DB. Filamentous fungi as microbial cell factories for food use. Curr Opin Biotechnol, 2000, 11(5): 478–483.
[2] Meyer V. Genetic engineering of filamentous fungi—progress, obstacles and future trends. Biotechnol Adv, 2008, 26(2): 177–185.
[3] Lubertozzi D, Keasling JD. Developing Aspergillus as a host for heterologous expression. Biotechnol Adv, 2009, 27(1): 53–75.
[4] Papagianni M. Fungal morphology and metabolite production in submerged mycelial processes. Biotechnol Adv, 2004, 22(3): 189–259.
[5] Casas López JL, Sánchez Pérez JA, Fernández Sevilla JM, et al. Pellet morphology, culture rheology and lovastatin production in cultures of Aspergillus terreus. J Biotechnol, 2005, 116(1): 61–77.
[6] Gupta K, Mishra PK, Srivastava P. A correlative evaluation of morphology and rheology of Aspergillus terreus during lovastatin fermentation. Biotechnol Bioproc Eng, 2007, 12(2): 140–146.
[7] Znidarsic P, Pavko A. The morphology of filamentous fungi in submerged cultivations as a bioprocess parameter. Food Tech Biotechnol, 2001, 39(3): 237–252.
[8] Kossen NW. The morphology of filamentous fungi. Adv Biochem Eng Biotechnol, 2000, 70: 1–33.
[9] Zhou Y, Du J, Tsao GT. Mycelial pellet formation by Rhizopus oryzae ATCC 20344. Appl Biochem Biotechnol, 2000, 84(1-9): 779–789.
[10] Reichl U, King R, Gilles ED. Characterization of pellet morphology during submerged growth of Streptomyces tendae by image analysis. Biotechnol Bioeng, 1992, 39(2): 164–170.
[11] Oncu S, Tari C, Unluturk S. Effect of various process parameters on morphology, rheology, and polygalacturonase production by Aspergillus sojae in a batch bioreactor. Biotechnol Prog, 2007, 23(4): 836–845.
[12] Riley GL, Tucker KG, Paul GC, et al. Effect of biomass concentration and mycelial morphology on fermentation broth rheology. Biotechnol Bioeng, 2000, 68(2): 160–172.
[13] Bocking SP, Wiebe MG, Robson GD, et al. Effect of branch frequency in Aspergillus oryzae on protein secretion and culture viscosity. Biotechnol Bioeng, 1999, 65(6): 638–648.
[14] Watters MK, Boersma M, Johnson M, et al. A screen for Neurospora knockout mutants displaying growth rate dependent branch density. Fungal Biol, 2011, 115(3): 296–301.
[15] Ziv C, Kra-Oz G, Gorovits R, et al. Cell elongation and branching are regulated by differential phosphorylation states of the nuclear Dbf2-related kinase COT1 in Neurospora crassa. Mol Microbiol, 2009, 74(4): 974–989.
[16] Lee IH, Walline RG, Plamann M. Apolar growth of Neurospora crassa leads to increased secretion of extracellular proteins. Mol Microbiol, 1998, 29(1): 209–218.
[17] Updegraff DM. Semimicro determination of cellulose in biological materials. Anal Biochem, 1969, 32(3): 420–424.
[18] Coradetti ST, Xiong Y, Louise Glass N. Analysis of a conserved cellulase transcriptional regulator reveals inducer-independent production of cellulolytic enzymes in Neurospora crassa. Microbiol Open, 2013, 2(4): 595–609.
[19] Galagan JE, Calvo SE, Borkovich KA, et al. The genome sequence of the filamentous fungus Neurospora crassa. Nature, 2003, 422(6934): 859–868.
[20] Colot HV, Park G, Turner GE, et al. A high-throughput gene knockout procedure for Neurospora reveals functions for multiple transcription factors. Proc Natl Acad Sci USA, 2006, 103(27): 10352–10357.
[21] Chae MS, Nargang CE, Cleary IA, et al. Two zinc-cluster transcription factors control induction of alternative oxidase in Neurospora crassa. Genetics, 2007, 177(4): 1997–2006.
[22] Plesofsky-Vig N, Brambl R. Disruption of the gene for hsp30, an alpha-crystallin-related heat shock protein of Neurospora crassa, causes defects in thermotolerance. Proc Natl Acad Sci USA, 1995, 92(11): 5032–5036.
(本文责编 陈宏宇)
Improving cellulases production with Neurospora crassa by morphology mutants screening
Zhiyong Sun1,2, Liangcai Lin2, Min Wang1, and Chaoguang Tian2
1 College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China
2 Key Laboratory of Systems Microbial Biotechnology, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
Filamentous fungi are widely used for large-scale production of cellulases. Morphological characteristics of mycelia under submerged condition are closely correlated with cellulases productivity. In order to find out the critical genes involved in the mycelial morphology development and cellulases production in liquid fermentation, 95 Neurospora crassa morphological mutants (named as SZY1-95) were screened for cellulases production. Compared with the wild type, cellulases production in four mutants SZY32, SZY35, SZY39 and SZY43 were significantly decreased, whereas mutants SZY63, SZY69, SZY87 and SZY11 produced much more cellulases than that of the wild type strain. Meanwhile, endo-beta-1,4-glucanase activity, beta-glucosidase activity, viscosity of broth and dry weight of these mutants were measured. The mycelial morphology of the mutants was also studied by microscope. Particularly, pellets were formed in mutant SZY11 and SZY43, whose viscosities were 25% and 50% of the wild type strain, respectively. Mutant SZY87 appeared long hyphae, and the viscosity of its broth was at least 2 folds of the wild type strain. These results indicate that a single gene deletion could influence the mycelial morphology in liquid fermentation, and increased the cellulases production. The low-viscosity related genes identified in our study will be the potential candidates for genetic modification of filamentous fungi.
Neurospora crassa, mycelial morphology, viscosity of fermentation broth, cellulases
June 24, 2013; Accepted: October 23, 2013
Chaoguang Tian. Tel: +86-22-84861947; E-mail: tian_cg@tib.cas.cn.
Supported by: Knowledge Innovation Program of the Chinese Academy of Sciences (No. KSCX2-EW-G-8), National Basic Research Program of China (973 Program) (No. 2011CB707400), National High Technology Research and Development Program of China (863 Program) (No. SS2012AA023303).
中国科学院知识创新工程重要方向项目 (No. KSCX2-EW-G-8),国家重点基础研究发展计划(973计划) (No. 2011CB707400),国家高技术研究发展计划(863 计划) (No. SS2012AA023303) 资助。

