基于2-C-甲基-D-赤藓糖醇-4磷酸途径的产紫槐二烯大肠杆菌构建及其补糖策略优化
汪建峰,熊智强,张嗣良,王勇
1华东理工大学生物反应器工程国家重点实验室,上海200237
2中国科学院上海生命科学研究院植物生理生态研究所合成生物学重点实验室,上海200032
基于2-C-甲基-D-赤藓糖醇-4磷酸途径的产紫槐二烯大肠杆菌构建及其补糖策略优化
汪建峰1,2,熊智强2,张嗣良1,王勇2
1华东理工大学生物反应器工程国家重点实验室,上海200237
2中国科学院上海生命科学研究院植物生理生态研究所合成生物学重点实验室,上海200032
汪建峰,熊智强,张嗣良,等.基于2-C-甲基-D-赤藓糖醇-4磷酸途径的产紫槐二烯大肠杆菌构建及其补糖策略优化.生物工程学报,2014,30(1):64−75.
Wang JF,Xiong ZQ,Zhang SL,et al.Engineering MEP pathway in Escherichia coli for amorphadiene production and optimizing the bioprocess through glucose feeding control.Chin J Biotech,2014,30(1):64−75.
2-C-甲基-D-赤藻糖醇-4-磷酸(2-methyl-D-erythritol-4-phosphate,MEP)途径是大肠杆菌Escherichia coli唯一的萜类前体合成途径,研究表明它比甲羟戊酸(Mevalonate,MVA)途径具有更高的理论产率。但目前有关MEP途径的调控所知非常有限,故单独强化MEP途径对萜类异源合成产量的提高效果并不理想。研究中通过引入外源MEP途径基因强化E.coli萜类合成的遗传改造策略和发酵过程补糖控制优化,尝试更有效地释放MEP途径的潜力,建立青蒿素前体——紫槐二烯的高密度发酵过程。研究结果表明共表达阿维链霉菌Streptomyces avermitilis dxs2基因和枯草芽胞杆菌Bacillus subtilis idi基因可使紫槐二烯的摇瓶发酵产量比野生菌株提高12.2倍。随后针对该菌株建立了高密度发酵过程,发现稳定期的中前期(24−72 h)是产物合成的关键期,通过稳定期补糖速率的调整,明显改善了产物合成速度,使紫槐二烯的产量从2.5 g/L提高到了4.85 g/L,但不影响产物积累的周期。考虑到72 h后菌体老化可能会影响产物合成,进一步采取了调整对数期的补糖速率控制菌体生长的策略,使紫槐二烯的产量达到6.1 g/L。研究结果为基于MEP途径的萜类异源合成工程菌构建及其发酵工艺的建立奠定了基础。
MEP途径,紫槐二烯,大肠杆菌,高密度发酵,补糖速率
近十年随着合成生物学技术的快速发展,以常见的微生物如大肠杆菌Escherichia coli和酿酒酵母Saccharomyces cerevisiae作为通用底盘细胞构建高效细胞工厂,已经成为大规模生产植物源珍稀天然产物的重要手段[1-4]。青蒿素作为最有效的抗疟疾药物,其前体紫槐二烯及青蒿酸的微生物合成受到了广泛的关注。加州大学伯克利分校的研究人员通过在S.cerevisiae中改造甲羟戊酸(MVA)途径或在E.coli中引入外源MVA途径的策略成功地构建了高产紫槐二烯(Amorphadiene)和青蒿酸的工程菌[5-6]。
与所有的萜类化合物一样,紫槐二烯是由萜类通用前体——异戊烯焦磷酸(IPP)和二甲基烯丙基焦磷酸(DMAPP)装配合成的。野生型E.coli以2-C-甲基-D-赤藻糖醇-4-磷酸(MEP)途径作为唯一的萜类前体合成途径[7]。在过去的十多年研究人员针对E.coli MEP途径采取了简单强化或精细调控关键基因表达的策略,使重组菌株的紫杉二烯和β-胡萝卜素产量分别提高到1 g/L和2.1 g/L的[8-9]。Partow等[10]和Meng等[11]分别利用全基因组水平in silico代谢通量分析发现MEP途径比MVA途径具有更高的理论产率。但受限于MEP途径特性及调控机制研究不成熟,大多数情况下改造MEP途径所取得的效果与引入更成熟的MVA途径具有一定的差距[6,12-13],尤其是Keasling等通过对引入MVA途径进行一系列的改造后[6],使E.coli能够合成27.4 g/L的紫槐二烯。此外,对MEP途径的改造效果往往随着基因表达强度、宿主菌株以及下游产物的变化而变化[12,14-15]。因此MEP途径仍需要有更多的研究来进一步释放潜力。此外,除工程菌的遗传改造外,目前针对萜类化合物异源合成的发酵过程主要是基于传统高密度蛋白表达工艺建立的[16-17],仍缺乏针对性的发酵控制策略的研究。考虑到萜类合成与蛋白表达在基因表达和细胞代谢调控两个层次上存在很大差异,如蛋白表达过程往往采取先生长后表达的策略,尽可能多地让表达阶段的物质和能量用于蛋白质合成,而异源合成需要平衡前体和下游途径基因表达,合理分配物质和能量代谢流,使细胞减少副产物积累,尽可能多地支持目标产物的合成[18]。因此仍需要针对某个特定的异源合成工程菌株开展更深入的发酵过程研究,了解产物合成与菌体生长代谢的关系,以便在反应器水平最大限度地发挥菌株潜力。
本研究拟从引入异源MEP途径基因构建紫槐二烯异源合成工程菌株和菌株高密度发酵过程的糖流加控制策略两个方面入手,尝试最大限度地释放E.coli内源MEP途径合成紫槐二烯的潜力,为开发基于MEP途径的萜类异源合成工程菌株及其发酵工艺奠定了基础。
1 材料与方法
1.1 质粒、菌株、引物及相关试剂
本研究相关的质粒与引物如表1所示。菌株E.coli DH10B(Invitrogen)作为克隆宿主,E.coli BL21(DE3)(Novagen)作为产物合成的宿主。分子克隆相关的酶、DNA片段与质粒抽提纯化试剂盒分别由NEB公司、TaKaRa公司及Axygen公司提供。石竹烯标准品和十二烷分别由Sigma-Aldrich公司和上海一基生物试剂有限公司提供。各培养基组分、抗生素及其他相关试剂购自Oxoid、国药集团与上海生物工程有限公司。本研究中各抗生素的工作浓度如下:氨苄青霉素100 mg/L,卡那霉素50 mg/L。以下研究中根据菌株所含质粒的抗性添加抗生素。除发酵培养基外,补料培养基也按相同的浓度添加,不再做特别说明。
1.2 重组质粒的构建
质粒pJF23(图2A)由本实验室保存[19],含有编码E.coli法尼基焦磷酸合成酶基因(ispA)和密码子优化后的紫槐二烯合成酶基因(ads)的T7 Prom-ispA-ads-T7 Term人工操作子[23]。以相应菌株的基因组为模板,分别PCR扩增E.coli MG1655的1-脱氧木酮糖-5-磷酸合成酶的基因(dxs_EC)和异戊二烯焦磷酸异构酶的基因(idi_EC),阿维链霉菌(Streptomyces avermitilis MA 4680T的dxs2_SAV,枯草芽胞杆菌(Bacillus subtilis CMCC63501)的idi_BS。将基因dxs_EC、idi_EC、dxs2_SAV和idi_BS的PCR产物回收,并用限制性内切酶酶切后,连接到pET21d载体的相应位点上,获得质粒pJF39、pJF44、pJF554和pJF567。用XbaⅠ和XhoⅠ酶切pJF44,回收含idi_EC基因的DNA片段,将其插入到pJF39的SpeⅠ和XhoⅠ位点上,获得质粒pJF63。用XbaⅠ和SpeⅠ酶切pJF554,回收含idi_BS基因的DNA片段,将其插入到pJF568的SpeⅠ位点上,获得重组质粒经测序验证,选择dxs2_SAV和idi_BS基因插入方向一致的克隆,命名为pJF678(图2A)。
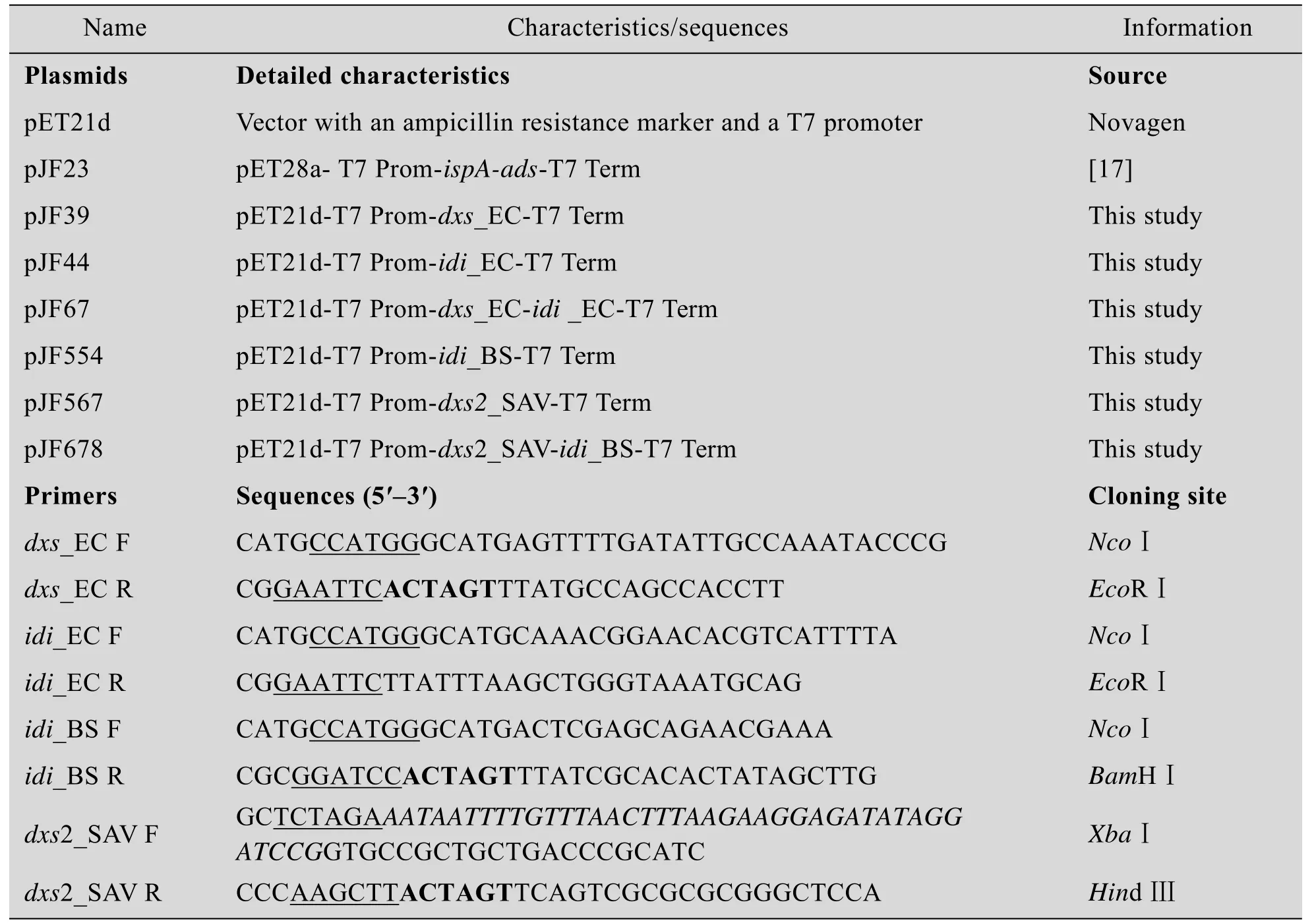
表1 本研究涉及的质粒与引物序列Table 1Plasmids and primers involved in this study
1.3 工程菌的发酵研究
1.3.1 发酵培养基
LB培养基(g/L):NaCl 10,蛋白胨10,酵母抽提物5。
摇瓶发酵培养基(g/L):Na2HPO4·7H2O 12.8,KH2PO43,NaCl 0.5,NH4Cl 1.0,MgSO4·7H2O 0.493,CaCl2·2H2O 0.0147,葡萄糖8。
补料分批培养基(体积1 L)[6]:基础料含K2HPO4·3H2O 15.7 g,KH2PO44.2 g,柠檬酸1.7 g, (NH4)2SO42 g葡萄糖15 g,MgSO4·7H2O 1.2 g和微量元素溶液Ⅰ10 mL。补料培养基含葡萄糖650 g,MgSO4·7H2O 12 g,(NH4)2SO410.7 g和微量元素溶液Ⅱ10 mL。微量元素溶液Ⅰ(g/L)含有CoCl2·6H2O 0.25,MnCl2·4H2O 1.5,CuCl2·2H2O 0.15,H3BO40.3,Na2MoO4·2H2O 0.25,Zn(CH3COO)2·2H2O 1.3和柠檬酸三铁10。微量元素溶液Ⅱ(g/L)含有CoCl2·6H2O 0.4,MnCl2·4H2O 2.35,CuCl2·2H2O 0.25,H3BO40.5,Na2MoO4·2H2O 0.4,Zn(CH3COO)2·2H2O 1.6和柠檬酸三铁4。
1.3.2 发酵种子的制备
将质粒pJF23与MEP途径改造相关的质粒(pET21d作为空白对照)共转化BL21(DE3),挑取单菌落至10 mL液体LB培养基中,37℃、250 r/min过夜培养12 h,用15 mL无菌离心管离心收集菌体后,加入等体积15%的甘油悬浮,–80℃冻存后作为摇瓶发酵种子和补料分批发酵的一级种子。
将–80℃冻存的甘油种子以1%的接种量接种到含50 mL LB培养基的500 mL摇瓶中,37℃、250 r/min培养6 h,作为补料分批发酵二级种子。
1.3.3 摇瓶发酵
取10 mL摇瓶发酵培养基于100 mL的摇瓶中,按2%的接种量将–80℃冻存的甘油种子接种到摇瓶中,同时加入20%的十二烷和终浓度为0.1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(IPTG)进行初始诱导,置于250 r/min、28℃的摇床上发酵培养3 d或者5 d后,进行产物检测。
1.3.4 发酵罐系统配置与参数采集
采用上海国强生化工程装备公司生产的5 L发酵罐系统,配有溶氧、温度和pH电极,罐体和补料称重装置,SHP8400PMS过程气体质谱仪等在线监测设备。发酵过程溶氧、温度、pH、氧摄取速率(OUR)和二氧化碳释放速率(CER)等在线参数由Biostar 2.0(由华东理工大学国家生化工程技术研究中心(上海)开发)软件包采集计算。
1.3.5 补料分批发酵
按5%的接种量,将二级种子接种到装液量为1 L的发酵罐中。为了减少菌体生长延迟期,发酵过程的初始温度为37℃,转速恒定800 r/min,通气量维持在1 vvm,自动补加氨水控制pH为 7.0。经过约3 h的延迟期后,菌体开始进入对数生长期,约7 h后菌体浓度(OD600)达到–10左右后,迅速降温至28℃,并加入200 mL十二烷和终浓度为0.1 mmol/L的IPTG诱导培养。随后待基础料中葡萄糖耗尽,溶氧开始回升后,开始流加碳源。整个发酵过程分两个阶段控制糖的流加,按图1所示分别对各工艺对数期和稳定期的流加速率进行控制。待OD600至200左右以后(进入稳定期),将补料速度设定为恒定速率补加。

图1 各过程的补糖速率Fig.1Profile of glucose addition rate of each feed-batch fermentation process in this study.
1.4 发酵过程离线参数检测、质粒稳定性分析与紫槐二烯的定量
残糖浓度检测:采用二硝基水杨酸法[20]。
铵离子浓度检测:采用苯酚-次氯酸盐法[21]。
质粒稳定性测试:在无菌条件下,将培养液稀释进行梯度稀释,选取合适的梯度涂布无抗性LB固体平板和加有氨苄青霉素和卡那霉素双抗性的平板。用抗性平板单菌落数与无抗性平板单菌落数的比值表征双质粒系统稳定性。
乙酸检测:色谱条件为TSKgel ODS-100ZC18色谱柱(250 mm×25 mm,5 μm),流动相为25 mmol/L KH2PO4缓冲液(pH 2.5):乙腈=98∶2,流速1.0 mL/min,检测波长210 nm,柱温30℃;紫槐二烯定量:按Tsuruta等[6]报道的条件,采用GC-MS (Thermo Scientific TRACE GC-ISQ)对紫槐二烯进行定量。取500μL的发酵液(保证十二烷均匀分布),用等体积的乙酸乙酯进行萃取一次,离心收集有机相,用乙酸乙酯对有机相进行一定的稀释后进样检测。以类似物石竹烯作为标准品采用选择离子扫描模式(204、189离子)进行GC-MS分析。
2 结果与分析
2.1 表达异源MEP途径基因模块对E.coli合成紫槐二烯的影响
已有的研究表明dxs和idi基因是E.coli MEP途径中最关键的限速基因[8-9]。强化dxs和idi基因的表达能够有效地提高MEP途径的代谢通量[8-9],强化下游萜类化合物的合成。从图2可以看到,单独过表达E.coli内源dxs和idi基因的菌株经5 d的摇瓶发酵后,紫槐二烯的产量分别为10.756 mg/L和9.552 mg/L,相比于对照菌株(6.552 mg/L),分别提高了64%和46%。该结果表明在BL21(DE3)菌株中强化E.coli内源MEP途径基因对提高amorphadiene的合成是比较有限。考虑到自然界中MEP途径基因在酶活及调控特性方面的多样性[22-23],本研究组在前期的研究中挖掘了链霉菌属、糖多孢菌属、芽胞杆菌属、欧文氏菌属等不同来源的MEP途径基因,发现通过表达S.avermitilis的dxs2基因和B.subtilis的二型idi基因能够显著地提升MEP途径前体供应,增加紫槐二烯的产量。由图2B可知,在M9培养基中摇瓶发酵5 d后,单独过表达dxs2_SAV(BL21(DE3) pJF567/pJF23)和idi_BS(BL21(DE3) pJF554/pJF23)基因能够使紫槐二烯的产量达到24.91 mg/L和53.50 mg/L,分别比对照菌BL21(DE3)pET21d/pJF23提高了3.8和8.2倍。此外,引入dxs2_SAV比过表达内源dxs_EC提高了2.3倍,引入idi_BS比过表达idi_EC提高了5.6倍。随后构建了T7 Prom-dxs2_SAV-idi_BS-T7 Term操纵子(pJF678)共表达dxs2_SAV和idi_BS模块进一步提高紫槐二烯的合成,菌株BL21(DE3)pJF678/pJF23能够合成80.22 mg/L的紫槐二烯,比野生菌提高了12.2倍。这些结果表明引入某些外源MEP途径基因比强化内源基因能更显著地释放MEP途径的潜力。外源MEP途径基因为E.coli MEP途径重新设计和改造提供了丰富的元件。
2.2 补料分批高密度发酵过程的建立
为了考察菌株BL21(DE3)pJF678/pJF23在发酵过程中的代谢潜能,本研究先建立了紫槐二烯的高密度发酵过程(过程1),考察了整个发酵过程中OUR、CER、菌体生长、紫槐二烯产量、残糖浓度和乙酸浓度状况。为了减少发酵过程副产物乙酸的积累,在保证对数期快速生长的前提下,整个发酵过程糖流加速率控制在较低的水平(图1,稳定期为6.05 g/h),以使对数期和稳定期的DO分别维持在20%−30%和60%−70%。由图3可知对数期菌体生长非常迅速,约24 h后OD600达到200以上,OUR和CER分别达到了192.09mmol/(L·h)和196.09 mmol/(L·h)。随后进入稳定期,补糖速率维持在6.05 g/h,菌体仍保持微弱的生长,OD600缓慢增长到225左右(60 h),OUR和CER逐渐减小,36 h以后维持在60−70 mmol/(L·h)。在对数期后期,产物已开始合成,尤其是在24−72 h,产物迅速积累。直到84 h,紫槐二烯的产量达到最大,为2.50 g/L。质粒稳定性测试发现120 h时双质粒的稳定性维持在78%以上,因此质粒稳定性对后期产物合成减慢不会产生影响。整个发酵过程中残糖和乙酸浓度控制在很低水平,仅有对数期后期和稳定期后期有少量的残糖(1.32 g/L)和乙酸积累(46.78 mg/L),不会对菌体产生抑制作用。以上结果表明发酵过程中工程菌株能够稳定的存在,发酵24−72 h是产物合成的关键时期。因此对稳定期控制策略的调整对于强化产物的合成可能具有重要的作用。

图2 产萜类大肠杆菌工程菌的构建及紫槐二烯的合成Fig.2 Construction of recombinant E.coli strain for isoprenoid production and biosynthesis of amorphadiene.(A) Strategy for the construction of engineered strains and the maps of plasmids responsible for MEP pathway engineering(pJF678)and amorphadiene pathway assembly(pJF23).(B)Amorphadiene yield for engineered strains.

图3 产萜类大肠杆菌工程菌补料分批发酵过程参数曲线Fig.3Process parameters of an E.coli feed-batch fermentation process for isoprenoid production.(A)The variation of DO,OUR and CER.(B)The variation of OD600,amorphadiene yield,acetate concentration and residual glucose.
2.3 稳定期补糖控制对紫槐二烯合成的影响
从过程1可以发现稳定期的24−72 h是紫槐二烯快速合成的关键时期,于是我们希望通过调整稳定期的补糖速率来强化产物合成速率和延长产物合成期来增加紫槐二烯的产量。考虑到过程1稳定期糖流加速率(6.05 g/h)较低,本研究以此为基础,在维持对数期补糖不变的情况下,通过逐步增加稳定期糖流加速率来考察菌体生长代谢和产物合成的变化。过程2(9.152 g/h)和过程3(14.08 g/h)稳定期菌体OD600缓慢增加到270左右,OUR分别维持在约90−100 mmol/h和120−130 mmol/h,DO则分别恒定在40%−50%和25%−35%。过程4(19.52 g/h)糖流加速率最大,OD600与过程1相当,维持在230左右,OUR从24 h的198.24 mmol/(L·h)逐渐下降到120 h的30.76 mmol/(L·h),同时伴随着DO逐步上升。比较4个过程的产物的积累情况可以发现(图4D),过程2–4与过程1一样,产物均在24−72 h快速合成,最终过程2获得了最高的紫槐二烯产量,发酵72 h后达到了4.85 g/L,比过程1提高了94%。60 h左右,过程3的产物合成速度与过程2相比,开始变慢,这可能是过程3的副产物乙酸积累比过程2更快引起的。过程4的补糖速率达到19.52 g/h,进入稳定期后乙酸马上即开始快速积累,48 h时即达到2.73 g/L,严重地影响了发酵过程菌体的生长和产物的积累。从质粒稳定性的测试发现过程2和过程3的质粒稳定性与过程1相似,120 h时仍维持在70%,过程4丢失比较严重,120 h仅为18%左右。以上结果表明,通过产物合成关键期补糖速率的调整,可以显著地增加产物合成速率,增加紫槐二烯的产量,但无法延长产物合成周期。
2.4 控制对数生长期补糖对菌体生长及紫槐二烯合成的影响
从2.3的结果稳定期补糖速率调整虽然可以改变24−72 h产物合成的速率,无法进一步延长产物的积累时间。考虑到萜类合成需要MEP途径提供DMAPP和IPP前体以及大量的ATP、还原力,而无论MEP途径活性和ATP、还原力均与菌体生长息息相关。稳定期中前期的24−72 h,菌体代谢活力较旺盛,能提供较多的能量和辅因子,同时MEP途径活性维持在较高的水平,因此工程菌株可以维持较活跃的异源代谢。基于这个推测,本研究进一步调整了对数期糖流加速率,希望通过延长菌体生长周期,达到延长产物合成时间,来增加紫槐二烯的最终产量。因此,在维持稳定期补糖为9.152 g/h的情况下,调整了对数生长期的糖流加速率(图1A,过程5),使对数期DO维持在40%−50%左右(图5A)。由图5B可以看到,OD600值在约48 h时才达到200,随后进入稳定期恒速补糖阶段。在48−108 h菌体浓度缓慢增加直到约108 h,OD600达到最大值为258.64。紫槐二烯的产量也一直保持增长,直到约108 h达到最大值为6.1 g/L,在过程2的基础上又提高了25.7%。该结果表明通过适当地减慢菌体生长,可以使菌体调节到更有利于异源萜类代谢产物合成的生理状态。

图4 稳定期补糖速率优化的影响Fig.4Effects of glucose feeding rate optimization during stationary phase.(A)The DO variation of process 1–4. (B)The acetate accumulation of process 1–4.(C)The OD600variation of process 1–4.(D)The amorphadiene accumulation of process 1–4.

图5 对数生长期糖流加速率调整对产萜类大肠杆菌补料分批发酵的影响Fig.5Effects of glucose feeding rate during stationary phase to a feed-batch fermentation process.(A)The variation of DO,OUR and CER.(B)The variation of OD600,amorphadiene yield,acetate concentration and residual glucose.
3 讨论
随着菌株及下游途径产物的变化,MEP途径关键基因强化对萜类合成的影响是不同[12,14-15]。Yuan等[12]在菌株MC1061中强化了染色体上dxs和idi的表达,使β-胡萝卜素的产量提高幅度达到2倍和1.4倍。Zhao等[14]在BL21(DE3)中过表达dxs,使异戊二烯产量提高幅度仅为50%。Morrone等[15]在C41 Overexpress菌株中过表达dxs和idi后使松香二烯的产量分别降低了50%和提高了50%。这些研究不仅表明MEP途径关键基因的强化对提高不同下游萜类产物的合成是不同的,而且也说明了简单强化内源MEP途径基因表达的策略对提高萜类的合成是相对有限的。在过去的十多年里,多种外源的MEP途径基因已经被用于E.coli MEP途径的强化,并更有效地改善了异戊二烯和番茄红素等萜类化合物的合成[22-24]。这些研究预示着不同来源的MEP途径基因可以为E.coli内源MEP途径的改造提供丰富的元件。随着大量微生物基因组信息的积累,链霉菌等原核生物被发现含有非常多样的MEP途径基因元件[25],如S.avermitilis和B.subtilis自身均以MEP途径作为萜类前体途径合成geosmin[25]和异戊二烯[26]等次级代谢产物。本实验室在前期的研究中通过对链霉菌属、糖多孢菌属、芽胞杆菌属和欧文氏菌属MEP途径模块的挖掘,idi基因发现dxs2_SAV和idi_BS这两个MEP途径基因能够非常显著地改善E.coli MEP途径的活性。基于此,本研究共表达dxs2_SAV和idi_BS两个外源MEP途径基因模块,使工程菌在摇瓶中紫槐二烯的产量比野生菌提高了12.2倍,有效地释放MEP途径的巨大潜力。基因组信息分析发现S.avermitilis中存在着dxs1和dxs2两个不同的dxs基因。在工程菌中表达了dxs2_SAV基因,能够比强化E.coli自身dxs基因更明显地提高萜类的合成,而表达dxs1_SAV对紫槐二烯的合成没有影响(未提供数据)。这说明S.avermitilis的dxs1和dxs2基因与M.tuberculosis的dxs1和dxs2一样,具有完全不同的酶活与调控特性[23]。B.subtilis的IDI酶是典型的二型IDI酶。单独过表达idi_BS能够使紫槐二烯合成提高8.2倍,该发现与已报道的某些II型IDI酶比I型IDI酶更能释放MEP途径活性一致[24]。该研究也证明了丰富的异源MEP途径基因资源是MEP途径潜力挖掘的重要模块。
基于传统蛋白表达的E.coli高密度发酵方法[18],本研究首先建立了简单的补料分批培养过程,发现稳定期的24–72 h是紫槐二烯积累的关键时期。对发酵过程稳定期糖流加速率进行优化调控后,紫槐二烯产量提高了94%。无论是化合物异源合成还是蛋白表达高密度培养过程,葡萄糖作为唯一碳源,为菌体生长维持和产物的合成提供必要的物质基础和ATP、NADPH等能量与辅因子。但异源合成与蛋白表达在基因表达、生理代谢两个层次上存在很大差异。蛋白表达往往需要将尽可能多的物质和能量导向蛋白质合成代谢以使蛋白质合成最大化,而异源合成需要实现前体及下游途径基因的适量表达,以平衡物质和能量代谢流的平衡,尽可能多地导向目的产物的合成[28]。因此与蛋白表达一样[29],建立适合异源合成工程菌的糖流加工艺对产物合成具有显著的影响。在过程1和过程2中的糖流加速率下,没有明显的副产物乙酸积累,过程2比过程1具有更大糖耗和代谢流以支持产物合成。继续增大补糖后,过程3中60 h后乙酸积累增加,影响了产物的合成,而过程4中,由于补糖速率过大,菌体生长和产物合成受到明显抑制。因此通过产物合成期的糖流加速率的优化可以找到平衡工程菌物质和能量代谢之间、自身生长维持与异源代谢之间的控制点,从反应器水平最大限制度发挥工程菌的潜力。此外稳定期补糖速率的调整无法延长产物快速积累的周期。而通过调整对数期的补糖速率来延长菌体生长周期的策略,可以有效地延长产物的积累。这可能是因为当前期菌体快速生长时,发酵到72 h时菌体已开始老化,而MEP途径是与菌体生长密切相关,菌体老化导致细胞维持代谢消耗增加,进入MEP途径的代谢流量减少,从而影响工程菌萜类前体的供应。延长菌体的生长周期,可以较长时间地保持菌体代谢活力和萜类前体的供应,增加紫槐二烯的产量。
REFERENCES
[1]Yadav VG,De Mey M,Lim CG,et al.The future of metabolic engineering and synthetic biology: towards a systematic practice.Metab Eng,2012, 14(3):233–241.
[2]Lee JW,Na D,Park JM,et al.Systems metabolic engineering of microorganisms for natural and non-natural chemicals.Nat Chem Biol,2012,8(6): 536–546.
[3]Keasling JD.Manufacturing molecules through metabolic engineering.Science,2010,330(6009): 1355–1358.
[4]Immethun CM,Hoynes-O'Connor AG,Balassy A,et al.Microbial production of isoprenoids enabled by synthetic biology.Front Microbiol, 2013,4(75):1–8.
[5]Ro DK,Paradise EM,Ouellet M,et al.Production of the antimalarial drug precursor artemisinic acid in engineered yeast.Nature,2006,440(7086): 940–943.
[6]Tsuruta H,Paddon CJ,Eng D,et al.High-level production of amorpha-4,11-diene,a precursor of the antimalarial agent artemisinin,in Escherichia coli.PLoS ONE,2009,4(2):e4489.
[7]Rodriguez-Concepcion M,Boronat A.Elucidation of the methylerythritol phosphate pathway for isoprenoid biosynthesis in bacteria and plastids.A metabolic milestone achieved through genomics. Plant Physiol,2002,130(3):1079–1089.
[8]Ajikumar PK,Xiao WH,Tyo KE,et al.Isoprenoid pathwayoptimizationforTaxolprecursor overproduction in Escherichia coli.Science,2010, 330(6000):70–74.
[9]Zhao J,Li Q,Sun T,et al.Engineering centralmetabolicmodulesofEscherichiacolifor improvingβ-caroteneproduction.MetabEng, 2013,17(0):42–50.
[10]PartowS,SiewersV,DavietL,etal. Reconstruction and evaluation of the synthetic bacterialMEPpathwayinSaccharomyces cerevisiae.PLoS ONE,2012,7(12):e52498.
[11]Meng H,Wang Y,Hua Q,et al.In silico analysis andexperimentalimprovementoftaxadiene heterologousbiosynthesisinEscherichiacoli. Biotechnol Bioproc E,2011,16(2):205–215.
[12]MorroneD,LowryL,DetermanMK,etal. Increasingditerpeneyieldwithamodular metabolicengineeringsysteminE.coli: comparison of MEV and MEP isoprenoid precursor pathway engineering.Appl Microbiol Biotechnol, 2010,85(6):1893–1906.
[13]MartinVJ,PiteraDJ,WithersST,etal. Engineering a mevalonate pathway in Escherichia coli for production of terpenoids.Nat Biotechnol, 2003,21(7):796–802.
[14]Zhao Y,Yang J,Qin B,et al.Biosynthesis of isoprene in Escherichia coli via methylerythritol phosphate(MEP)pathway.ApplMicrobiol Biotechnol,2011,90(6):1915–1922.
[15]YuanLZ,RouvièrePE,LaRossaRA,etal. Chromosomalpromoterreplacementofthe isoprenoidpathwayforenhancingcarotenoid production in E.coli.Metabolic Engin,2006,8(1): 79–90.
[16]AlperH,MiyaokuK,StephanopoulosG. Characterization of lycopene-overproducing E.coli strains in high cell density fermentations.Appl Microbiol Biotechnol,2006,72(5):968–974.
[17]NewmanJD,MarshallJ,ChangM,etal. High-level production of amorpha-4,11-diene in a two-phase partitioning bioreactor of metabolically engineered Escherichia coli.Biotechnol Bioeng, 2006,95(4):684–691.
[18]Lee SY.High cell-density culture of Escherichia coli.Trends Biotechnol,1996,14(3):98–105.
[19]Meng H,Wang J,Xiong Z,et al.Quantitative designofregulatoryelementsbasedon high-precision strength prediction using artificial neural network.PLoS ONE,2013,8(4):e60288.
[20]Miller GL.Use of dinitrosalicylic acid reagent for determination of reducing sugar.Analyt Chem, 1959,31(3):426–428.
[21]LiBQ,DengYJ,YangJW.Determining concentrationofammoniumioninexternal environmentofblankliposomeby phenol-hypochlorite reaction.Chin J Pharm,2006, 4(4):181–185(in Chinese).李宝齐,邓英杰,杨静文.苯酚-次氯酸盐法测定空白脂质体透析液中铵离子浓度.中国药剂学杂志,2006,4(4):181–185.
[22]BerthelotK,EstevezY,DeffieuxA,etal. Isopentenyl diphosphate isomerase:A checkpoint to isoprenoid biosynthesis.Biochimie,2012,94(8): 1621–1634.
[23]BrownAC,EberlM,CrickDC,etal.The nonmevalonate pathway of isoprenoid biosynthesis in Mycobacterium tuberculosis is essential and transcriptionally regulated by dxs.J Bacteriol, 2010,192(9):2424–2433.
[24]Kajiwara S,Fraser PD,Kondo K,et al.Expression of an exogenous isopentenyl diphosphate isomerase geneenhancesisoprenoidbiosynthesisin Escherichia coli.Biochem J,1997,324(Pt 2): 421–426.
[25]Rad SA,Zahiri HS,Noghabi KA,et al.Type 2 IDI performs better than type 1 for improving lycopene production in metabolically engineered E.coli strains.World J Microb Biotechnol,2012,28(1): 313–321.
[26]Cane DE,He X,Kobayashi S,et al.Geosmin biosynthesis in Streptomyces avermitilis.Molecular cloning,expression,and mechanistic study of the germacradienol/geosmin synthase.J Antibiot,2006, 59(8):471–479.
[27]WagnerWP,HelmigD,FallR.Isoprene biosynthesisinBacillussubtilisviathe methylerythritol phosphate pathway.J Nat Prod, 2000,63(1):37–40.
[28]NaD,KimTY,LeeSY.Constructionand optimization of synthetic pathways in metabolic engineering.Curr Opion Microbiol,2010,13(3): 363–370.
[29]LiX,TaylorKB.Effectofglucoseonthe expression parameters of recombinant protein in Escherichia coli during batch growth in complex medium.Biotechnol Prog,1994,10(2):160–164.
(本文责编陈宏宇)
Engineering MEP pathway in Escherichia coli for amorphadiene production and optimizing the bioprocess through glucose feeding control
Jianfeng Wang1,2,Zhiqiang Xiong2,Siliang Zhang1,and Yong Wang2
1 State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai 200237,China 2 Institute of Plant Physiology and Ecology,Shanghai Institutes for Biological Sciences,Chinese Academy of Sciences,Shanghai 200032, China
The pathway of 2-methyl-D-erythritol-4-phosphate(MEP)is the exclusive isoprenoid precursor biosynthetic pathway in Escherichia coli,with a higher theoretical yield than mevalonate(MVA)pathway.However,due to lack of information about the regulation of MEP pathway,only engineering MEP pathway in E.coli achieved limited improvement of heterologous isoprenoid production.We used exogenous MEP pathway genes to improve MEP pathway in E.coli and optimized the glucose feeding to release the potential of MEP pathway.The results demonstrate that co-expression of dxs2 from Streptomyces avermitilis and idi from Bacillus subtilis can increase amorphadiene production with 12.2-fold compared with the wild-type strain in shake flask fermentation.Then we established a high-cell density fermentation process for the engineered strain,and found that the phase from 24 to 72 h is important for product biosynthesis.The optimization of glucose feeding rate during 24 to 72 h significantly improved product accumulation,which was improved from 2.5 to 4.85 g/L,within the same process time.Considering the attenuation of strain metabolism after 72 h,this study further modulated the glucose feeding rate during exponential phase to control strain growth and the amorphadiene yield eventually reached to 6.1 g/L.These results provided useful information to develop engineered E.coli for isoprenoid production through MEP pathway engineering.
2-methyl-D-erythritol-4-phosphate pathway(MEP pathway),isoprenoids,Escherichia coli,high-cell density fermentation,glucose feeding rate
September 30,2013;Accepted:November 29,2013
Siliang Zhang.Tel/Fax:+86-21-64252565;E-mail:siliangz@ecust.edu.cn Yong Wang.Tel/Fax:+86-21-54924295;E-mail:yongwang@sibs.ac.cn
Supported by:National Basic Research Program of China(973 Program)(No.2012CB721104),National High Technology Research and Development Program(863Program)(No.2012AA02A701),National Natural Science Foundation of China(Nos.31170101,31100073), Major Projects of Knowledge Innovation Program of Chinese Academy of Sciences(No.KSCX2-EW-J-12).
国家重点基础研究发展计划(973计划)(No.2012CB721104),国家高技术研究发展计划(863计划)(No.2012AA02A701),国家自然科学基金(Nos. 31170101, 31100073),中国科学院知识创新工程重大项目(No. KSCX2-EW-J-12) 资助。

