非小细胞肺癌中PAX6表达及其对肿瘤细胞增殖与侵袭作用机制研究
武汉市第一医院呼吸科,湖北 武汉 430022
非小细胞肺癌中PAX6表达及其对肿瘤细胞增殖与侵袭作用机制研究
熊安洲 陈菁 曹艳 胡小萍
武汉市第一医院呼吸科,湖北 武汉 430022
背景与目的:转录因子PAX6主要表达于胚胎期,不同肿瘤中PAX6呈现高表达,通过不同的信号通路发挥肿瘤抑制或促进作用。检测PAX6在非小细胞肺癌(non-small cell lung cancer,NSCLC)中的表达,通过RNAi下调其表达,研究PAX6对肿瘤细胞侵袭和增殖力以及cyclin E、p38表达水平的影响。方法:应用蛋白印记检测86例NSCLC肿瘤组织及癌旁配对组织以及2例细胞系中PAX6的表达情况。应用PAX6特异性siRNA序列,转染NSCLC细胞系A549,MTT法、Transwell小室、划痕实验检测转染前后细胞增殖、侵袭和迁移能力的对比。蛋白质印记法(Western blot)检测转染前后cyclin E及p38表达情况。结果:对比癌旁组织及正常人支气管上皮细胞16HBE,PAX6在NSCLC组织及A549细胞系中显著高表达。选取高效siRNA序列转染细胞系后,PAX6表达的下调抑制了肿瘤细胞的增殖及集落形成,G1期细胞比例增加,细胞侵袭及迁移力均下降。PAX6基因敲低细胞cyclin E及p38活性受到抑制,表达下调。结论:PAX6通过调控MAPK通路及cyclin E的表达加速肿瘤细胞的增殖、侵袭及迁移,是潜在的NSCLC诊疗靶点。
非小细胞肺癌;PAX6;SiRNA;p38;Cyclin E
肺癌是常见的恶性肿瘤之一,根据生物学行为不同,肺癌分为非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lungcancer,SCLC),其中NSCLC的比率高达80%,且NSCLC的发病率和死亡率一直居高不下。近来的研究发现,肺癌是诊断率最高的肿瘤,同时也是致死率最高的恶性肿瘤之一。本研究拟探讨NSCLC的侵袭转移分子机制,寻找早期诊断和治疗的NSCLC特异性标志物。
PAX6基因隶属PAX基因家族,编码成对盒转录因子,在发育和疾病进展过程中发挥作用。PAX6是胚胎形成期重要的转录因子,同时也是干细胞因子,在胰腺癌、胃肠肿瘤中呈现高表达[1-2],这提示其在肿瘤形成中可能发挥作用。本研究旨在揭示PAX6在NSCLC中表达及对肺癌细胞系的侵袭、增殖及迁移力的影响,并初步探讨其作用的可能机制。
1 材料和方法
1.1 组织样本及细胞系
收集武汉市第一医院2008年1月—2012年9月外科手术治疗的NSCLC患者,随访3~5年,选取具有完整临床、病理和随访资料的NSCLC石蜡标本86例组成实验组,所有患者术前均未接受放、化疗或靶向治疗。配对癌旁组织作为对照组。其中男性39例、女性15例,年龄25~78岁,平均45.23岁。患者临床资料见表1。人类肺腺癌细胞系A549作为实验组,人支气管上皮细胞16HBE作为对照组,肺癌细胞系培养使用加入10%胎牛血清的RPMI-1640培养基,16HBE细胞则使用加入10%胎牛血清的MEM-EBSS液体培养基。
1.2 主要试剂及设备
PAX6特异性siRNA序列(5'-GAGTAGCG ACTCCAGAAGT-3')及无沉默作用的siRNA序列NS-siRNA(5'-TTCTCCGAAC GTGTCACGT-3')由上海吉玛制药技术有限公司合成;蛋白质印迹法(Western blot)所用抗体购自Abcam公司。MTT、二甲基亚砜(DMSO)购自美国Sigma公司;RNA提取TRIzol试剂盒、脂质体LipofectamineTM2000购自美国Invitrogen公司。qPCR仪(7500 Fast Real-Time PCR系统)和普通PCR仪(2720热循环仪)均购自ABI公司,凝胶成像分析系统(GelDoc-It TS Imaging System)购自UVP公司。A549及16HBE细胞系购自中国科学院上海生命科学研究院生物化学与细胞生物学研究所。

表1 肺癌患者一般临床资料Tab. 1 Patients and clinical characteristics
1.3 方法
1.3.1 siRNA转染
A549细胞在10%胎牛血清的RPMI-1640培养基中生长至占培养皿90%时消化,离心,转入24孔板。当细胞生长到约50%~60%的融合面积时进行转染。实验分为3组,空白对照组仅加入转染液,转染PAX6特异性siRNA组和转染NS-siRNA的阴性对照组。
1.3.2 RNA、DNA及蛋白质提取
包括蜡块包埋组织及细胞中核酸及蛋白的提取,提取试剂盒购自天根公司,依照试剂盒操作步骤进行实验,提取过程中注意样品的污染和降解,RNA提取全程在冰上操作,提取样品于-80 ℃保存,DNA样品于-20 ℃保存,通过琼脂糖凝胶电泳及紫外分光光度仪测定所提取核酸浓度和纯度,蛋白定量采用考马斯亮蓝法。
1.3.2 逆转录及定量PCR检测
本实验采用比较Ct值的相对定量法,以GAPDH为管家基因,应用2-ΔΔCt进行分析。定量PCR反应体系及反应条件(25 μL):SYBR premix(2×)12.5 μL,目的基因上、下游引物各0.5 μL,cDNA模板2.0 μL,ddH2O 9.5 μL,反应条件:95 ℃预变性5 min;95 ℃ 15 s,60 ℃30 s,72 ℃ 30 s,共40个循环。
1.3.3 Western blot检测蛋白的表达水平
转染72 h后提取细胞总蛋白,标准曲线法定量,上样量为30 μg,SDS-PAGE凝胶90 V电泳3 h,经转膜、抗体温育、显色等常规步骤。图像灰度分析比较蛋白表达水平,以β-actin为内参照。
1.3.4 细胞增殖能力检查(MTT法)
转染24 h后,将转染组细胞与对照组细胞接种于96孔板,每孔体积200 μL,细胞数2×103个细胞,每组细胞接种6孔,以培养液为空白对照,培养24 h,使用MTT试剂盒检测细胞增殖,每孔加5 mg/mL MTT,培养4 h后弃去上清液加150 μL DMSO,震荡10 min,采用用酶标仪检测吸光度(A)值,波长490 nm,DMSO为内参对照,连续测4 d,绘制细胞生长曲线。
1.3.5 Transwell小室检测细胞侵袭力
Transwell小室检测细胞侵袭力,小室外为加15%胎牛血清的RPMI-1640培养液500 μL,小室内为200 μL含5×103个细胞的肿瘤细胞悬液,RPMI-1640培养液中加2%胎牛血清,每组重复6个样本。培养24 h,取出小室,擦去微孔膜上层细胞,染色,计数移至下层的细胞数。
1.3.6 划线法检测细胞迁移力
24孔培养板内,每孔细胞数5×104个,至形成单层细胞,用直径1 mm消毒不锈钢探针在底部划横线,冲洗细胞碎片后继续培养,观察0、24、48、72 h细胞运动情况,记录从迁移起点至迁移最远点细胞核间距,每个视野选10个观测点。
1.4 统计学处理
应用SPSS 17.0统计软件,计数资料用百分比表示,组间比较采用方差分析,数据以表示,P<0.05为差异有统计学意义。
2 结 果
2.1 PAX6在NSCLC肿瘤组织、细胞系中表达结果
PAX6基因与管家基因扩增产物特异,无引物二聚体或其他非特异性产物,根据2-ΔΔCt方法进行计算得出,PAX6基因在NSCLC肿瘤组织、癌旁配对组织及A549细胞系相对表达量分别为(2.927±0.923)、(0.513±0.172)和(1.024±0.264),16HBE细胞系中未见表达(图1)。对比癌旁正常组织,NSCLC肿瘤组织中PAX6表达水平显著上升(P<0.05)。
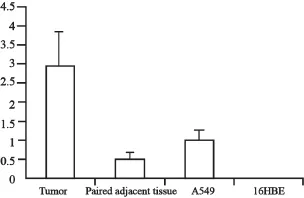
图1 PAX6基因在癌组织、癌旁正常组织及细胞系中表达情况Fig. 1 PAX6 gene expression in tumor and paired adjacent tissue and A549 16HBE cell
2.2 RNA干扰对A549细胞PAX6表达水平影响
Western blot检测结果表明,转染PAX6特异性siRNA组,PAX6表达水平显著低于NS-siRNA组和空白对照组,组间比较差异有统计学意义(P<0.05,图2)。
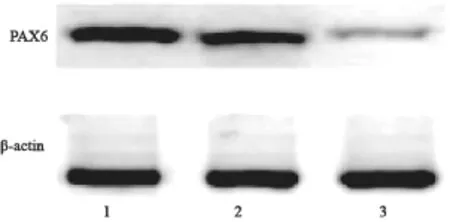
图2 PAX6-siRNA特异性siRNA显著下调A549细胞PAX6蛋白水平Fig. 2 PAX6 expression was suppressed by PAX6-siRNA in A549 cell
2.3 MAPK信号通路蛋白p38及其磷酸化水平
PAX6基因敲除细胞培养72 h,提取蛋白经Western blot检测p38蛋白及磷酸化水平,结果显示,PAX6基因敲除的A549细胞,p38蛋白磷酸化水平下降,差异有统计学意义(P<0.05,图3)。

图3 PAX6表达下调细胞p38蛋白表达及磷酸化水平Fig. 3 p38 expression and phosphorylation was inhibited when PAX6 expression was suppressed
2.4 细胞周期蛋白cyclin E表达水平检测
Western blot检测PAX6敲除肿瘤细胞cyclin E表达情况,结果显示,PAX6敲除的A549细胞,cyclin E蛋白表达水平下降,差异有统计学意义(P<0.05,图4)。

图4 PAX6表达下调细胞cyclin E蛋白表达水平Fig. 4 Cyclin E expression was inhibited while PAX6 expression was suppressed
2.5 转染对肿瘤细胞增殖、侵袭、迁移力的影响
转染后肿瘤细胞增殖明显减缓,细胞换液时间由原来的3 d推迟到6 d左右,PAX6-siRNA组生长明显较空白对照及NS-siRNA组滞后(图5)。侵袭力对比,空白对照组和NS-siRNA组穿膜能力较强,穿膜细胞数分别为(51±6)和(49±5)次,转染后穿膜细胞数减低为(21±3),显著降低(P<0.05)。划痕实验结果提示,PAX6-siRNA组培养24 h后,划痕缩小趋势不明显,48 h略缩小,但并无融合趋势,72 h后,划痕缩小,空白对照组和NS-siRNA组培养24 h,划痕开始缩小,48 h明显缩小,72 h划痕已有融合趋势,结果表明,转染后细胞的迁移力出现下降。划痕宽度对比见表2。

图5 转染后细胞生长曲线图Fig. 5 Knockdown of PAX6 suppressed lung cancer cell growth
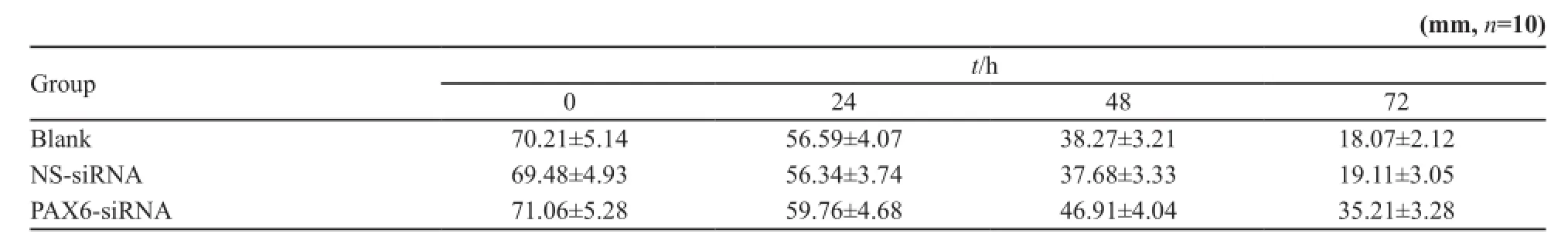
表2 转染后各组细胞不同时刻划痕宽度Tab. 2 Scratch width of 3 groups cells after transfection at 0, 24, 48 and 72 h
3 讨 论
肺癌是世界范围内发病率和死亡率居高不下的恶性肿瘤之一,其预后较差,复发和转移发生率也较高[3]。随着诊断技术的进步,肺癌也是确诊率最高的肿瘤之一,但尽管如此,肺癌的治疗效果仍不理想,基于此,新的肿瘤分子靶点成为当前恶性肿瘤基础与临床研究的新策略。
PAX6基因定位于人类染色体11p13,编码成对盒基因6,产物蛋白包含保守的成对盒状结构域,其结构域能结合DNA,具有调控基因转录的功能。PAX6基因在神经系统及眼的发育过程中表达[4-5]。近来发现在视网膜母细胞瘤、胰腺癌等肿瘤及乳腺癌细胞系中发现PAX6呈高表达。肺癌中,有研究者发现PAX8和PAX5分别在NSCLC和SCLC中呈现高表达[6],但却未见PAX6相关研究的报道。PAX6在不同肿瘤中通过作用于不同信号通路发挥截然不同的作用,在视网膜母细胞瘤和胰腺癌中发挥癌基因的作用,但在前列腺癌和胶质母细胞瘤中却发挥肿瘤抑制作用[7-8]。
丝裂原激活的蛋白激酶(mitogen activated protein kinase,MAPK)信号通路具有调控细胞有丝分裂和G1/S转换的功能,MAPK信号通路中的p38蛋白通过磷酸化激活,发挥细胞有丝分裂调控作用。细胞分裂过程中,细胞周期蛋白同样发挥着重要的作用,这其中cyclin E的作用尤为关键。
本研究首先通过定量逆转录PCR的方法检测NSCLC肿瘤组织、癌旁正常组织及A549、16HBE细胞系中PAX6基因表达情况,结果显示NSCLC肿瘤组织和A549细胞系中PAX6基因表达上调,16HBE细胞系中未见表达。研究结果与视网膜母细胞瘤、胰腺癌中结果一致[1,4]。为进一步研究PAX6对肿瘤细胞增殖、侵袭和迁移能力的影响,本研究应用特异性的PAX6-siRNA转染A549细胞系。RNAi是一种反向遗传学技术,具有操作简单、高效等特点,已逐渐成为基因功能研究的有效手段,本研究采用RNAi技术成功下调PAX6在NSCLC细胞系A549中的表达。
通过RNAi下调PAX6表达的肿瘤细胞,增殖力、侵袭力和迁移能力均表现出明显下降,差异具统计学意义。转染后的细胞中,细胞周期蛋白cyclin E表达水平下调,MAPK信号通路p38蛋白的磷酸化水平出现明显下降。Cyclin E及p38表达及磷酸化水平的改变导致了细胞增殖的滞后,有丝分裂停止在G1期。PAX6对细胞周期的影响与其他研究者在视网膜母细胞瘤中结果一致[9]。
肿瘤侵袭过程极为复杂,涉及基质黏附、基质成分蛋白水解以及肿瘤细胞迁移等步骤,基质金属蛋白酶(matrix metalloproteinases,MMPs)与肿瘤侵袭转移关系最为密切,之前Mayes等[10]发现胶质母细胞瘤中PAX6可通过抑制MMP2的表达达到抑制肿瘤细胞侵袭的作用,PAX6的下调降低NSCLC肿瘤细胞侵袭力的具体机制有待进一步的揭示,MMPs可能参与了此过程。
综上所述,PAX6基因的高表达与NSCLC有着密切的关系,其作用机制涉及激活细胞周期蛋白及MAPK信号通路,调控肿瘤细胞的无限增殖,PAX6基因可作为NSCLC发生、发展的潜在靶点,为NSCLC的诊疗提供新的方向。
[1] LANG D, MASCARENHAS J B, POWELL S K, et al. PAX6 is expressed in pancreatic adenocarcinoma and is downregulated during induction of terminal differentiation[J]. Mol Carcinog, 2008, 47(2): 148–156.
[2] BERKHOUT M, NAGTEGAAL I D, CORNELISSEN S J, et al. Chromosomal and methylation alterations in sporadic and familial adenomatous polyposis-related duodenal carcinomas[J]. Mod Pathol, 2007, 20(12): 1253-1262.
[3] 陈万青, 张思维, 邹小农. 中国肺癌发病死亡的估计和流行趋势研究[J]. 中国肺癌杂志, 2010, 13(5): 488-493.
[4] OSUMI N, SHINOHARA H, NUMAYAMA-TSURUTA K, et al. Concise review: Pax6 transcription factor contributes to both embryonic and adult neurogenesis as a multifunctional regulator[J]. Stem Cell, 2008, 26(7): 1663-1672.
[5] YOSHIZAKI K, OSUMI N. Molecular mechanism and mental function of postnatal neurogenesis[J]. Brain Nerve, 2010,62(12): 1315-1322.
[6] KANTETI R, NALLASURA V, LOGANATHAN S, et al. PAX5 is expressed in small-cell lung cancer and positively regulates c-Met transcription[J]. Lab Invest, 2009, 89(3): 301-314.
[7] ZHOU Y H, HU Y, MAYES D, et al. PAX6 suppression of glioma angiogenesis and the expression of vascular endothelial growth factor A[J]. J Neurooncol, 2010, 96(2): 191-200.
[8] SHYEAR C R, TSAI M Y, YEH S, et al. Tumorsuppressor PAX6 functions as androgen receptor co-repressor to inhibit prostate cancer growth[J]. Prostate, 2010, 70(2): 190-199.
[9] LI L, LI B, ZHANG H, et al. Lentiviral vector-mediated PAX6 overexpression promotes growth and inhibits apoptosis of human retinoblastoma cells[J]. Invest Ophthalmol Vis Sci, 2011, 52: 8393–8400.
[10] MAYES D A, HU Y, TENG Y, et al. PAX6 suppresses the invasiveness of glioblastoma cells and the expression of the matrix metalloproteinase-2 gene[J]. Cancer Res, 2006, 66(20): 9809-9817.
Expression and interaction mechanism of PAX6 in human non-small cell lung cancer
XIONG Anzhou, CHEN Jing, CAO Yan, HU Xiao-ping
(Department of Respiratory, First Hospital of Wuhan, Wuhan Hubei 430022, China)
CHEN Jing E-mail: 1803876732@qq.com
Background and purpose: The transcription factor PAX6 is primarily expressed in embryos. PAX6 is also expressed in several tumors and plays oncogenic or tumor suppressor role. This study aimed to investigate the expression of PAX 6 in non-small cell lung cancer (NSCLC) tumor samples and cell lines; and evaluate the effects of PAX6 on the proliferation and invasion of tumor cells and the expression level of cyclin E and p38. Methods: Western blot was carried out to detect the PAX6 protein level in 86 NSCLC tumor tissues, paired adjacent normal tissues and 2 cell lines. PAX6 siRNA was transfected into human lung cancer A549 cell line. Anchorage-independent growth and invasiveness of tumor cells were measured by MTT and transwell cell invasion assay, respectively. Cyclin E and p38 protein level before and after transfection were detected by western blot. Results: Comparison with tumor adjacent tissues and normal human bronchial epithelial cells 16HBE, PAX6 in NSCLC tissues and A549 cell lines was signi ficantly higher expression. After transfection with ef ficient sequence of PAX6 siRNA for A549 cell lines, the down expression of PAX6 inhibits tumor cell proliferation, the proportion of cells in G1phase increased, the cell invasion and migration decreased remarkably. Cyclin E and p38 activity was inhibited in PAX6 knockdown cells. Conclusion: PAX6 accelerate cell cycle progression by activating cyclin E and p38. PAX6 is a potential target for diagnosis and therapy.
Non-small cell lung cancer; PAX6; siRNA; p38; Cyclin E
10.3969/j.issn.1007-3969.2014.08.008
R734.2
A
1007-3639(2014)08-0604-06
2014-02-05
2014-06-20)
武汉市卫计委科研课题(No:WX14B03)。
陈菁 E-mail:1803876732@qq.com

