培美曲塞与最佳营养支持治疗晚期非小细胞肺癌的疗效比较
潍坊市肿瘤医院肿瘤内科,山东 潍坊 261000
培美曲塞与最佳营养支持治疗晚期非小细胞肺癌的疗效比较
陈淑霞 杨翰潮 陈洪大
潍坊市肿瘤医院肿瘤内科,山东 潍坊 261000
背景与目的:肺癌是目前发病率最高的恶性肿瘤之一,肺癌中以非小细胞肺癌(non-small cell lung cancer,NSCLC)为主,化疗在晚期NSCLC中占主要地位,但对于老年晚期NSCLC的化疗目前存在争议。本研究旨在比较培美曲塞与最佳营养支持治疗在ECOG=2分且年龄≥70岁晚期NSCLC患者的临床疗效,并探讨培美曲塞的不良反应。方法:以84例ECOG=2分且年龄≥70岁的晚期NSCLC患者为研究对象,随机分为培美曲塞组(治疗组)和最佳营养支持治疗组(对照组)(n=42)。治疗组采用培美曲塞二钠,500 mg/m2,第1天,静脉滴注,3周为1个周期。对照组每天保证200 g葡萄糖供应,蛋白质根据患者体质量供给。近期疗效治疗组2个周期后评价,对照组2个月后评价。结果:治疗组完全缓解(CR) 0例,部分缓解(PR) 6例(14.3%),病情稳定(SD) 21例(50.0%),病情进展(PD)13例(30.9%),客观有效率14.3%,疾病控制率64.3%。对照组CR 0例,PR 1例(2.4%),SD 15例(35.7%),PD 25例(60.9%),1例死亡,客观有效率为2.4%,疾病控制率为39.0%(P<0.05)。结论:培美曲塞在ECOG=2分且年龄≥70岁晚期NSCLC患者的疗效优于最佳营养支持治疗,并且不良反应轻,患者可以耐受。
培美曲塞;营养支持治疗;非小细胞肺癌
肺癌是目前发病率最高的恶性肿瘤之一,肺癌中非小细胞肺癌(non-small cell lung cancer,NSCLC)约占80%[1],死亡率在所有肿瘤中居首位。大部分NSCLC患者在确诊时已属中晚期,化疗是晚期NSCLC的常见治疗方法,但对于体质稍差的老年晚期NSCLC患者的全身化疗目前存在争议。本研究旨在比较培美曲塞与最佳营养支持治疗ECOG=2分且年龄≥70岁晚期NSCLC患者的疗效。
1 资料与方法
1.1 一般资料
选择本院2012年1月—2013年6月接受治疗的晚期NSCLC患者84例,均经病理学或细胞学证实,并且有客观可测量或可评价病灶。按照WHO恶性肿瘤一般体力状况评分(ECOG)标准,患者均为ECOG=2分且年龄≥70岁,其中男性53例,女性31例。年龄70~81岁,平均75.5岁,71例为腺癌,8例为腺鳞癌,5例为肺泡细胞癌。随机分为培美曲塞组(治疗组,n=42)和最佳营养支持组(对照组,n=42)。其中治疗组2例,对照组0例。所有患者入组前均签署治疗知情同意书。
1.2 治疗方法
治疗组42例患者化疗前行血常规、肝肾功能及心电图等检查,证实无化疗禁忌后。采用培美曲塞二钠500 mg/m2,第1天,静脉滴注,21 d重复,化疗前1周内予以维生素B121 000 μg肌肉注射,3个周期注射1次,化疗前5~7 d开始叶酸治疗,善存片每日1片,化疗前1天口服地塞米松4 mg,每天2次,共3 d。对照组每天保证200 g葡萄糖供应,脂肪乳1.0 g/kg.d,氨基酸1.2/kg.d,蛋白质1.0 g/kg.d,并补充电解质、维生素和微量元素,并每周检测血生化及电解质,根据病情需要及时调整。
1.3 疗效及不良反应评估
根据RECIST 1.1标准评价近期疗效[2],分为完全缓解(CR),部分缓解(PR),病情稳定(SD),病情进展(PD),客观有效率:CR+PR,疾病控制率:CR+PR+SD。不良反应评价参照抗癌药物不良反应的规定标准[3]。连续用药2个周期或以上评价疗效,如果病情缓解应于4个周期后进行疗效确认。
1.4 统计学处理
采用SPSS 15.0数据包进行数据检验和处理,2组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 治疗效果
治疗组42例患者均完成2个周期化疗,2个周期后予以近期疗效评价,CR 0例,PR 6例(14.3%),SD 21例(50.0%),PD 13例(30.9%),客观有效率为14.3%,疾病控制率为64.3%。对照组2个月后予以近期疗效评价,CR 0例,PR 1例(2.4%),SD 15例(35.7%),PD 25例(60.9%),1例因死亡出组,客观有效率为2.4%,疾病控制率为39.0%。经χ2检验两组培美曲塞组对比最佳营养支持治疗在疗效上差异有统计学意义(P<0.05,表1)。
2.2 不良反应
治疗组不良反应主要为1~2度骨髓抑制和胃肠道反应,经过对症处理后恢复,未发生严重骨髓抑制和胃肠道反应及肝肾功能损伤,患者均能耐受(表2)。
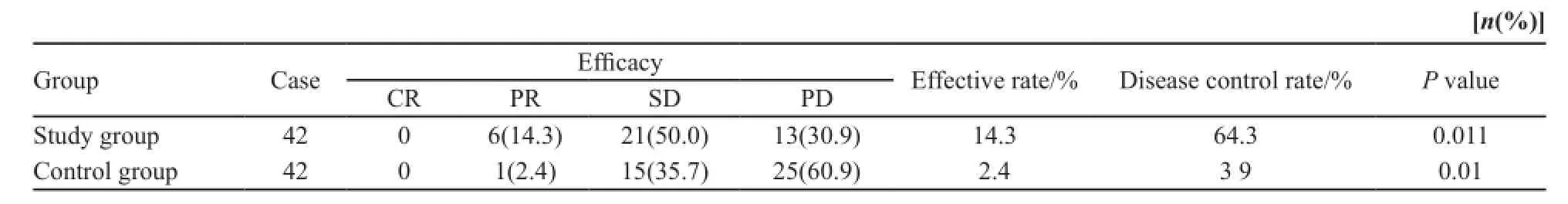
表1 两组患者近期疗效比较Tab. 1 Comparison of the recent effective between the patients of the two groups

表2 治疗组不良反应Tab. 2 Adverse effects in the study group
3 讨 论
近年来,随着人们生活水平不断提高,以及生活环境、生活习惯的改变,肿瘤的发病率在逐年上升,重视肿瘤患者生活质量的治疗成为当代肿瘤学的重要领域。化疗在肿瘤的治疗过程中占有重要的地位,尤其在晚期NSCLC的治疗中,化疗是最为常见有效的治疗方式之一,目前以铂类联合第三代化疗药物(紫衫醇、吉西他滨、多西他赛、长春瑞滨、伊立替康)的方案被认为是晚期NSCLC的一线标准治疗。但是对于体力状况差的晚期老年肺癌患者,化疗耐受性差,生活质量是很多患者考虑的重要因素,很多人对化疗产生恐惧感,这样营养支持治疗成为癌症晚期老年患者选择的治疗方式之一。
营养支持治疗是20世纪产生于外科学中的一类经典治疗方式[4-5]。由于肿瘤本身以及抗肿瘤治疗的影响,肿瘤患者更容易发生营养不良。肿瘤患者的营养支持治疗在整个治疗过程中地位得到肿瘤专家的重视。肿瘤本身就是一个慢性消耗性疾病,加上肿瘤患者由于多程化疗后体内蛋白水平降低,药物的药动学在体内发生改变,导致药物不良反应增加,老年患者器官功能减退,机体耐受性减低,患者容易发生水电解质紊乱,最终无法耐受或拒绝化疗[6],而选择营养支持治疗。但营养支持治疗不同于手术、放化疗及靶向药物治疗,它不能直接杀死肿瘤细胞,对于老年晚期并且体质稍差的肺癌患者是采用化疗还是最佳营养支持治疗是很多医师和家属一直在思索的问题。对于晚期NSCLC患者化疗的目的是提高生活质量,延长生存时间。因此,合理选择一种有效,并且不良反应较轻的化疗药物是治疗的关键。
培美曲塞作为一种多靶点的叶酸拮抗药,主要通过抑制细胞复制过程中叶酸的代谢发挥抗肿瘤作用。正是这种多靶点性,使得培美曲塞在临床应用中显示出确切的疗效和广谱的抗瘤性[7]。经过药理实验证明,培美曲塞可以抑制胸苷酸合成酶、二氢叶酸还原酶及甘氨酰胺核苷甲酰基转移酶,并能够减少嘌呤及胸腺嘧啶核苷的生物合成,从而影响肿瘤细胞的DNA及RNA的合成,使肿瘤细胞增殖停滞在S期,抑制肿瘤生长。培美曲塞主要不良反应为骨髓抑制和胃肠道反应及转氨酶升高,在化疗过程中应用叶酸和维生素B12可以明显减少这些不良反应的发生。Hanna等[8]进行的临床研究证明,培美曲塞对于肺癌患者的疗效与经典二线治疗药物多西他赛相似,但是不良反应明显小于后者,易被患者耐受。这就提示培美曲塞应用于老年患者的可行性,尤其是ECOG=2分的老年患者。在2008年的一项JMDB研究中,Scaglitti等[9]、Syrigos等[10]和Ciuleanu等[11]的研究结果显示,肺癌患者总生存期及预后与病理类型有关。目前培美曲塞联合铂类的化疗方案一线应用晚期NSCLC仍存在争议,我国卫生部颁发的肺癌诊疗规范中未把培美曲塞纳入一线治疗用药。Scaglitti等[12]研究报道了PP方案和GP方案用于一线治疗晚期NSCLC的疗效,结果显示,PP方案显著延长了非鳞癌患者的点生存期,基于该项研究,培美曲塞被用于晚期非鳞癌患者的一线治疗方案。回顾性分析亦提示肺癌中非鳞癌患者更能从培美曲塞治疗中获益。有临床研究显示,单药注射用培美曲塞二钠用于初治NSCLC有效率在20%左右[13]。在本研究中发现培美曲塞用于ECOG=2分且年龄≥70岁晚期NSCLC患者客观有效率14.3%,疾病控制率64.3%,与国内外报道相似。
综上所述,培美曲塞治疗ECOG=2分且年龄≥70岁的晚期NSCLC患者的疗效优于最佳营养支持治疗,且不良反应小,患者能够耐受,可以作为体质稍差的老年晚期NSCLC患者的治疗方案。
[1] 范江, 姜格宁. 非小细胞肺癌治疗进展[J]. 中华临床医师杂志(电子版), 2010, 2(1): 11-14.
[2] EISENHAUER E A, THERASSEB P, BOGAERTSC J, et al. New respongse evaluation criteria in solid tumours: revised RECIST guideline( version 1. 1) [J]. Eur J Cancer, 2009, 45(2): 228-247.
[3] 董益忠, 张亚平, 毕延智, 等. 培美曲塞单药治疗复治晚期肺腺癌45 例临床观察[J]. 当代医学, 2012. 18(31): 39-41.
[4] 吴坚文, 李丹, 曾波航, 等. 高龄对老年性晚期非小细胞肺癌化疗效果的影响[J]. 广东医学, 2011, 32(17): 2282-2284.
[5] 吕鲁闽. 脂肪乳氨酸(17)葡萄糖(11%)注射液对癌症患者生活质量改善的疗效观察[J]. 广东医学, 2011, 32(16): 2094-2096.
[6] 刘东军, 卢秋平. 肠内营养支持在肺癌化疗患者中的临床应用[J]. 中国药物与临床, 2010, 10(8): 954-955.
[7] AL-SALEH K, QUINTON C, LLLIS P M. Role of pemetrexed in advanced non-small-cell lung cancer: meta-analysis of randomized con-trolled trials, with histology subgroup analysis[J]. Curr Oncol, 2012,19(1): 9-15.
[8] HANNA N, SHEPHERD F A, FOSSELLA F V, et al. Randomized phase Ⅲ trial of pemetrexed versus docetaxel in patients with non-small-cell lung cancer preⅥously treated with chemotherapy [J]. J Clin Oncol, 2004, 22 (9): 1589-1597.
[9] SCAGLIOTTI G, HANNA N, FOSSELLA F, et al. The differential efficacy of Pemetrexed according to NSCLC histology: a review of two phase Ⅲ studies [J]. Oncologist, 2009, 14(3): 253-263.
[10] SYRIGOS K N, VANSTEENKISTE J, PARIKH P, et al. Prognostic and pre-dictive factors in a randomized phaseⅢ trial comparing cisplatin- pemtrexed versus cisplatingemcitabine in advanced non-small-cell lung cancer [J]. Ann Oncol, 2010, 21(3): 556-561.
[11] CIULEANU T E, BRODOWICZ T, BELANI C P, et al. Maintenance Pemetrexed plus best supportive care (BSC) versu splacebo plus BSC: a phase Ⅲ study [J]. J Clin Oncol, 2008, 26(Suppl 15): 8011.
[12] SCAGLITTI G V, PARIKH P, VON PAWEL J, et al. PhaseⅢ study comparsing cisplatin plus gemcitabine with cisplatin plus pemetrexed in chemotherapy-naive patients with advanced-stage non-small-cell lung cancer [J]. J Clin Oncol, 2008, 26(21): 3543-3551.
[13] ESTEBAN E, CASILLAS M, CASSINELLO A. Pemetrexed in first-line treatment of non-small cell lung cancer [J]. Cancer Treat Rev, 2009, 35(4): 364-373.
Clinical observation of pemetrexed contrast to the best supportive care in the patients with advanced non-small cell lung cancer
CHEN Shu-xia, YANG Han-chao, CHEN Hong-da
(Department of Oncology,
Weifang Tumor Hospital, Weifang Shandong 261000, China)
YANG Han-chao E-mail: tidessss@sohu.com
Background and purpose: Lung cancer is the one with the highest incidence tumors, is mainly appeared to be non-small cell lung cancer(NSCLC). The main treatment method is chemotherapy. However, it is controversial whether using chemotherapy in the patients of advanced NSCLC. The present study aimed to observe the ef ficacy and toxicity of pemetrexed contrast to the best supportive care in the NSCLC patients of ECOG=2 and older than 70. Methods: A total number of 84 patients of ECOG=2 and older than 70 with advanced NSCLC were randomly assigned into two groups. The study group accepted pemetrexed, 500 mg/m2, every 3 weeks as a cycle, and the control group was given 200 g glucose supply and protein according to patients’ weight every day. Evaluation of the study group was performed at end of 2 cycles and the control group was evaluated after 2 months. Results: There was no CR patient in 2 groups. In the study group there were 6 patients of PR (14.3%), 21 patients of SD (50%) and 13 patients of PD (30.9%), the effective rate was 14.3%, and the disease control rate was 64.3%. There were 1 patient of PR (2.4%), 15 patients of SD (35.7%), 25 patients of PD (60.9%), 1 patient of death, the effective rate was 2.4% and the disease control rate was 39.0% in the control group (P<0.05). Conclusion: The study group has better treatment effect and adverse reaction in patients of ECOG=2 and older than 70 with advanced non-small-cell lung cancer and the toxicity could be tolerated.
Pemetrexed; Supportive care; Non-small cell lung cancer
10.3969/j.issn.1007-3969.2014.08.00X
R734.2
A
1007-3639(2014)08-0626-04
2014-01-08
2014-06-10)
杨翰潮 E-mail:tidessss@sohu.com

