微小RNA-214在胰腺癌中的表达及临床意义研究
上海交通大学附属第六人民医院普外科,上海 200233
微小RNA-214在胰腺癌中的表达及临床意义研究
朱宏达 马尘超 艾开兴
上海交通大学附属第六人民医院普外科,上海 200233
背景与目的:微小RNAs(microRNAs,miRNA,miR)在多种肿瘤中异常表达,可能与肿瘤的发生、发展、侵袭及转移有关,被认为可能起癌基因或抑癌基因的作用。该研究旨在检测miR-214在胰腺癌组织中的表达情况,并探讨其临床意义。方法:实时定量PCR(real-time PCR,RT-PCR)法检测36例胰腺癌组织与相应癌旁组织中miR-214的表达水平,分析miR-214表达水平与胰腺癌患者临床病理特征及预后的关系。结果:miR-214在69.4%(25/36)的胰腺癌组织中相对高表达,表达水平为3.45(1.73~5.13),癌旁组织中的表达水平为1.52(1.09~2.12),差异有统计学意义(P<0.01),并且在T3、T4期患者中的表达水平显著高于T1、T2期患者(P=0.018)。Kaplan-Meier生存分析显示,miR-214表达水平越高,患者生存期越短(P=0.032)。结论:miR-214在胰腺癌组织中的表达上调与胰腺癌的临床病理特征及患者预后密切相关,miR-214可能成为胰腺癌诊断及预后判断的新的分子标志。
胰腺肿瘤;微小RNAs;预后;miR-214
胰腺癌是目前已知的恶性程度最高的肿瘤之一,其死亡率和发病率之比接近0.99∶1,在美国癌症死亡原因中,胰腺癌居第四位,5年生存率<5%[1]。在中国,胰腺癌发病率及死亡率呈上升趋势,逐渐接近西方国家水平。目前,胰腺癌的治疗仍首选手术切除,但由于早期诊断率低,仅10%~20%的患者在诊断时能够得到根治性切除,且术后生存率仅为20%[2]。近年来,一类在转录后水平调控基因表达的非蛋白编码微小RNAs(microRNAs,miRNA,miR)的研究,给胰腺癌的诊断与治疗带来了新的启示。miRNA是一类长度约22个核苷酸的内源性非编码单链小分子RNA,通过与靶基因mRNA的3’端非翻译区(3’-untranslated region,3’-UTR)的互补序列相配对,降解或抑制mRNA的翻译,导致靶基因的转录后沉默,在细胞的增殖、分化和凋亡中具有重要作用[3]。目前大量研究结果显示miRNA能够通过调节癌基因或抑癌基因的转录后翻译,促进或抑制各种肿瘤的发生。有研究发现,在胰腺癌组织和非癌组织中miRNAs表达谱存在明显差异的[4-6],提示miRNA可能与胰腺癌的发生、侵袭、转移、凋亡、药物抵抗等生物学行为相关,因此其可能在胰腺癌诊断、治疗和预后判断中具有一定的应用价值[7]。本研究旨在检测miR-214在胰腺癌组织中的表达,探讨其与临床病理特征、临床预后之间的关系。
1 材料和方法
1.1 材料
胰腺癌标本36例,取自2009年1月—2010年12月于我院普外科行胰腺癌手术切除的患者,均知情同意,并签署书面知情同意书。其中男性23例,女性13例,年龄40~83岁,中位年龄为61岁。按肿瘤部位(胰头和胰体尾)、肿瘤大小(≤2 cm,>2 cm)、浸润深度(T1、T2及T3、T4)、淋巴结转移、淋巴管浸润、血管浸润、周围神经浸润、TNM分期(Ⅰ~Ⅱ,Ⅲ~Ⅳ)、CA199水平(≤37 ng/mL,>37 ng/mL)进行临床病理资料分析,其中TNM分期依照美国癌症委员会(AJCC)胰腺癌TNM分期(2010)标准进行。每例患者的手术标本均在标本离体后10 min内予锋利刀片迅速切取胰腺癌及相应癌旁组织(距癌组织>3 cm)各5块。所有患者术前均未经化疗、放疗或免疫治疗,术后病理检查均由2位病理医师共同诊断,且病理诊断结果显示均为胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)。组织标本离体后立即放入液氮,后转入-80 ℃冰箱保存备用。TRIzol试剂购自美国Invitrogen公司;实时定量PCR(real-time PCR RTPCR)试剂盒All-in-OneTMmiRNA qRT-PCR检测试剂盒、U6、miR-214引物购自美国复能基因有限公司;无水乙醇、甲醇、异丙醇、氯仿、盐酸均购自国药集团化学试剂有限公司;枪头,EP管,离心管均购自AXYGEN公司。
1.2 方法
1.2.1 总RNA的提取
将收集的胰腺癌及癌旁组织标本从液氮罐中取出,剪切成绿豆大小块状,放入研钵中研磨,随后装入加有1 mL TRIzol的EP管,静置5 min,加氯仿0.2 mL,混匀静置5 min,离心(4 ℃,12 000×g,15 min),吸取上清液,加入0.5 mL异丙醇,静置15 min,离心(4 ℃,12 000×g,15 min),可见RNA沉淀, 弃上清液, 加750 mL/L乙醇1 mL混匀,离心(4 ℃,7 500×g,5 min),弃上清液,加入RNase free water溶解RNA沉淀。1%琼脂糖凝胶电泳检测RNA质量、紫外分光光度计检测RNA浓度及纯度。
1.2.2 RT-PCR检测miR-214的表达
取总RNA 2 μg进行逆转录反应,反应条件:16 ℃,30 min,42 ℃,30 min,85 ℃,10 min。取2 μL逆转录产物cDNA进行实时定量PCR反应,反应条件:50 ℃预热2 min;95 ℃预变性10 min(95 ℃变性15 s;60 ℃延伸1 min)共40个循环;95 ℃终延伸15 s。以上各步骤中,反应体系以及试剂用量均严格按照说明书进行。RT-PCR结果以Ct值表示,采用2-ΔΔCt比较各样品间miR-214的表达差异[8],ΔCt=待检样品的miR-214 Ct值-该样品的U6 Ct值,ΔΔCt值=肿瘤组织的 ΔCt 值-癌旁组织的ΔCt值。
1.3 统计学处理
非正态数据以中位数(四分位数间距)表示,两组间配对样本采用Wilcoxon检验,独立样本采用Mann-Whitney检验;正态数据以表示,采用配对t检验,计数资料采用χ2检验或Fisher精确检验;利用Kaplan-Meier法绘制生存曲线以及Log-rank检验比较生存率差异。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-214在胰腺癌组织中高表达
RT-PCR技术检测36例胰腺癌组织和癌旁组织中miR-214的表达水平结果见图1。
检测结果显示,miR-214在69.4%(25/36)的胰腺癌组织中相对高表达,表达水平为3.45(1.73~5.13),癌旁组织的表达水平为1.52(1.09~2.12),差异有统计学意义(P<0.01,图1)。
2.2 miR-214的表达与胰腺癌临床病理特征间的关系
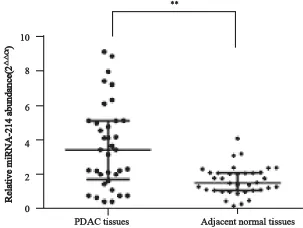
图1 RT-PCR检测miR-214在胰腺癌组织及相应癌旁组织中的表达Fig. 1 RT-PCR was used to detect the miR-214 expressions in PDAC tissues and matched adjacent normal tissues
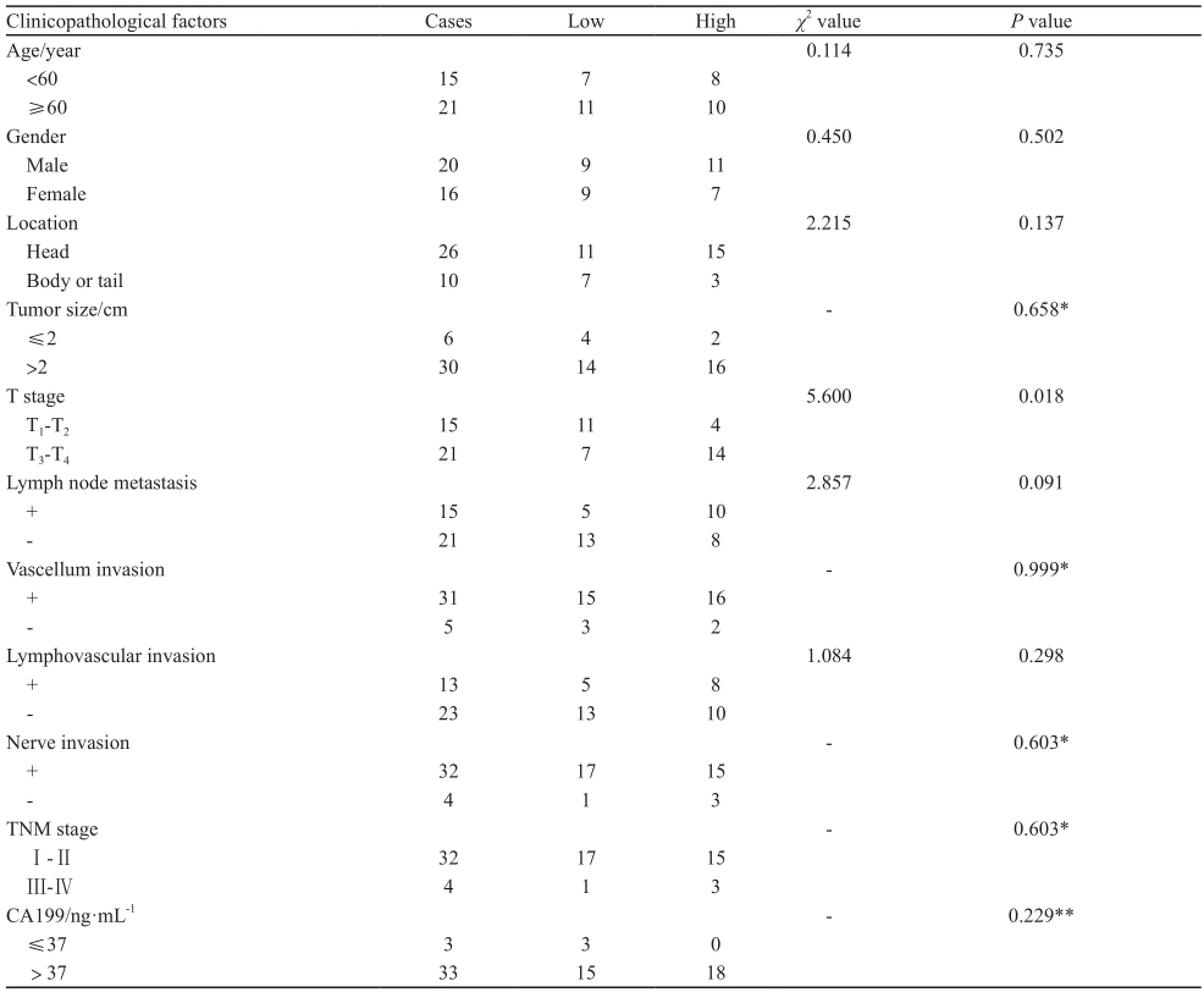
表1 胰腺癌组织中miR-214的表达与临床病理特征间的关系Tab. 1 Correlation between miR-214 expression levels and clinic-pathological features in PDAC#
以胰腺癌组织中miR-214表达量的中位数为分界点将其分为低表达组和高表达组[9],分析两组与临床病理特征间的关系(表1)。结果表明,miR-214的表达水平与胰腺癌T分期密切相关,T3、T4期患者中miR-214高表达率为66.7%(14/21),显著高于T1、T2期患者的26.7%(4/15),差异有统计学意义(P=0.018),而与性别、年龄、肿瘤部位、肿瘤大小、淋巴结转移、淋巴管浸润、血管浸润、周围神经浸润、TNM分期及CA199水平无明显相关性(P>0.05,表1)。
2.3 miR-214表达与预后的关系
以胰腺癌组织中miR-214表达量的中位数为分界点将其分为低表达组和高表达组,利用Kaplan-Meier法绘制生存曲线以及Log-rank检验比较两组之间生存率的差异。结果表明miR-214高表达患者的中位生存期为9.0个月,显著低于miR-214低表达患者的20.0个月,差异有统计学意义(P=0.032,图2)。
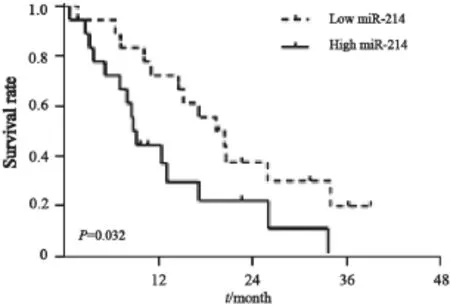
图2 miR-214表达与胰腺癌患者的生存时间的关系Fig. 2 The relationship between the miR-214 expression and survival time of pancreatic cancer patients
3 讨 论
自1993年文献首次报道miRNA以来,对miRNA的研究不断深入。癌基因或抑癌基因的mRNA能够成为miRNA的靶点,因此miRNA的失调会影响基因的表达,从而参与肿瘤的发生、发展过程。大量研究证实miRNA在乳腺癌[10]、肝癌[11]、胃癌[12]、胰腺癌[13]、结直肠癌[14]等多种恶性肿瘤中表达失调。一种miRNA往往可以调控多个靶基因,一个靶基因又可以被多种miRNA所调控,在肿瘤形成过程中,多条信号通路交错形成复杂的信息网络,因此不同肿瘤的miRNA的表达谱往往不同[15]。miRNA表达谱的特异性为肿瘤的筛查、诊断、治疗提供了新的思路[16]。
miR-214位于人1号染色体长臂(1q24.3)的Dnm3基因内,是miRNA家族中的一个重要分子[17]。近年来发现miR-214在肿瘤发生、发展过程中表现尤为活跃,其在多种恶性肿瘤中表达失调,并且与患者的临床病理特征关系密切。但在不同肿瘤中miR-214的表达情况却不尽相同,具有一定的肿瘤特异性。Schwarzenbach等[18]发现在乳腺癌患者血清中miR-214呈低表达,并且与淋巴结转移情况相关。Shih等[19]发现miR-214在肝细胞肝癌患者中低表达,且与患者的复发及预后不良密切相关。Zhou等[20]发现miR-214在食管鳞癌中呈低表达并与食管鳞癌的病理分级、TNM分期及淋巴结转移相关。另一方面,miR-214在某些肿瘤中呈现高表达,通过促进肿瘤细胞的增殖、增强对化疗药物耐药性发挥促癌作用。Zhang等[21]发现miR-214在胰腺癌中高表达,并能降低癌细胞对吉西他滨的敏感性,可能与胰腺癌患者化疗效果差密切相关。Penna等[22]发现miR-214在黑色素瘤中高表达,并可通过调节功能基因TFAP2C、ITGA3及多种细胞表面分子的表达而促进肿瘤细胞的迁徙、侵袭和转移能力。
本研究结果显示胰腺癌组织中miR-214的表达水平较癌旁组织显著增高,提示miR-214的表达上调可能参与了胰腺癌的发生,miR-214在胰腺癌发生中可能起癌基因的作用;胰腺癌组织中miR-214的表达水平与胰腺癌的浸润深度(T分期)具有显著相关性,与性别、年龄、肿瘤部位、肿瘤大小、淋巴结转移、淋巴管浸润、血管浸润、周围神经浸润、TNM分期及CA199水平无明显相关,但在淋巴结转移阳性患者中有高表达倾向,说明miR-214的表达上调可能促进了胰腺癌的进展;胰腺癌组织中miR-214的表达水平与胰腺癌患者的生存期及临床预后呈负相关,即表达水平越高,患者的生存期越短,这与Zhang等[21]报道的结果相似,至于是由于肿瘤本身生物学特性造成的生存期降低还是由于后期的化疗干预造成的,有待进一步研究。这些结果表明miR-214在胰腺癌组织中表达显著升高,并且与胰腺癌的恶性程度及临床预后相关,因此对胰腺癌的诊断及患者临床预后的预测具有一定的指导意义。但是,是否适合作为胰腺癌诊断及预后预测的组织分子标志物尚需进一步深入研究。并且本研究获取的样本量较小,因而确切的结论需要更多的样本进一步观察验证。
综上所述,miR-214在胰腺癌组织中的表达上调与胰腺癌的发生、发展密切相关,miR-214可能成为胰腺癌诊断及预后判断的新的分子标志。
[1] SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics, 2012[J]. CA: a cancer journal for clinicians, 2012, 62(1): 10-29.
[2] SIEGEL R, DESANTIS C, VIRGO K, et al. Cancer treatment and survivorship statistics, 2012[J]. Cancer Clin, 2012, 62(4): 220-241.
[3] LU J, GETZ G, MISKA E A, et al. MicroRNA expression profiles classify human cancers[J]. Nature, 2005, 435(7043): 834-838.
[4] SZAFRANSKA A E, DOLESHAL M, EDMUNDS H S, et al. Analysis of microRNAs in pancreatic fine-needle aspirates can classify benign and malignant tissues[J]. Clin Chem, 2008, 54(10): 1716-1724.
[5] SZAFRANSKA A E, DAVISON T S, JOHN J, et al. MicroRNA expression alterations are linked to tumorigenesis and nonneoplastic processes in pancreatic ductal adenocarcinoma[J]. Oncogene, 2007, 26(30): 4442-4452.
[6] HUMEAU M, TORRISANI J, CORDELIER P. miRNA in clinical practice: pancreatic cancer[J]. Clin Biochem, 2013, 46(10-11): 933-936.
[7] 邢曼琰, 沈赞. MicroRNA和肿瘤转移关系的研究进展[J]. 中国癌症杂志, 2009, 19(10): 793-796.
[8] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402-408.
[9] BLOOMSTON M, FRANKEL W L, PETROCCA F, et al. MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis[J]. JAMA, 2007, 297(17): 1901-1908.
[10] CORCORAN C, RANI S, BRESLIN S, et al. miR-630 targets IGF1R to regulate response to HER-targeting drugs and overall cancer cell progression in HER2 over-expressing breast cancer[J]. Molecular Cancer, 2014, 13(1): 71-81.
[11] JUNG H S, SEO Y R, YANG Y M, et al. Galphagep oncogene inhibits FOXO1 in hepatocellular carcinoma as a consequence of miR-135b and miR-194 dysregulation[J]. Cell Signalling, 2014, 26(7): 1456-1465.
[12] YANG T S, YANG X H, WANG X D, et al. MiR-214 regulate gastric cancer cell proliferation, migration and invasion by targeting PTEN[J]. Cancer Cell Inter, 2013, 13(1): 68-78.
[13] WANG P, CHEN L, ZHANG J, et al. Methylation-mediated silencing of the miR-124 genes facilitates pancreatic cancer progression and metastasis by targeting Rac1[J]. Oncogene, 2014, 33(4): 514-524.
[14] SHANG J, YANG F, WANG Y, et al. MicroRNA-23a antisense enhances 5-fluorouracil chemosensitivity through APAF-1/caspase-9 apoptotic pathway in colorectal cancer cells[J]. J Cell Biochem, 2014, 115(4): 772-784.
[15] GYUGOS M, LENDVAI G, KENESSEY I, et al. microRNA expression might predict prognosis of epithelial hepatoblastoma[J]. Virchows Archiv, 2014, 464(4): 419-427.
[16] PIVA R, SPANDIDOS D A, GAMBARI R. From microRNA functions to microRNA therapeutics: novel targets and novel drugs in breast cancer research and treatment (Review)[J]. Int J Oncol, 2013, 43(4):985-994.
[17] BAR-ELI M. Searching for the 'melano-miRs': miR-214 drives melanoma metastasis[J]. EMBO J, 2011, 30(10): 1880-1881.
[18] SCHWARZENBACH H, MILDE-LANGOSCH K, STEINBACH B, et al. Diagnostic potential of PTEN-targeting miR-214 in the blood of breast cancer patients[J]. Breast Cancer Res, 2012, 134(3): 933-941.
[19] SHIH T C, TIEN Y J, WEN C J, et al. MicroRNA-214 downregulation contributes to tumor angiogenesis by inducing secretion of the hepatoma-derived growth factor in human hepatoma[J]. J Hepatol, 2012, 57(3): 584-591.
[20] ZHOU Y, HONG L. Prediction value of miR-483 and miR-214 in prognosis and multidrug resistance of esophageal squamous cell carcinoma[J]. Genet Test Mol Biomarkers, 2013, 17(6): 470-474.
[21] ZHANG X J, YE H, ZENG C W, et al. Dysregulation of miR-15a and miR-214 in human pancreatic cancer[J]. J Hematol Oncol, 2010, 3: 46.
[22] PENNA E, ORSO F, CIMINO D, et al. microRNA-214 contributes to melanoma tumour progression through suppression of TFAP2C[J]. EMBO J, 2011, 30(10): 1990-2007.
The expression and clinical signi ficance of microRNA-214 in pancreatic cancer
ZHU Hong-da, MA Chen-chao, AI Kai-xing
(Department of General Surgery, Shanghai Jiao Tong University Affiliated 6thPeople’s Hospital, Shanghai 200233, China)
AI Kai-xing E-mail: akxing8258@gmail.com
Background and purpose: Aberrant expressions of microRNAs (miRNA, miR)are reported in various cancers and may associate with cancer occurrence, development, invasion and metastasis, thereby functioning as either tumor suppressors or oncogenes. This study attempted to observe the expression of miR-214 in pancreatic cancer and to explore its clinical signi ficance. Methods: Real-time PCR was used to detect the miR-214 expressions between pancreatic cancer tissues and matched adjacent tissues. The correlations of miR-214 expression with clinicpathological features and clinical prognosis were analyzed. Results: MiR-214 expression was up-regulated in 69.4% (25/36) of tumor tissue specimens. The relative expression level of miR-214 was signi ficantly higher in tumor tissues than in matched adjacent tissues (3.45 vs 1.52, P<0.01). Higher miR-214 level was strongly associated with T3-T4stage (P=0.018). The Kaplan-Meier analysis revealed that patients with higher expression of miR-214 had a shorter survival time (P=0.032). Conclusion: The expression of miR-214 is associated with clinic-pathological features and patient’s clinical prognosis, so it may be used as a potential diagnostic biomarker and a prognostic predictor in patients with pancreatic cancer.
Pancreatic neoplasms; MicroRNAs; Prognosis; MiR-214
10.3969/j.issn.1007-3969.2014.08.006
R735.9
A
1007-3639(2014)08-0594-05
2014-05-16
2014-06-16)
艾开兴 E-mail:akxing8258@gmail.com

