结直肠癌患者血清脂肪酸合成酶水平的检测及其临床意义
上海建工医院外科,上海 200083
结直肠癌患者血清脂肪酸合成酶水平的检测及其临床意义
闾晨涛 韩潞 江勇 韩东兴
上海建工医院外科,上海 200083
背景与目的:脂肪酸合成酶(fatty acid synthase, FAS)是唯一有能力在细胞内合成长链脂肪酸的蛋白。由于肿瘤组织对脂肪酸的需求旺盛,包括结直肠癌在内的多种恶性肿瘤组织中常见FAS过表达。本实验研究结直肠癌患者血清FAS水平与肿瘤病理特征的关系。方法:选择2013年3月—2014年3月接受根治性手术治疗的60例结直肠癌患者为研究组,另选20名健康志愿者为对照组。采用酶联免疫吸附法(enzymelinked immunosorbent assay,ELISA)检测血清FAS水平,分析结直肠癌患者血清FAS水平与其临床病理特征的关系。结果:研究组FAS平均为20.77±10.56 mg/L,对照组FAS水平为10.33±5.65 mg/L,差异有统计学意义(P<0.05)。研究组Ⅰ~Ⅱ、Ⅲ及Ⅳ期患者FAS水平分别为13.24±11.43、24.20±11.87和35.44± 12.18 mg/L,各组间比较差异均有统计学意义(P<0.05)。研究组高分化、中分化、低分化患者FAS水平分别为16.46±10.58、20.38±11.87和25.84±10.88 mg/L,各组间比较差异无统计学意义(P>0.05)。结论:血清FAS水平可能与结直肠癌的发生、发展有一定关系,可以对其作为评估肿瘤进展情况的标志物的可行性作进一步研究。
脂肪酸合成酶;结直肠癌;血清肿瘤标志物
脂肪酸合成酶(fatty acid synthase,FAS)是唯一有能力在细胞内合成长链脂肪酸的蛋白,人体主要从饮食途径获取的脂肪酸,因此在正常人体组织中FAS不表达或者低表达。由于肿瘤组织对脂肪酸的需求旺盛,包括结直肠癌在内的多种恶性肿瘤常见FAS过表达[1]。曾有文献报道结肠癌组织FAS上调[2]。也有报道FAS表达过高预示着乳腺癌、前列腺癌和卵巢癌的预后不良[3-5]。另外,胰腺癌和胰腺病变患者FAS均有升高[6]。
目前对结直肠癌患者血清FAS水平的研究较少,本实验旨在探寻结直肠癌患者血清FAS水平与肿瘤进展程度的关系。
1 资料和方法
1.1 一般资料
选择2013年2月—2014年4月因结直肠癌在上海建工医院外科接受手术治疗的60例患者,其中男性34例,女性26例;年龄37~84岁,平均(66.2±13.5)岁;BMI为22.4~33.8 kg/m2,平均(27.5±3.8)kg/m2;肿瘤位于右半结肠(盲肠、升结肠、横结肠右侧半)15例,左半结肠(横结肠左侧半、降结肠、乙状结肠、直肠)45例;UICC分期Ⅰ期4例,Ⅱ期24例,Ⅲ期23例,Ⅳ期9例;低分化15例,中分化30例,高分化15例。所有患者无严重内科合并症,如糖尿病、高脂血症、甲状腺疾病或代谢综合征,且均未服用影响脂质代谢的药物。选择同期20例健康志愿者作为对照组,其中男性12例,女性8例,年龄23~82岁,平均(69.1±14.8)岁。2组患者年龄、性别差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 血液样本采集
所有血液样本于术前2~4日清晨空腹采集,37 ℃静置1 h后快速离心分离血清,储存于-80 ℃冰箱备用。
1.2.2 检测方法
采用双抗体夹心酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)法检测血清中FAS水平。FAS ELISA试剂盒购自上海蓝基生物科技有限公司,操作均按试剂盒说明书进行。
1.3 统计学处理
采用SPSS 13.0统计软件进行统计学处理,计量资料采用表示,组间差异分析采用方差分析。FAS水平与肿瘤分期、分化程度的相关性采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 研究组与对照组临床特征的比较
研究组和对照组的临床和组织病理学特点见表1。两组之间性别构成、年龄、BMI的差异均无统计学意义(P>0.05)。
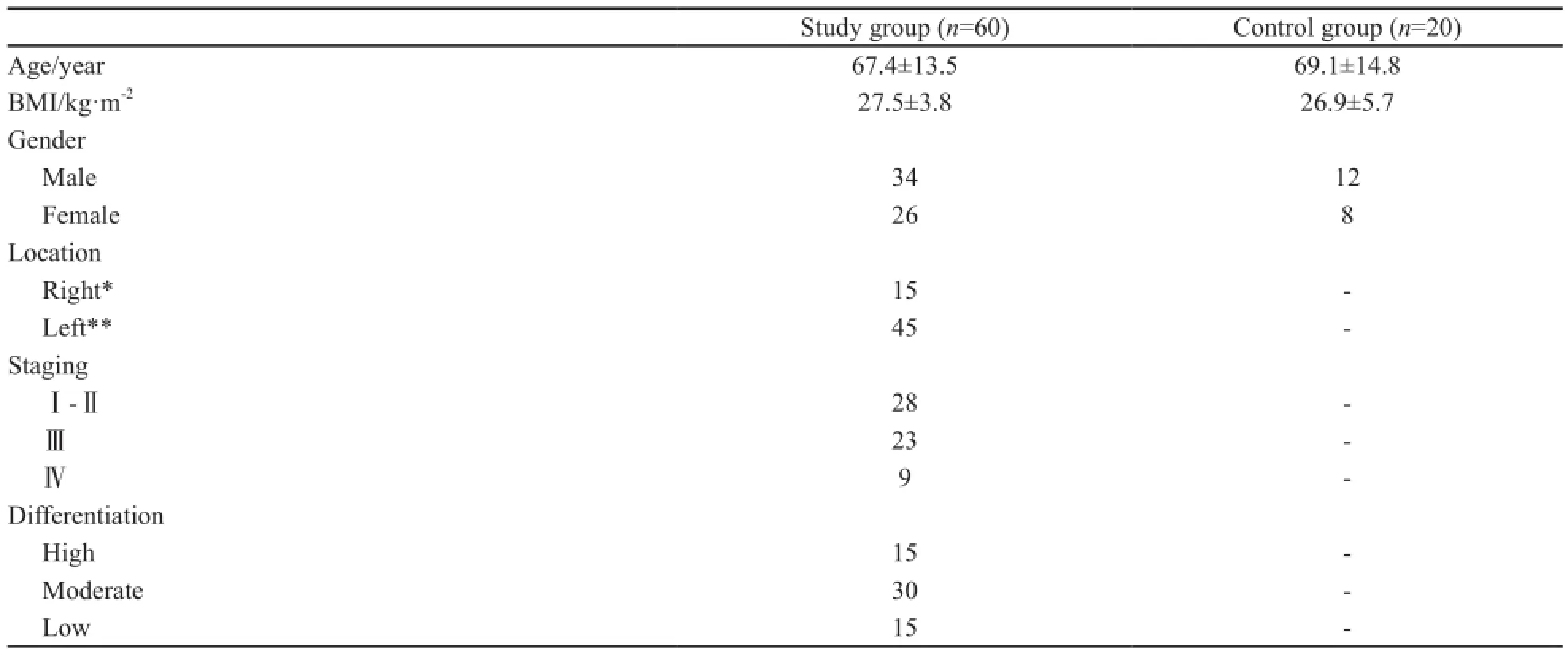
表1 研究组与对照组的临床特点Tab. 1 Clinical pathological characteristics in patients with colorectal cancer
2.2 研究组与对照组血清FAS水平的比较
实验组FAS平均水平为20.77±10.56 mg/L,高于对照组的10.33±5.65 mg/L,差异有统计学意义(P<0.05)。
2.3 不同分期结直肠癌患者FAS水平的比较
实验组内分期Ⅲ、Ⅳ期FAS水平分别为24.20±11.87和35.44±12.18,明显高于Ⅰ~Ⅱ期的13.24±11.43,差异有统计学意义(P=0.003)。另外,随着肿瘤分期进展,FAS水平呈上升趋势(P=0.001)。
2.4 不同分化程度结肠癌患者血清FAS水平的比较
不同肿瘤分化程度亚组之间FAS水平差异有统计学意义(P<0.05),高、中、低分化FAS水平分别为16.46±10.58、20.38±11.87和25.84±10.88 mg/L。肿瘤分化程度越高,FAS水平相对较低,差异无统计学意义(P>0.05)。
3 讨 论
FAS在正常人体组织中含量较低,主要存在于脑、肝、肺组织中,以顺应这些器官在β-氧化或其他代谢途径(如磷酸酯类合成和甘油三酯合成)中对脂肪酸的特别需求。但是在癌组织中由于肿瘤细胞快速增殖需要充分的能量供应和膜脂的生物合成,增生性肿瘤细胞利用长链脂肪酸进行细胞膜合成,或通过多种蛋白的脂质修饰或作为能量来源,以维持肿瘤细胞的生存和生长[7],因此FAS较正常组织明显升高。本实验的结果再次证明了这一点。
FAS对于肿瘤细胞的生长具有很重要的意义,表现为在多种肿瘤组织内均有升高。有文献报道结直肠癌组织中FAS蛋白表达上调,FAS活性增加,表明FAS是一个功能性活化酶,而且整个脂肪酸合成通路活性均有上调[8]。
FAS不仅在肿瘤组织中过表达,在某些恶性肿瘤患者血清中也能检测到FAS水平上升。有一项对22例乳腺癌患者以ELISA方法测定血清FAS的研究证实不同分期的乳腺癌FAS均较正常人有所升高[9]。另有学者指出转移性乳腺癌患者循环FAS升高与HER-2过表达显著相关[10]。有研究报道体外培养的乳腺癌细胞能向细胞外基质分泌免疫活性FAS,重要的是,与健康人相比,乳腺癌患者“细胞外FAS”明显升高[11]。我们的结果与以往针对其他肿瘤的研究结果相一致[3-5,12-13]。可能的机制是,过量的细胞内FAS在肿瘤发展过程中被排出细胞外,这种排出细胞外的程度与肿瘤分期相关。血清FAS与临床分期同步变化,提示血清FAS可以作为评估肿瘤侵袭性的候选标志物,用于跟踪结直肠癌的进展。FAS在肿瘤发生早期阶段即有上升,提示血清FAS具有作为早期发现结直肠癌标志物的潜在可能性。
血清FAS的检测较肿瘤组织FAS的检测简便,尤其适用于肿瘤根治性手术后的患者,可以作为评估术后治疗效果的指标之一。另外已有研究发现,在荷瘤大鼠中应用FAS抑制剂,可以降低转移发生率和减少肿瘤血管生成[14]。这从另一个角度提示我们检测血清FAS的意义,因为检测血清FAS可能是最简便的评价FAS抑制剂效果的指标之一。
本次实验发现血清FAS升高与结直肠癌分期进展有关,为临床上采用FAS作为监测肿瘤进展潜在标志物提供了数据支持,为进一步评估FAS作为肿瘤标志物的可行性建立了基础。虽然其中的生物学意义和FAS在结直肠癌发生、发展中的作用需要进一步的研究,我们仍然可以初步将血清FAS分子定量检测作为评估肿瘤进展的工具之一。
[1] KUHAJDA F P. Fatty acid synthase and cancer: new application of an old pathway[J]. Cancer Res, 2006, 66(5): 5977–5980.
[2] OGINO S, NOSHO K, MEYERHARDT J A, et al. Cohort study of fatty acid synthase expression and patient survival in colon cancer [J]. J Clin Oncol, 2008, 26(35): 5713–5720.
[3] PORTA R, BLANCAFORT A, CASOLIVA G, et al. Fatty acid synthase expression is strongly related to menopause in earlystage breast cancer patients[J]. Menopause, 2014, 21(2): 188-191.
[4] YUKIE Y, TAKAKO F, NOBUYUKI O, et al. Fatty acid synthase is a key target in multiple essential tumor functions of prostate cancer: uptake of radiolabeled acetate as a predictor of the targeted therapy outcome[J]. PLoS ONE, 2013, 8(5): e64570.
[5] GRUNT T W. Targeting fatty acid synthase, ErbB/HER and PI3K in ovarian cancer[J]. Int J Mol Med, 2012, 30(suppl 1): 24.
[6] CHEN M C, ESQUIVEL S, REBER H A, etal. Eicosapentaenoic acid decreases fatty acid synthase through an Akt-dependent pathway in pancreatic cancer cells[J]. Pancrease, 2011, 40(8): 1316.
[7] PALOMERO T, SULIS M L, CORTINA M, et al. Mutational loss of PTEN induces resistance to NOTCH1 inhibition in T-cell leukemia [J]. Nat Med, 2007, 13(10): 1203-1210.
[8] KUCHIBA A, MORIKAWA T, YAMAUCHI M, et al. Body mass index and risk of colorectal cancer according to fatty acid synthase expression in the nurses health study[J]. JNCI, 2012, 104(5): 415-420.
[9] WANG Y, KUHAJDA F P, LI J N, et al. Fatty acid synthase expression in human breast cancer cell culture supernatants and in breast cancer patients [J]. Cancer Lett, 2001, 167(1): 99-104.
[10] VAZQUEZ-MARTIN A, FERNANDEZ-REAL J M, OLIVERAS-FERRAROS C, et al. Fatty acid synthase activity regulates HER2 extracellular domain shedding into the circulation of HER2-positive metastatic breast cancer patients[J]. Int J Oncol, 2009, 35(8): 1369-1376.
[11] WANG Y, KUHAJDA F P, LI J, et al. Fatty acid synthase as a tumor marker: its extracellular expression in human breast cancer [J]. J Exp Ther Oncol, 2004, 4(1): 101-110.
[12] ORITA H, COULTER J, TULLY E, et al. High levels of fatty acid synthase expression in esophageal cancer represent a potential target for therapy[J]. Cancer Biol Ther, 2010, 10(6): 549-554.
[13] SUGINO T, BABA K, HOSHI N, et al. Overexpression of fatty acid synthase in human urinary bladder cancer and combined expression of the synthase and Ki-67 as a predictor of prognosis of cancer patients[J]. Med Mol Morphol, 2011, 44(3): 146-150.
[14] SEGUIN F, CARVALHO M A, BASTOS D C, et al. The fatty acid synthase inhibitor orlistat reduces experimental metastases and angiogenesis in B16-F10 melanomas[J]. Brit J Cancer, 2012, 107(6): 977-987.
Serum levels of fatty acid synthase in colorectal cancer patients and its clinical significance
LV Chen-tao, HAN Lu, JIANG Yong, HAN Dong-xing
(Department of Surgery, Shanghai Jiangong Hospital, Shanghai 200083, China)
HAN Dong-xing E-mail: surgeonhdx@126.com
Background and purpose: Fatty acid synthase (FAS) is the sole protein in the human genome capable of intracellular synthesis of long-chain fatty acids. FAS overexpression is detected in various cancer tissues including colorectal cancer because of the increasing requirement of tumor for long-chain fatty acid. This study was to investigate the association between serum levels of FAS in patients with colorectal cancer and clinicopathological characteristics of colorectal cancer. Methods: A total of 60 patients who underwent radical surgical resection for colorectal cancer from Mar. 2013 to Mar. 2014 were selected as the study group, while 20 healthy volunteers were selected as the control group. The serum levels of FAS were measured by enzyme-linked immunosorbent assay (ELISA) methods. Differences of serum levels of FAS in patients with various clinicopathological characteristics of colorectal cancer were analyzed. Results: The serum levels of FAS in the study group were signi ficantly different with those in the control group. Serum FAS levels of patients belonging to stage Ⅰ-Ⅱ, Ⅲ and Ⅳ were 13.24±11.43, 24.20±11.87 and 35.44±12.18 mg/L, respectively, and were statistically different. Serum FAS levels of patients belonging to high, moderate and low differentiation were 16.46±10.58, 20.38±11.87 and 25.84±10.88 mg/L, respectively, there were also statistically different. Conclusion: FAS may be involved in the development and progression of colon cancer.
Fatty acid synthase; Colorectal cancer; Serum tumor marker
10.3969/j.issn.1007-3969.2014.08.011
R735.3+5
A
1007-3639(2014)08-0622-04
2014-03-13
2014-06-29)
韩东兴 E-mail:surgeonhdx@126.com

