乳腺癌耐药细胞中c-fos抗凋亡作用的研究
彭洪薇 师锐赞 袁向飞 熊冬生 魏筱华
1.南昌大学第一附属医院药学部,江西 南昌 330006;
2.山西医科大学药理学系,山西 太原 030001;
3.中国医学科学院,北京协和医学院实验血液学国家重点实验室,天津 300020
乳腺癌耐药细胞中c-fos抗凋亡作用的研究
彭洪薇1 师锐赞2 袁向飞3 熊冬生3 魏筱华1
1.南昌大学第一附属医院药学部,江西 南昌 330006;
2.山西医科大学药理学系,山西 太原 030001;
3.中国医学科学院,北京协和医学院实验血液学国家重点实验室,天津 300020
背景与目的:乳腺癌是女性最常见的恶性肿瘤之一,且患者死亡率居高不下,其中乳腺癌耐药是导致临床化疗失败的主要原因。该课题组采用已建立的乳腺癌耐药细胞模型MCF-7/ADR及其敏感株MCF-7,旨在探讨c-fos在乳腺癌耐药细胞中的详细作用机制。方法:MTT检测上述细胞对多柔比星的敏感性,并通过实时定量PCR(real-time PCR,RT-PCR)检测上述细胞中mdr-1及c-fos的mRNA表达情况;3 μmol多柔比星分别处理MCF-7细胞12、24、36 h后采用RT-PCR检测细胞中c-fos mRNA的表达,以监测化疗药物处理过程中乳腺癌细胞c-fos的表达变化过程;构建相应载体得到了c-fos稳定干扰细胞株及其对照细胞株:MCF-7/ADR/si-fos-8B、MCF-7/ADR/si-fos-3D和MCF-7/ADR/siNC,采用MTT检测干扰c-fos后对5-FU及顺铂的敏感性变化;流式细胞术检测上述药物及γ射线照射处理后细胞凋亡的情况;罗丹明123检测乳腺癌耐药细胞的外排能力;RT-PCR及蛋白质印迹法(Western blot)分别检测c-fos干扰后,凋亡相关基因bax、bcl-2、puma、p53及mdr-1等的表达。结果:与敏感细胞MCF-7相比,MCF-7/ADR细胞中c-fos及mdr-1的表达显著升高,且对多柔比星的耐药倍数为敏感株的近40倍;在3 μmol多柔比星处理MCF-7之后c-fos的表达逐渐升高,结果显示,c-fos在乳腺癌的耐药表型形成早期即开始发挥作用;干扰c-fos后,细胞对药物(5-FU、顺铂)的敏感性增高,且经药物处理及γ射线照射后稳定干扰细胞株的凋亡率显著升高,说明干扰c-fos后乳腺癌耐药细胞在受到外界刺激后,更易于发生凋亡;RT-PCR及Western blot检测结果显示,干扰c-fos后,bax、puma、p53的表达明显升高,而bcl-2及mdr-1的表达显著降低。结论:在乳腺癌耐药细胞MCF-7/ADR中发现,c-fos呈异常高表达,其可能通过调节乳腺癌细胞凋亡信号通路蛋白的变化抑制乳腺癌细胞的凋亡,促进了乳腺癌耐药表型的形成。由此,c-fos可作为克服乳腺癌耐药治疗的一个潜在靶点用于今后的药物开发。
乳腺癌耐药;c-fos;细胞凋亡
作为AP-1的组成成分之一,c-fos蛋白在肿瘤发生、转化、血管生成、侵袭和转移中发挥了非常重要的作用[1]。Fos蛋白最初是在鼠的骨肉瘤细胞中发现的,有研究表明,表达该蛋白的基因一种原癌基因,在细胞的恶性转化方面发挥了重要作用[2-3]。c-fos蛋白作为Fos的同系物,是最早发现的立即早期基因之一。现在发现的Fos家族的蛋白有4种(c-fos、FosB、Fra-1及Fra-2),这些蛋白和Jun家族(c-Jun、JunB及JunD)的蛋白以同源或异源二聚体的形式结合形成AP-1,调控细胞的生命活动,其中c-fos和c-Jun组成的异源二聚体是最稳定的形式[4]。
近年来的研究表明,c-fos对细胞凋亡信号通路发挥了重要的调控作用。在受到凋亡刺激之后,c-fos一方面可以通过抑制抗凋亡蛋白c-FLIP表达的途径,另一方面可通过调节内源性凋亡途径,从而发挥促进细胞凋亡的作用[4-6]。上述研究均证实了c-fos在细胞凋亡通路中的重要地位。MCF-7及其耐药株MCF-7/ADR是本科室保存的乳腺癌细胞株,在我们的研究工作中发现耐药的乳腺癌细胞株MCF-7/ ADR呈c-fos高表达,本研究针对c-fos在MCF-7/ ADR凋亡调控方面的机制进行了初步的探讨。
1 材料和方法
1.1 细胞培养
人乳腺癌细胞及其耐药细胞株MCF-7、 MCF-7/ADR由本室保存。上述细胞均培养于含10%胎牛血清的RPMI-1640培养基,在37 ℃、CO2体积分数为5%的培养箱中培养,细胞接种24~48 h后进入指数增长期。
1.2 主要实验试剂及仪器
顺铂购自山东齐鲁制药厂;5-FU购自天津金耀氨基酸有限公司;多柔比星购自美国辉瑞制药有限公司;MTT和G418购自美国Sigma公司;Real time PCR(RT-PCR)试剂购自大连Takara公司;BCA蛋白定量试剂盒购自ThermoScientific公司;兔抗人p53抗体、兔抗人bax抗体购自Cell Signaling Technology公司;兔抗人bcl-2抗体购自Epitomics公司;兔抗人puma抗体购自ProSci公司;山羊抗兔HRP-IgG抗体购自北京中杉金桥公司。PCR引物由上海生工生物工程技术服务公司合成。TRIzol及DEPC购自美国Sigma公司。凝胶电泳仪购自上海天能(Tanon)公司。
1.3 MTT法检测细胞生长抑制率
采用常规MTT法测定药物体外抗肿瘤活性[7],取对数生长期的肿瘤细胞,用含有10%小牛血清的RPMI-1640培养液配成1× 105/mL,接种于96孔微培养板(细胞数为6×103个/孔,180 μL/孔),在37 ℃、CO2体积分数为5%的条件下培养24 h,分组加药,每个浓度设3个平行孔,实验组加入对应浓度的药物,阴性对照加入等体积的0.9%Nacl溶液,使每孔的终体积为200 μL/孔。培养68 h后,每孔加入MTT 20 μL (5 mg/mL),37 ℃继续培养4 h,离心(1 000转/min,10 min),弃上清液,每孔加入DMSO 150 μL,振荡至沉淀完全溶解;在酶标仪上检测570 nm光密度(A)值。肿瘤细胞生长抑制率按以下公式计算:抑制率(%)=[A对照组-A加药组]/A对照组×100%。以同一药物的不同浓度对肿瘤细胞生长抑制率作图可得到剂量反应曲线,根据线性回归方程求出该药物的半数杀伤浓度IC50,即细胞存活率减少50%时的药物剂量。
1.4 细胞凋亡实验
胰酶消化MCF-7/ADR、MCF-7/ADR/siNC、MCF-7/ADR/si-fos-8B及MCF-7/ADR/si-fos-3D,10%胎牛血清终止消化后用PBS洗两遍,制成单细胞悬液,调整细胞浓度为1×105/mL,6孔板每孔加2 mL细胞悬液,培养过夜后加入药物处理。根据细胞毒实验所测得的药物IC50值,取不同浓度的5-FU(0、5、10、15和20 μg/mL)及不同浓度的CDDP(0、10、15和25 μmol/L)分别作用MCF-7/ADR/siNC、MCF-7/ADR/si-fos-8B和MCF-7/ADR/si-fos-3D各72、48 h之后,参照Annexin Ⅴ/PI双染凋亡试剂盒操作说明书操作。收集细胞制成单细胞悬液,冰预冷的PBS洗两遍后,用100 μL Binding Buffer将待测细胞的密度调整为5×105~1×106细胞悬液,加入5 μL FITCAnnexin Ⅴ标记液和5 μL PI,轻轻混匀。避光室温染色15 min,再补充400 μL Binding Buffer重悬,流式细胞仪(BD,LSRⅡ)测定各组细胞发生凋亡的百分数。实验重复3次,取平均值。
1.5 RNA提取,cDNA合成和RT-PCR检测
胰酶消化MCF-7/ADR/siNC、MCF-7/ADR/ si-fos-8B和MCF-7/ADR/si-fos-3D,用10%胎牛血清终止消化,随后用PBS洗两遍,调整细胞浓度,收集2×105个细胞沉淀,以TRIzol裂解。cDNA合成根据Invitrogen cDNA合成试剂盒说明操作。根据GenBank数据库提供的基因序列信息,采用Premier 5.0软件设计特异性引物,并经BLASÉ分析,由Invitrogen公司合成,PAGE纯化,本研究所用的引物序列如下:mdr-1顺义链:ATAATGCGACAGGAGATAGG;反义链:TTGCCATTGACTGAAAGAAC;引物bax顺义链:CCAGCTCTGAGCAGATCAT GAAG,反义链:GCAATCATCCTCTGC A G C T C C AT);引物b c l-2顺义链:ACCTGGATCCAGGATAACGGAG,反义链:CCAACAACATGGAAAGCGAATC;引物puma顺义链:GAAGAGCAAATGAGCCAAACG,反义链:GGAGCAACCGGCAAACG;引物c-fos顺义链:AGCGAGCAACTGA GAAGCC,反义链:CGCTGTGAAGCA G A G C T G G;引物G A P D H顺义链:AGTCAACGGATTTGGTCGTA,反义链:GGAACATGTAAACCATGTAG。
1.6 蛋白裂解、SDS-PAGE电泳及蛋白质印迹法(Western blot)检测
分别收集MCF-7/ADR、MCF-7/ADR/siNC、MCF-7/ADR/si-fos-8B、MCF-7/ADR/si-fos-3D细胞1×107个,胰酶消化后,按每100 μL 2×106个RIPA浓度加入含有蛋白酶抑制剂的RIPA中裂解,4 ℃裂解30 min,10 000×g离心20 min,取上清液,BCA法进行总蛋白定量。每组取50 μg蛋白,用10%的SDS-PAGE分离蛋白,然后转印至PVDF膜上。5%脱脂牛奶封闭2 h后,按预染标志物标记的分子量裁剪转印膜,分别加入bax、bcl-2、puma、p53及内参GAPDH等的一抗,4 ℃温育过夜。再以PBS清洗后加入二抗,室温下温育30 min,ECL法显色。Tanon凝胶图像分析系统照相并分析结果。
1.7 统计学处理
2 结 果
2.1 MCF-7/ADR细胞中c-fos表达情况
首先我们通过MTT试验证实MCF-7/ADR对多柔比星的耐药程度升高了近40倍,是稳定的耐药乳腺癌细胞株(表1)。为进一步阐明乳腺癌耐药产生的相关机制,我们利用RT-PCR及Western blot的方法检测了c-fos、mdr-1基因在乳腺癌细胞MCF-7及其耐药株MCF-7/ADR中的表达情况。c-fos及mdr-1在MCF-7/ADR中无论是mRNA还是蛋白质表达水平均明显高于敏感细胞MCF-7。为了进一步探索c-fos表达上调与乳腺癌细胞耐药的关系,我们检测了3 μmol/L多柔比星处理MCF-7细胞之后c-fos的表达变化情况。c-fos的表达在ADR作用12、36 h之后呈逐渐上升的趋势(3 μmol/L的多柔比星作用36 h之后c-fos的mRNA水平升高了8倍),同时其蛋白表达也明显升高(3 μmol/L的多柔比星作用36 h之后升高6倍,图1)。以上结果说明c-fos过表达的现象有可能是在细胞耐药表型的产生过程中逐渐获得的。

表1 多柔比星对MCF-7及MCF-7/ADR的IC50值Tab. 1 Determination of IC50of doxorubicin in MCF-7 and MCF-7/ADR
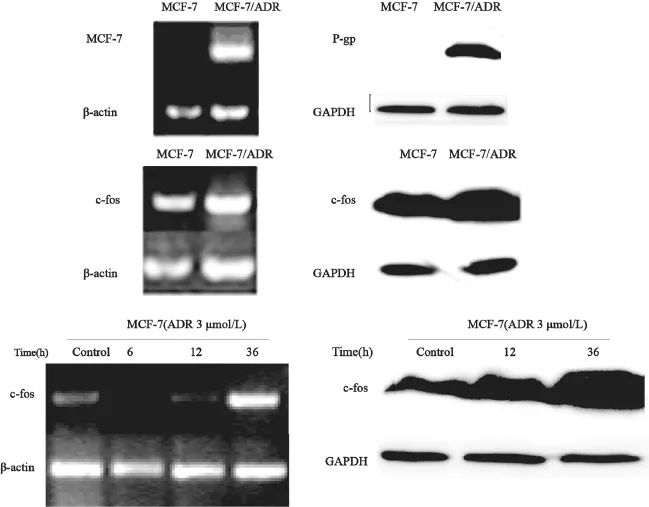
图1 c-fos在MCF-7/ADR及其在乳腺癌耐药表型形成早期中的表达Fig. 1 The expression of c-fos in MCF-7/ADR and in the early stage of formation of MDR-phenotype
2.1 MCF-7/ADR/si-fos-8B及MCF-7/ADR/ si-fos-3D是c-fos稳定干扰的细胞株
本研究发现在MCF-7/ADR细胞中c-fos表达量高于其母代、敏感的MCF-7细胞株,我们在MCF-7/ADR中转染了干扰c-fos的shRNA,得到了稳定干扰c-fos的两株细胞及相应对照细胞,将它们分别命名为MCF-7/ADR/si-fos-8B、MCF-7/ADR/si-fos-3D和MCF-7/ADR/siNC。这些细胞在常规培养中加入终浓度为60 μg/mL的G418以维持它们的稳定干扰状态。其中,c-fos的干扰效果及干扰效率见图2,MCF-7/ADR/sifos-8B的干扰效率高于MCF-7/ADR/si-fos-3D,与MCF-7/ADR/siNC相比干扰效率分别为38.8%和95.7%。
2.2 c-fos干扰后细胞对多柔比星的敏感性改变情况
多柔比星是常用的细胞毒药物,且MCF-7/ ADR对其耐药。MTT检测发现干扰c-fos后,细胞对多柔比星的耐药倍数降低(表2)。
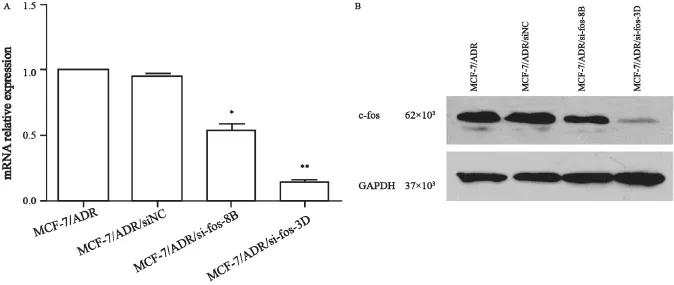
图2 c-fos稳定干扰株的建立Fig. 2 The establishment of c-fos stable interfered cell line
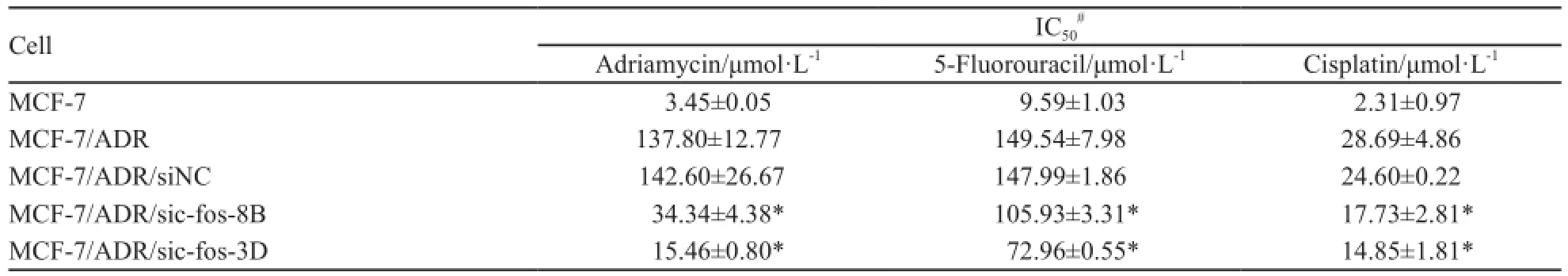
表2 c-fos下调对乳腺癌细胞化疗敏感性的影响Tab. 2 Effects of c-fos down-regulation on the sensitivity to chemotherapeutic agents
2.3 干扰c-fos基因的细胞株对非P-gp底物的细胞毒药物的敏感性增加
为了证实c-fos在耐药细胞株MCF-7/ADR中的作用,本研究选用了两种非P-gp底物的细胞毒药物(5-FU,CDDP)进行实验。细胞毒试验发现,稳定干扰c-fos的细胞株MCF-7/ADR/si-fos-8B、MCF-7/ADR/si-fos-3D与对照MCF-7/ADR/ siNC相比,对5-FU及CDDP的IC50均有所降低(表2)。细胞凋亡实验证实c-fos干扰后,MCF-7/ ADR/si-fos-8B及MCF-7/ADR/si-fos-3D对5-FU、CDDP所诱导的凋亡更敏感(图3)。
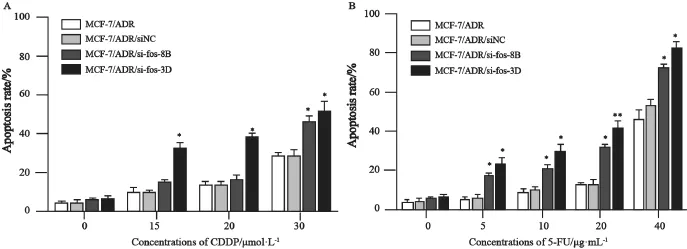
图3 化疗药物CDDP与5-FU诱导MCF-7/ADR及其c-fos稳定干扰细胞凋亡Fig. 3 Cisplatin and 5-FU induced apoptosis in MCF-7/ADR and its c-fos stable interfered cell lines
2.4 干扰c-fos细胞株对铯源照射所致的凋亡敏感性影响
10 Gy的铯源照射之后,细胞48 h后出现明显凋亡,MCF-7/ADR、MCF-7/ADR/siNC、MCF-7/ADR/si-fos-8B和MCF-7/ADR/si-fos-3D的凋亡率分别为12.18±1.56、10.14±2.57、17.42±1.09和23.45±3.83;20 Gy的铯源照射之后上述细胞的凋亡率分别为19.83±2.07、16.87±1.96、22.33±3.97和49.61±3.54(图4)。上述凋亡率统计均来源于3次平行试验。
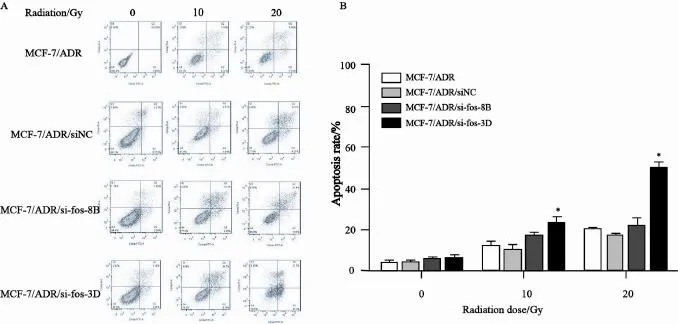
图4 γ-射线照射诱导MCF-7/ADR及其c-fos稳定干扰细胞凋亡Fig. 4 Irradiation by γ-ray induced apoptosis in MCF-7/ADR and its c-fos stable interfered cell line
2.5 c-fos基因下游凋亡相关蛋白的表达变化
为进一步验证c-fos与凋亡的关系,我们首先用RT-PCR检测了凋亡相关基因bcl-2、bax和puma的变化,发现干扰c-fos后,bcl-2 mRNA水平略微下降,bax mRNA和puma mRNA的水平有所升高(图5)。Western blot检测发现,在蛋白水平,bcl-2的表达在干扰后降低,且MCF-7/ ADR/si-fos-8B降低得更明显;bax与puma的表达升高;因p53在细胞中与细胞凋亡相关性很显著,且为bcl-2家族蛋白,故我们也检测了干扰组与对照组p53的表达情况,发现与对照组相比,干扰组的p53表达升高,且MCF-7/ADR/sifos-8B的p53升高更明显(图5)。
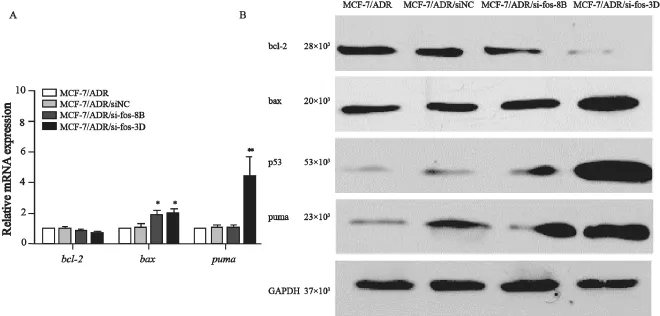
图5 RT-PCR及Western blot检测凋亡相关基因的变化Fig. 5 Analysis of apoptosis-related gene expression by RT-PCR and Western blot
3 讨 论
在乳腺癌中,c-fos的过度表达和预后成反比。c-fos基因敲除可以延长乳腺癌移植瘤小鼠的存活时间,抑制乳腺癌细胞的增生和浸润[8]。本研究结果表明一些会诱导肿瘤多药耐药性产生的药物如多柔比星在应用过程中会引起c-fos表达水平的升高。这提示在多药耐药形成早期,c-fos引起的转录机制的加强促进了肿瘤耐药表型的产生。MCF-7/ADR细胞中c-fos的表达无论在mRNA水平还是蛋白水平均明显高于其亲代敏感细胞MCF-7。而将MCF-7/ADR中的c-fos干扰之后,干扰组对多柔比星的IC50明显降低,且凋亡相关蛋白bax、bcl-2、puma及p53表达发生了明显的变化,细胞呈现更易于凋亡的趋势。以上结果提示c-fos可能与乳腺癌细胞中凋亡的调控有关。
在本研究中,我们利用已建立起的c-fos稳定干扰细胞株进一步研究了c-fos在乳腺癌耐药细胞MCF-7/ADR中对其凋亡通路的调控。因c-fos可能会同时对MCF-7/ADR中耐药蛋白P-gp的表达有调控作用,为了排除P-gp对实验结果的影响,我们选用了两种非P-gp底物的药物,5-FU和CDDP,观察用上述两种药物处理之后细胞生存情况的变化。我们的结果发现,5-FU和CDDP对干扰细胞株MCF-7/ADR/si-fos-3D和MCF-7/ADR/si-fos-8B的生长抑制作用强于对照MCF-7/ADR/siNC,细胞凋亡率也更高。此外,铯源照射发现干扰c-fos后,辐射所致的细胞凋亡增加;RT-PCR和Western blot检测发现,干扰细胞株凋亡通路相关基因p53、puma和bax均出现表达上调,而抗凋亡基因bcl-2下调,细胞表现出对凋亡刺激更加敏感的特征。
人类p53基因定位于染色体l7p13,全长16~20 kb,含有11个外显子与10个内含子。p53基因有野生型和突变型两种,野生型p53是细胞内重要的抑癌基因,其主要生物学功能是经过一系列信号传导作用调控细胞周期和诱导细胞凋亡,维持基因组和细胞稳定,抑制肿瘤生长,p53在细胞周期中起着“分子警察”作用[10]。突变型p53因其突变型的不同甚至可能会对癌症的发生、发展有促进作用。p53有助于保持细胞基因组的稳定,正常情况下,在细胞因外界刺激受到损伤时,即启动细胞周期阻滞或诱导凋亡作用[11]。当DNA受到外界刺激而出现损伤时,p53蛋白通过上调周期相关蛋白p21的蛋白,抑制CDKs/cyclin复合物的形成,导致细胞周期阻滞,为DNA损伤修复机制的进行赢得了更多的时间,也避免了细胞将错误的遗传信息传递到子代细胞。
DNA损伤将激活ATM/ATR激酶,ATM/ ATR蛋白激酶的活化可直接使p53活性增强;DNA损伤还可通过特异性诱导E2F1的表达激活p19ARF,进而使p53积聚诱导凋亡。p53主要通过影响线粒体凋亡途径促进细胞凋亡[12]。当受到外界刺激时,细胞质中的p53易位进入线粒体中,与bcl-2凋亡相关蛋白发生相互作用,puma是p53基因下游重要的效应蛋白,转录水平的p53即可刺激puma的表达,进而puma表达的增加可以促进p53的稳定性及活性的增强。有研究发现,puma的表达量与肿瘤对辐射的敏感性相关[13-14]。本研究结果发现,c-fos干扰后,辐射引起的细胞凋亡增加。
bax是bcl-2家族介导凋亡的主要效应子。p53通过促进bax的释放,bax易位至线粒体外膜,并通过自身多聚化改变线粒体外膜的通透性,最后细胞色素C释放,启动caspase级联信号,导致受损细胞的凋亡[15]。正常生理状况下,bcl-2与bax结合,抑制其诱导的细胞凋亡信号的产生。c-fos干扰后,bax/bcl-2蛋白的相对比例发生变化,更倾向于促进细胞凋亡的发生,说明c-fos确实发挥了抗凋亡的作用。
综上所述,c-fos在乳腺癌耐药细胞株MCF-7/ADR中不仅参与了耐药表型的产生,且还可抵抗放化疗引起的细胞凋亡,可能是治疗乳腺癌的一个新的靶点。
[1] KARIN M L. The Fos family of transcription factors and their role in tumourigenesis[J]. Euro J Cancer, 2005, 41: 2449-2461.
[2] MORITZ D, PETER A, JOCHEN H. The transcription factor Fos: a Janus-type regulator in health and disease[J]. Histo Histopathol, 2009, 24: 1451-1461.
[3] CURRAN T, MACCONNELL W P, VAN STRAATEN F, et al. Structure of the FBJ murine osteosarcoma virus genome: molecular cloing of its associated helper virus and the cellular homolog of the v-fos gene from mouse and human cells[J]. Mol Cell Biol, 1983, 3(5): 914-921.
[4] ANGEL P, KARIN M. The role of Jun, Fos and the AP-1 complex in cell-proliferation and transformation[J]. Biochim Biophys Acta, 1991, 1072: 129-157.
[5] WANG X, ZHANG Y, XIAO G, et al. c-fos enhances the survival of thymocytes during positive selection by upregulating Bcl-2[J]. Cell Res, 2009, 19(3): 340-347.
[6] EITAN S, MICHAEL K. AP-1 in cell proliferation and survival[J]. Oncogene, 2001, 20: 2390-2400.
[7] LIN B, CHEN Z, XU Y, et al. 7-b, a novel amoafid analoge, cause growth inhibition and apoptosis in Raji cells via a ROS-mediated mitochondrial pathway[J]. Leuk Res, 2011, 35(5): 646-656.
[8] KARIN M L. The Fos family of transcription factors and their role in tumorigenesis[J]. Euro J Cancer, 2005, 41(16): 1449-1461.
[9] DEMPKE W, VOIGT W, GROTHEY A, et al. Cisplatin resistance and oncogenes-a review[J]. Anticancer Drugs, 2000, 11: 225-236.
[10] 贾春平. 抑癌基因p53与肿瘤研究的最新进展[J]. 生命科学, 2008, 20(3): 450-453.
[11] 姚逸临. 肿瘤抑制基因p53的研究进展[J]. 广东医学, 2006, 27(8): 1263-1265.
[12] VASEVA A V, MOLL U M. The mitochondrial p53 pathway[J]. Biochim Biophys Acta, 2009, 1787(5): 414-420.
[13] VALENTE L J, GRAY D H, MICHALAK E M, et al. p53 efficiently suppresses tumor development in the complete absence of its cell-cycle inhibitory and proapoptotic effectors p21,Puma, and Noxa[J]. Cell Rep, 2013, 3(5): 1339-1345.
[14] SHAO L, LUO Y, ZHOU D. Hematopoietic stem cell injury induced by ionizing radiation[J]. Antioxid Redox Signal, 2013, 20(9): 1447-1462.
[15] 谢咪雪, 谢彦晖. P53家族成员及相互作用与白血病关系的研究进展[J]. 中国实验血液学杂志, 2013, 21(5): 1331-1335.
The anti-apoptotic effect of c-fos in drug-resistant breast cancer cells
PENG Hong-wei1, SHI Ruizan2, YUAN Xiang-fei3, XIONG Dong-sheng3, WEI Xiao-hua1
(1.Department of Pharmacy, First Af filiated Hospital of Nanchang University, Nanchang Jiangxi 330006, China; 2.Department of Pharmacology, Shanxi Medical University, Taiyuan Shanxi 030001, China; 3.State Key Laboratory of Experimental Hematology, Institute of Hematology & Hospital of Blood Diseases, Chinese Academy of Medical Sciences & Peking Union Medical College, Tianjin 300020, China)
WEI Xiao-hua E-mail: wxh-hello@163.com
Background and purpose: Breast cancer is one of the most common carcinoma among female patients with high mortalities. Drug-resistance is the major reason that leads to chemotherapy failure in clinical practice. MCF-7/ADR is a multi-drug resistant cell line that was established on the basis of breast cancer cell line MCF-7. This research aimed to investigate the anti-apoptotic effect of c-fos in resistant breast cancer cell MCF-7/ADR, and to compare with its sensitive counterpart MCF-7. Methods: Doxorubicin with various concentrations was used to treat MCF-7 as well as its MDR- counterpart MCF-7/ADR. The growth inhibitory rate of MCF-7 and MCF-7/ADR wasdetermined by MTT assay. Additionally, RT-PCR was used to test the expression of P-gp and c-fos mRNA in MCF-7 and MCF-7/ADR; The expression of c-fos mRNA was detected by RT-PCR after 3 μmol doxorubicin treatment; We further established cell lines that stably interfered with c-fos, named MCF-7/ADR/si-fos-8B, MCF-7/ADR/si-fos-3D. Flow cytometry and MTT assay were used to investigate the apoptosis rate and inhibitory rate in these above cells under the treatment of 5-FU, CDDP or γ-radiation. At last, RT-PCR and Western blot analysis were used to detect the expression of bax, bcl-2, puma, p53. Results: The expression of c-fos and P-gp (MDR-1) was up-regulated in MCF-7/ ADR, compared with its sensitive counterpart MCF-7. Additionally, the resistant fold of MCF-7/ADR to doxorubicin was nearly 40; The expression of c-fos was gradually up-regulated after 3 μmol doxorubicin treatment; The sensitivity to drugs (5-FU and CDDP) was increased after c-fos interference while the apoptosis rate was also increased after 5-FU, CDDP and γ-radiation treatment. RT-PCR and Western blot analysis indicated that up-regulation of bax, puma, p53 after c-fos interference while the expression of bcl-2 was down-regulated. Conclusion: c-fos may act as an anti-apoptotic protein in resistant breast cancer cell line MCF-7/ADR by regulating the expression of apoptosis related proteins, and may play a vital role in the formation of multi-drug resistance phenotype.
Resistance breast cancer; c-fos; Apoptosis
10.3969/j.issn.1007-3969.2014.08.004
R737.9
A
1007-3639(2014)08-0581-08
2013-12-28
2014-05-30)
魏筱华 E-mail:wxh-hello@163.com

