表柔比星联合奥沙利铂和短期5-FU持续滴注的EOF5方案一线治疗晚期胃癌的疗效评估
复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
表柔比星联合奥沙利铂和短期5-FU持续滴注的EOF5方案一线治疗晚期胃癌的疗效评估
朱晓东 赵晓莹 彭伟 孙思 曹君 季冬梅 刘欣 王辰辰于慧 李进 印季良
复旦大学附属肿瘤医院肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:晚期胃癌治疗中,ECF(表柔比星、顺铂及5-FU持续滴注21 d)方案系经典一线方案,2004年起我们以奥沙利铂取代顺铂,以低剂量5-FU持续滴注120 h取代标准剂量持续滴注21 d,组成EOF5方案,以期提高疗效及依从性,先后开展了小样本探索性研究及扩大样本的Ⅱ期研究。方法:本研究回顾性分析了该两项Ⅱ期研究结果。患者均接受了表柔比星50 mg/m2,静脉推注,第1天;奥沙利铂130 mg/m2,静脉滴注2 h,第1天;每天5-FU的剂量为375~425 mg/m2,低剂量持续输注5 d共120 h;每3周重复,每6周评价疗效。治疗到进展、不能耐受或患者退出,对于6~8个疗程后稳定以上疗效的患者根据医师推荐及患者的意愿,选择氟尿嘧啶类药物维持治疗或观察。结果:178例晚期胃癌患者纳入本研究,170例可行疗效及不良反应评估,7例(3.9%)完全缓解(complete response,CR),76例(42.7%)部分缓解(partial response,PR),总有效率(overall response rate,ORR,CR+PR)为46.6%,69例(38.8%)疾病稳定(stable disease,SD),18例(10.1%)疾病进展(progressive disease,PD)。中位无进展生存期(progress free survival,PFS)为6.0个月(95%CI:5.2~6.8),中位总生存期(overall survival,OS)为12.6个月(95%CI:8.9~16.3),1、2年生存率分别为50.9%和28.0%。3~4度以上不良反应主要有白细胞及中性粒细胞减少23.0%及38.8%、血红蛋白下降6.5%、血小板下降23.5%、恶心呕吐14.1%、手足麻木1.2%。接受二线治疗的75例患者,二线治疗中位生存时间8.0个月(95%CI:4.8~11.2)。结论:EOF5方案治疗晚期胃癌有效率高,PFS和OS同ECF及其改良方案类似,不良反应可控,是安全有效的晚期胃癌一线治疗方案。
胃癌;联合化疗;表柔比星;奥沙利铂;氟尿嘧啶
尽管近十年来在胃癌的姑息化疗方面有较多的临床研究,也取得了一些成果,但遗憾的是仍未形成一个公认的一线标准化疗方案。目前含铂及氟尿嘧啶的两联及三联方案是较为主流的方案[1]。三联方案中,含蒽环类的ECF(表柔比星、顺铂及5-FU联合)或其改良方案及含紫杉类的DCF(多西他赛、顺铂及5-FU联合)方案均有大样本的Ⅲ期研究证据支持[2-5]。但含多西他赛的方案骨髓抑制很强,老年人尤其明显,在使用上受到较大的限制[5]。近年来,不含蒽环类的两联方案也显示了较好的疗效,并且耐受性更好,一些学者认为两联方案不劣于蒽环类的三联方案,因此推荐两联方案一线治疗[6-7]。但目前缺乏两联方案同蒽环类三联方案的头对头比较,且REAL-2研究、MAGIC研究及REAL-3研究都进一步证实了蒽环类三联方案治疗晚期胃癌的临床效果[4,8-9],因此,断言蒽环类在胃癌中没有地位尚为时过早。
ECF方案引起的肾毒性、较严重的骨髓抑制及氟尿嘧啶的21 d持续静脉滴注使很多患者不能耐受,依从性也较差。为降低该方案的毒性,提高依从性,我们在2004年起即设计了改良ECF方案,即EOF5方案,以奥沙利铂替代顺铂并缩短5-FU持续滴注到120 h[10]。我们的Ⅱ期探索性研究显示EOF5疗效高,不良反应较轻,为确认该方案的临床疗效,我们扩大样本进行了后续的Ⅱ期研究。本文回顾性分析了该两项Ⅱ期研究中接受EOF5一线治疗患者的总生存期(overall survival,OS)、无进展生存期(progress free survival,PFS)、一线后维持治疗、二线治疗及联合局部治疗的结果。
1 资料和方法
1.1 研究对象
本研究回顾性分析了我院的两项EOF5方案治疗转移性胃癌的Ⅱ期临床试验患者共178例。第一项探索性研究进行于2004年—2006年共26例,剔除6例二线治疗患者,其余20例一线治疗患者进入本研究。第二项研究自2007年6月—2012年7月,共163例。其中5例撤销知情同意且之后未接受治疗,实际158例接受了至少1个疗程的治疗,纳入本研究。本研究随访截止日期为2013年3月5日。
1.2 一般资料
所有患者均经病理组织学证实为胃腺癌,经影像学证实为不能手术的晚期或进展期患者,入组临床研究前均有可测量的病灶(螺旋CT直径≥10 mm),靶病灶未接受过放疗。重要脏器(肝肾)功能正常,血常规、心电图正常,无脑转移,无消化道大出血、穿孔及梗阻,预期生存时间>12周。
1.3 治疗方法
所有患者接受EOF5方案化疗:表柔比星50 mg/m2静脉滴注,第1天;奥沙利铂130 mg/m2静脉滴注,第1天;每天5-FU的剂量为375~425 mg/m2,低剂量持续滴注5 d共120 h;每3周重复。治疗持续到进展、不能耐受或患者退出。完成6~8个周期治疗仍达稳定以上疗效的患者,根据患者的意愿、医师的建议决定是否采用氟尿嘧啶类药物维持治疗或观察。氟尿嘧啶类药物包括优福定、卡培他滨、艾丰和替吉奥。
1.4 疗效评估
第一项探索性研究中,有效率的判断采用WHO标准,第二项扩大样本的研究则采用了RECIST 1.0标准。每6周进行疗效评估。本次回顾性分析,将第一项探索性研究的WHO评估的数据按照RECIST标准进行了再评估。
1.5 统计学处理
采用SPSS 15.0进行分析。采用Kaplan-Meier绘制生存曲线进行PFS和OS的分析,各组生存资料间的比较采用Log-rank检验。P<0.05为差异有统计学意义。
医学技术的发展让外科手术的治疗水平有了显著提升,但外科手术患者通常会因为手术治疗出现短暂的功能障碍,在缺乏家属和护理人员陪伴的情况下易出现安全事故,因而对于此类患者的护理工作应重点强化风险管理,分析识别可能产生的风险因素,以此展开针对性的护理工作。
2 结 果
2.1 入组患者临床病理特征
178例患者中位年龄56岁(22~78岁),中位接受5.4个疗程化疗。表1为患者的临床病理特征。除2例局部进展期胃癌外,其余均为转移性患者,男性111例,女性67例,91%的患者有3个以上肿瘤病灶,79.8%为同时性转移的患者,20.2%为异时性转移的患者(异时性患者均为术后复发)。51.1%的患者有后腹膜淋巴结转移,38.2%有肝转移,9.0%有肺转移,21.9%有腹腔积液。65.7%为低分化腺癌,11.8%为中高分化腺癌,另22.5%患者胃腺癌分化情况不详(表1)。
2.2 一线治疗的有效率、PFS和OS结果
178例患者中,8例患者完成1或2个疗程化疗后未来评估,亦未再来治疗。共170例患者能进行疗效评价,其中7例(3.9%)完全缓解(complete response,CR),76例(42.7%)部分缓解(partial response,PR),总有效率(overall response rate,ORR,CR+PR)为46.6%,69例(38.8%)疾病稳定(stable disease,SD),18例(10.1%)疾病进展(progressive disease,PD)。中位PFS为6.0个月(95%CI:5.2~6.8),两项采用EOF5治疗晚期胃癌的Ⅱ期研究OS相似,178例患者的中位OS为12.6个月(95%CI:8.9~16.3),1年生存率为50.9%,2年生存率为28.0%(图1)。

表1 患者的临床病理特征Tab. 1 Patients’ clinicopathological characteristics
2.3 维持治疗结果
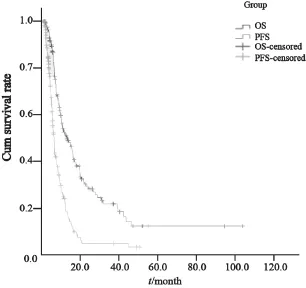
图1 178例患者的总生存及无进展生存时间Fig. 1 The OS and PFS of 178 patients treated with EOF5regimen
本研究中的178例患者,76例在6个疗程内或6个疗程后即评估为进展,因此一线治疗后无维持治疗;8例患者接受了手术达到R0切除或局部放疗后疾病达到临床无瘤状态,未进行维持治疗;另外26例患者一线治疗后是否接受维持治疗不详;剩下的68例患者接受EOF5方案化疗6~8个疗程后,评估达SD以上疗效,其中33例接受了氟尿嘧啶类药物(优福定、希罗达、艾丰或替吉奥)维持治疗,其余35例定期复查未接受维持治疗(其中部分接受中药治疗)。接受维持治疗及未接受维持治疗患者的一线中位PFS及中位OS见图2。维持治疗组中位OS为38.6个月(95%CI:16.4~60.9),而无维持组为19.2个月(95%CI:15.5~22.9,P=0.024)。维持治疗组PFS为11.4个月(95%CI:9.6~13.3),而无维持组为9.0个月(95%CI:7.5~10.4,P=0.079)。
2.4 二线治疗结果
本研究的178例患者中,15例末次随访时仍未进展,24例一线进展后不能耐受或不愿接受二线化疗,64例一线治疗后具体资料不详。剩下的75例患者接受了二线化疗,其中6例完成1个疗程治疗后未继续在本院治疗,其余69例有完整的二线治疗资料。该75例患者二线治疗中位总生存(二线治疗开始计算的总生存时间OS2)为8.0个月(95%CI:4.8~11.2),其中69例完整资料患者的OS2为8.6个月(95%CI:4.0~13.1)。69例患者中,采用伊立替康为主化疗的26例,紫杉类为主化疗的31例,其他12例(包括丝裂霉素、5-FU、顺铂或奥沙利铂)。3种治疗组间二线化疗的中位OS2差异无统计学意义(P=0.423,图3)。
2.5 局部治疗及长期生存患者的分析
本研究30例患者在经化疗后接受了局部治疗(包括手术、放射治疗),其中19例行手术治疗,9例达R0切除,6例为姑息切除术,4例未能切除;11例患者接受了局部病灶放疗,包括2例伽马刀治疗。30例接受局部治疗的患者中位OS为22.4个月(95%CI:8.3~36.5)明显优于其余148例未接受局部治疗患者的10.4个月(95%CI:8.6~12.2,P=0.002,图4)。至随访截止时,15例生存超过36个月的长期存活患者中,9例仅接受单纯化疗,6例化疗基础上还接受了手术或放疗等局部治疗。
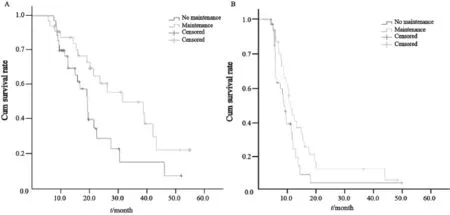
图2 采用5-FU药物维持治疗与否的总生存及无进展生存Fig. 2 The overall survival and progression free survival of patients with or without 5-FU maintenance treatment
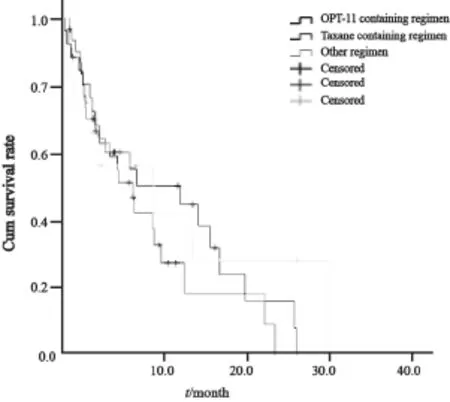
图3 一线EOF5治疗失败后接受不同药物二线化疗的二线总生存结果Fig. 3 The overall survival of second line treatment (OS2) for different kinds of regimen after EOF5 first line treatment
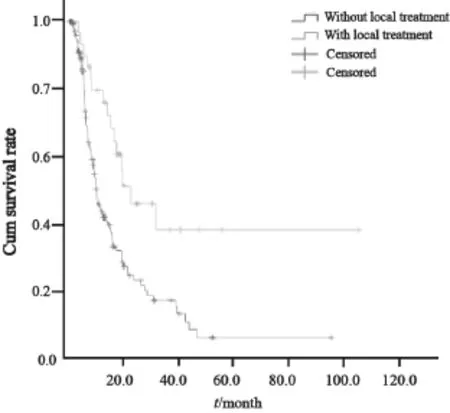
图4 治疗期间接受局部治疗的患者同未接受局部治疗患者的总生存Fig. 4 The overall survival of patients with or without local treatment
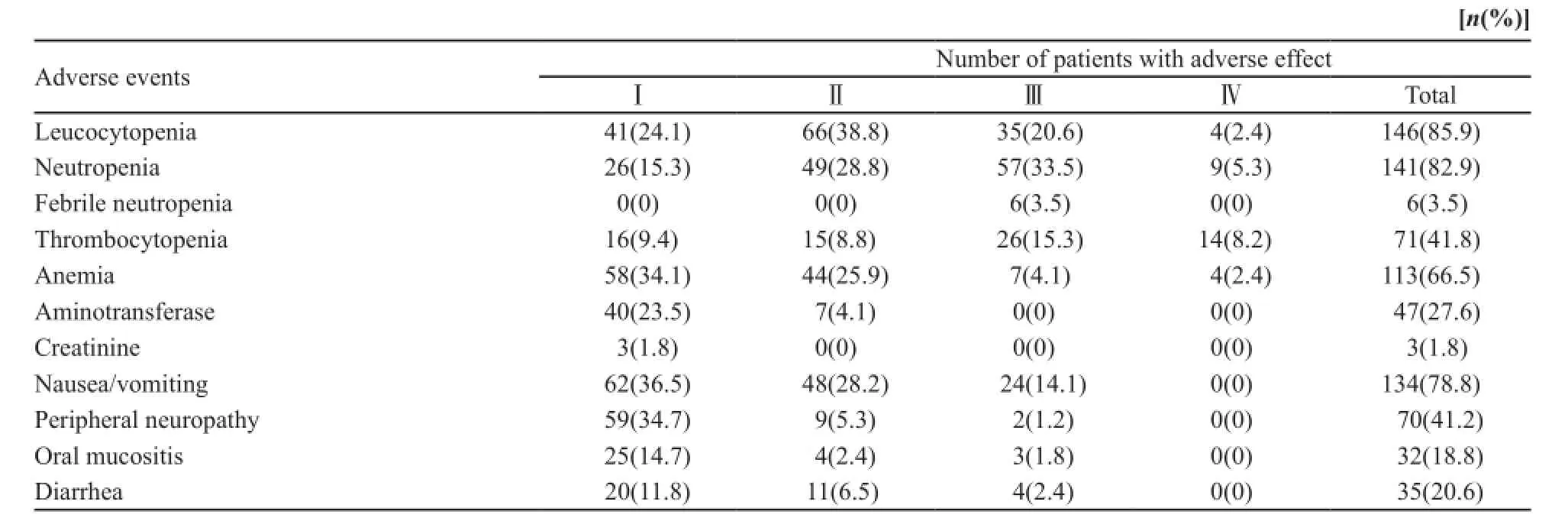
表2 治疗期间的发生的主要不良反应Tab. 2 Adverse events assessed according to National Cancer Institute Common Toxicity Criteria
2.6 常见不良反应分析
本化疗方案引起的主要不良反应见表2。3度以上的不良反应主要有白细胞及中性粒细胞下降、血小板下降、恶心呕吐、手足麻木等外周神经系统不良反应。
3 讨 论
在晚期胃癌的姑息化疗方面,近30年来进展一直比较缓慢。20世纪80年代后期,众多的临床试验研究了以5-FU、顺铂、甲氨蝶呤、表柔比星、丝裂霉素和VP-16等药物的联合方案在胃癌中的临床效果。最终ECF方案(表柔比星、顺铂和5-FU联合)的结果在多个Ⅲ期随机对照研究中得到印证[2-3],两联的FP方案(5-FU和顺铂)的疗效也比较稳定。因此很长一段时间内,ECF及FP尽管未能成为晚期胃癌的标准一线治疗,却常被胃癌的一线Ⅲ期随机对照研究用来作为对照方案[4-6]。
近年来采用ECF方案围手术期化疗的MAGIC研究显示术前ECF化疗能显著降期提高R0切除率,延长OS[8];REAL-2研究一方面再次确认了蒽环类三联方案的疗效,另外也证实了奥沙利铂取代顺铂,卡培他滨取代5-FU在OS上有非劣效性,而卡培他滨取代5-FU还有优效的趋势[4]。因此EOX似乎是蒽环类三联方案中最佳的选择。但卡培他滨一来比较贵,另外一些患者因骨髓抑制、腹泻、手足综合征、消化道反应等不能完成2周的服药,从而导致卡培他滨的剂量强度严重不足。因此持续滴注5-FU仍是临床常用的选择,但若采用标准21 d持续滴注,过长持续滴注时间且无休息期很大程度影响治疗的依从性。因此我们尝试采用短期低剂量5-FU持续滴注120 h的方法在达到较好的依从性和经济性条件下期望获得同经典方案相似的疗效[10]。
我们的研究证明EOF5总体有效率超过了46%(在可评估患者中达48.8%),OS达到了12.6月,1、2年生存率超过50%和28%。这些结果至少同REAL-2研究相当,也不输于其他采用常规化疗的Ⅲ期研究结果[4-9]。目前胃癌一线临床研究中,除联合赫赛汀的ToGA研究[11],OS很少超过12个月(在日本的SPIRITS研究中,OS超过13个月[7],但其入组患者超过1/3为进展期胃癌,非远处转移的患者)。
我们的研究中EOF5治疗后,至少超过42%的患者接受了二线治疗,二线治疗的中位OS达8个月。优于目前2项胃癌二线治疗Ⅲ期随机研究的结果[12-13]。可能以下因素同本研究较高的二线OS有关:①以EOF5作为一线治疗有效率较两联治疗为高,因此肿瘤退缩的程度会较两联为高。肠癌的研究中一线治疗后肿瘤退缩的最大程度同一线进展后的生存时间正相关[14-15],对于进展后即接受二线化疗的患者,其二线治疗的OS基本等同于一线进展后生存时间;②本研究中我们的二线化疗多为两联方案,而发表的2项二线Ⅲ期研究中都只采用单药治疗;③我们的资料因部分患者一线进展后未继续在我院治疗,后续治疗不详仅能随访到OS,因此可能未涵盖所有接受二线治疗的患者,有一定偏倚。
一线EOF5化疗6个疗程后达到SD以上的患者,根据患者的意愿及医师的建议,一部分患者选择了维持治疗。同选择观察(多数为中药调理)的患者相比,PFS存在较明显差异,OS差异有统计学意义。但由于我们并未采用随机分组,不能排除在选择维持治疗抑或支持治疗时存在诸如研究者、患者经济条件、体力情况等方面的偏倚,因此尚不能确认维持治疗优于观察。不过,该现象值得进一步研究明确。由于维持治疗可以看成是出现不能耐受的不良反应时原方案的减量,而持续治疗到进展仍是目前常规策略之一,因此对可以耐受的患者,单药维持治疗到进展仍是临床中可接受的选择。事实上,诸如AVAGAST、EXPAND等大型临床研究都采用单药5-FU类药物维持治疗的策略[16-17]。
我们的研究中,通过姑息化疗,部分患者的肿瘤病灶缩小消失,或仅余部分残留病灶,后续接受了手术或局部放疗。局部治疗的患者同未接受局部治疗的患者相比有明显的生存优势。作为非随机对照研究,本研究不是为明确局部治疗是否延长OS而设计。但数例存在腹膜转移、肝转移的患者,化疗后再次手术结合后续化疗巩固,得以长期保持无瘤状态(1例已存活超过7年,3例已存活3~5年,随访截止时均保持无瘤状态),2例锁骨上淋巴结转移的患者化疗后局部放疗至随访截止未复发,已分别存活40个月和18个月。这些证据说明在一些选择性的患者中,局部治疗的加入可能使患者获益,因此姑息化疗中何种患者适合联合何种局部治疗值得进一步研究。
通过我们178例患者的资料证明了EOF5是一个有效率高、毒性可控的胃癌一线化疗方案,同经典ECF方案及其改良方案相比,疗效及生存数据类似,不良反应未增加,但操作更简单,依从性更好,可以作为目前晚期胃癌一线治疗的选择之一。
[1] VAN CUSTEM E, VAN DE VELDE C, ROTH A, et al. Expert opinion on management of gastric and gastro-esophageal junction adenocarcinoma on behalf of the European Organization for Research and Treatment of Cancer (EORTC)-gastrointestinal cancer group [J]. Eur J Cancer, 2008, 44(2): 182-194.
[2] ROSS P, NICOLSON M, CUNNINGHAM HAM D, et al. Prospective randomized trial comparing mitomycin, cisplatin, and protracted venous-infusion fluorouracil (PVI 5-FU)with epirubicin, cisplatin, and PVI 5-FU in advanced esophagogastric cancer[J]. J Clin Oncol, 2002, 20(8): 1996-2004.
[3] WEBB A, CUNNINGHAM HAM D, SCARFFE J H, et al. Randomized trial comparing epirubicin, cisplatin, and fluorouracil versus fluorouracil, doxorubicin, and methotrexate in advanced esophagogastric cancer[J]. J Clin Oncol, 1997, 15(1): 261-267.
[4] CUNNINGHAM HAM D, STARLING N, RAO S, et al. Capecitabine and oxaliplatin for advanced esophagogastric cancer[J]. N Engl J Med, 2008, 358(1): 36-46.
[5] VAN CUTSEM E, MOISEYENKO V M, TJULANDIN S, et al. V325 Study Group. Phase Ⅲ study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group[J]. J Clin Oncol, 2006, 24(31): 4991-4997.
[6] KANG Y K, KANG W K, SHIN D B, et al. Capecitabine/ cisplatin versus 5-fluorouracil/cisplatin as first-line therapy in patients with advanced gastric cancer: a randomized phaseⅢ non-inferiority trial[J]. Ann Oncol, 2009, 20(4): 666-673.
[7] KOIZUMI W, NARAHARA H, HARA T, et al. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer (SPIRITS trial): a phase Ⅲ trial[J]. Lancet Oncol, 2008, 9(3): 215-221.
[8] CUNNINGHAM D, ALLUM W H, STENNING S P, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer[J]. N Engl J Med, 2006, 355(6): 11-20.
[9] WADDELL T, CHAU I, CUNNINGHAM HAM D, et al. Epirubicin, oxaliplatin, and capecitabine with or without panitumumab for patients with previously untreated advanced oesophagogastric cancer (REAL3): a randomised, open-label phase 3 trial [J]. Lancet Oncol, 2013, 14(6): 481-489.
[10] ZHU X, LEAW J, GU W, et al. Phase Ⅱ clinical trial of advanced and metastatic gastric cancer based on continuous infusion of 5-fluorouracil combined with epirubicin and oxaliplatin[J]. J Cancer Res Clin Oncol, 2008, 134(9): 929-936.
[11] BANG Y J, VAN CUTSEM E, FEYEREISLOVA A, et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial[J]. Lancet, 2010, 376(9742): 687-697.
[12] KANG J H, LEE S I, LIMDO H, et al. Salvage chemotherapy for pretreated gastric cancer: a randomized phase Ⅲ trial comparing chemotherapy plus best supportive care with best supportive care alone[J]. J Clin Oncol, 2012, 30(13): 1513-1518.
[13] FORD H E, MARSHALL A, BRIDGEWATER J A, et al. Docetaxel versus active symptom control for refractory oesophagogastric adenocarcinoma (COUGAR-02): an openlabel, phase 3 randomised controlled trial[J]. Lancet Oncol, 2014, 15(1): 78-86.
[14] MANSMANN U R, SARTORIUS U, LAUBENDER R P, et al. Deepness of response: A quantitative analysis of its impact on post-progression survival time after first-line treatment in patients with mCRC [M]. J Clin Oncol, 2012 (suppl 34; abstr 427): 30.
[15] MANSMANN U R, SARTORIUS U, LAUBENDER R P, et al. Quantitative analysis of the impact of deepness of response on post-progression survival time following first-line treatment in patients with mCRC [M]. J Clin Oncol, 2013 (suppl; abstr 3630): 31.
[16] OHTSU A, SHAH M A, VAN CUTSEM E, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase Ⅲ study [J]. J Clin Oncol, 2011, 29(30): 3968-3976.
[17] LORDICK F, KANG Y K, CHUNG H C, et al. Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial [J]. Lancet Oncol, 2013, 14(6): 490-499.
The clinical evaluation of EOF5regimen, the combination of epirubicin, oxaliplatin and 5-day continuous infusion of 5-FU, for patients with advanced/metastatic gastric cancer
ZHU Xiao-dong,
ZHAO Xiao-ying, PENG Wei, SUN Si, CAO Jun, JI Dong-mei, LIU Xin, WANG Chen-chen, YU Hui, LI Jin, YIN Ji-liang
(Department of Medical Oncology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
YIN Ji-liang E-mail: nettyjl@hotmail.com
Background and purpose: Although there is still no standard first line chemotherapy regimen for metastatic gastric cancer (MGC), the doublet and triplet regimens containing platinum and fl uorouracil were most popular worldwidely. The ECF regimen is the classical and one of the most popular treatment choices in this setting, while the marrow suppression, the renal toxicity and poor compliance inhibits its usage. In order to improve its ef ficacy and tolerability, this study conducted 2 phase Ⅱ trials by modified ECF regimen, the EOF5regimen (substituting cisplatin with oxaliplatin, shortening the continuous infusion period to 120 h), to treat patients with MGC since 2004. This paper reported the comprehensive results of the 2 studies. Methods: All the patients who enrolled in our previous2 phase Ⅱ trials and received EOF5as first line treatment entered this study. Each patient received the treatment of epirubicin 50 mg/m2iv d1, oxaliplatin 130 mg/m2iv gtt d1 and 5-FU 375-425 mg/m2·d-1civ 120 h, and repeated every 3 weeks. Ef ficacy was analyzed every 6 weeks. Results: A total number of 178 patients (all were metastatic patients but 2 advanced patients with unresectable lesions) were included into this study. One hundred and seventy patients were evaluable, and 7 patients (3.9%) achieved complete response (CR), 76 patients (42.7%) achieved partial response (PR), 46.6% patients achieved overall response rate (ORR, CR+PR), and the cases of stable disease (SD) and progressive disease (PD) were 69 (38.8%) and 18 (10.1%), respectively. The median progress free survival (PFS) and overall survival (OS) were 6.0 months (95%CI: 5.2-6.8) and 12.6 months (95%CI: 8.9-16.3), 1-year and 2-year survival rate were 50.9% and 28.0%, respectively. Grade 3, 4 toxicity including: leucopenia (23.0), neutropenia (38.8%), anemia (6.5%), thrombocytopenia (23.5%), nausea/vomiting (14.1%), and peripheral neuropathy toxicity (1.2%). Among 75 patients who received second line treatment, the median survival from second line treatment was 8.0 months (95%CI: 4.8-11.2). Conclusion: EOF5regimen is a highly effective regimen with moderate and manageable toxicity, and it providesa suitable alternative for the first-line treatment of MGC.
Gastric cancer; Combination chemotherapy; Epirubicin; Oxaliplatin; 5- fl uorouracil
10.3969/j.issn.1007-3969.2014.08.010
R735.2
A
1007-3639(2014)08-0615-07
2014-05-04
2014-06-05)
印季良 E-mail:nettyjl@hotmail.com

